胆道闭锁(biliary atresia, BA)是一种进行性纤维化梗阻性胆管疾病,主要涉及肝脏和肝内胆管系统[1]。如未经治疗,患者肝脏会迅速纤维化,导致门脉高压症和终末期肝病,病死率极高。因此,了解BA所致肝纤维化的病理机制尤为重要。
上皮间质转化(epithelial-mesenchymal transition, EMT)的分子基础是细胞失去正常的上皮特征,如细胞间黏附分子缺如,并获得间充质表型[2]。近年来研究发现,胆管上皮细胞的EMT可能与某些慢性肝胆疾病的导管周围纤维化和门静脉纤维化有关[3-6]。血小板源性生长因子(platelet-derived growth factor, PDGF)是包括成纤维细胞和平滑肌细胞等间充质来源细胞的主要有丝分裂原(诱发有丝分裂或细胞分裂过程的任何物质)[5, 7]。肿瘤上皮细胞或内皮细胞高表达PDGF-BB,通过向新生血管招募外膜细胞促进血管生成,并促进其分化为成纤维细胞样表型[8-9]。Snail 1是一种锌指转录因子,在EMT的启动中起关键作用[10]。而在BA的肝组织中PDGF-BB的表达及其与EMT的关系尚不清楚。本文通过免疫组织化学法和实时荧光定量PCR法检测BA患儿肝脏中PDGF-BB、Snail 1、E钙黏素(E-cadherin)和N钙黏素(N-cadherin)在蛋白和mRNA水平上的表达,并分析他们之间的关系,以期为BA的诊断和治疗提供新的科研依据。
资料与方法 一、研究对象选取2018年1月至2019年12月河北医科大学第二医院小儿外科收治的50例患儿,男28例,女22例,年龄(67±8)d。其中BA 25例(BA组),胆总管囊肿15例(choledochal cyst, CCC组)、正常对照10例(NL组)。BA组入选标准:①月龄<6个月,临床资料完整;②均接受Kasai手术治疗与肝活检手术(取肝尾叶约0.5 cm×0.5 cm× 0.5 cm大小组织为活检组织,术后留取组织标本),手术期间均确诊为BA。CCC组入选标准:①月龄<6个月,临床资料完整;②术前均无肝功能受损或者胆道梗阻现象;③均接受胆总管囊肿根治手术与肝活检手术(取肝尾叶约0.5 cm×0.5 cm× 0.5 cm大小组织为活检组织,术后留取组织标本),手术期间确诊为先天性胆总管囊肿。NL组入选标准:①月龄<6个月,为同期手术的肝脏错构瘤、肝母细胞瘤患儿,临床资料完整;②术前均无肝功能受损或者胆道梗阻现象;③术前肝功能检查结果均显示正常;④均接受手术治疗(术后取肿物旁正常肝组织为组织标本)。排除标准:①凝血功能差或伴其他疾病不能耐受手术及麻醉的患儿;②术后2个月内接受肝移植患儿。BA组、CCC组分别于全身麻醉下实施肝门- 空肠吻合术(Kasai术式)、胆道探查或重建术,收集患儿肝组织。
手术前收集患儿的临床病理数据包括年龄、性别、白蛋白、总胆红素、直接胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶和γ-谷氨酰转移酶。上述标本的获取均取得患儿监护人的知情同意,并经河北医科大学第二医院伦理委员会批准(2021—R381)。
二、主要试剂免疫组化染色试剂盒、浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司,PDGF-BB兔多克隆抗体(bs-1316R)和Snail 1兔多克隆抗体(bs-1371R)购自北京博奥森公司,E-cadherin兔多克隆抗体(PB0583)和N-cadherin兔多克隆抗体(BA0673)购自武汉博士德生物工程有限公司,抗原修复液购自基因科技上海有限公司。TRIzol购自美国Invirogen公司,Platinum SYBR SuperMix试剂,逆转录试剂盒购自美国Promega公司,PCR引物购自锐博公司。
三、实时荧光定量PCR检测三组患儿肝组织PDGF-BB、Snail 1、E-cadherin和N-cadherin mRNA的表达用TRIzol试剂提取BA组、CCC组、NL组肝组织的总RNA,按照反转录试剂盒和实时荧光定量PCR试剂盒说明书提供的方法进行反转录,并利用实时荧光定量PCR方法检测PDGF-BB、Snail 1、E-cadherin和N-cadherin的表达量,GAPDH为内参。表 1列出了PDGF-BB、Snail 1、E-cadherin、N-cadherin和GAPDH的引物序列。PCR反应条件:95℃预变性5 min;95℃ 15 s、60℃ 1 min,共40个循环;72℃ 5 min。以2-△△Ct法计算三组肝组织中PDGF-BB、Snail 1、E-cadherin和N-cadherin mRNA的相对表达水平。
| 表 1 实时荧光定量PCR引物序列 Table 1 Sequences of real-time PCR primers |
|
|
将石蜡病理切片按照试剂盒说明书方法检测PDGF-BB、Snail 1、E-cadherin和N-cadherin蛋白的表达情况。PDGF-BB、Snail 1、E-cadherin和N-cadherin抗体分别以1∶200、1∶200、1∶200和1∶100稀释,二抗和辣根过氧化酶标记的链酶卵白素均为试剂盒中的原液,加入DAB试剂显色后,用苏木精对比染色,中性树胶封片后于显微镜下观察染色情况。
免疫组化染色以细胞质或细胞核或细胞膜内出现棕黄色颗粒定义为阳性细胞,采用双盲法观察切片全部视野,采用半定量积分法判断结果,标准如下:①阳性细胞数≤5%为0分,6% ~25%为1分,26% ~50%为2分,51% ~75%为3分,>76%为4分;②染色阳性强度,无着色为0分;黄色为1分;棕黄色为2分;深棕色为3分。将①和②两者积分相乘所得数值≤2分定义为阴性表达,>2分定义为阳性表达[11]。以PBS代替一抗作为阴性对照。
肝脏纤维化分级:标本采用Masson染色。参照Ohkuma's分级标准对肝脏纤维化程度进行划分:Ⅰ级为肝门管区轻度纤维化,Ⅱ级为邻近门管区轻度桥接纤维化,Ⅲ级为伸向邻近门管区重度桥接纤维化,Ⅳ级为假小叶及肝硬化形成。
Masson的三色染色是根据制造商的规程(GENMED SCIENTIFICS INC, USA)进行的。胶原纤维被染成蓝色,细胞核被染成黑色,背景被染成红色。肝纤维化根据Metavir分级系统16评估如下:F0代表无纤维化,F1代表门脉区域轻度纤维化,F2代表邻近门脉区域轻度桥接纤维化,F3代表邻近门脉区域严重桥接纤维化,F4代表肝硬化和环形纤维化伴结节形成。
五、统计学处理采用SPSS 22.0进行数据分析。计数资料用频数、构成比表示,各免疫组化指标阳性率比较采用χ2检验;服从正态分布的计量资料用x±s表示,组间比较用F检验,两两比较采用LSD检验;各指标相关性分析采用Spearman等级相关;P<0.05为差异有统计学意义。
结果 一、BA组、CCC组和NL组患儿临床病理参数对比所有患儿的临床病理参数特征如表 1所示。BA组、CCC组及NL组白蛋白、碱性磷酸酶水平差异无统计学意义(P>0.05)。BA组、CCC组及NL组总胆红素、直接胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、γ-谷氨酰转移酶水平差异有统计学意义(P<0.05);其中BA组与CCC组总胆红素、直接胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、γ-谷氨酰转移酶水平差异有统计学意义(P<0.05),BA组与NL组总胆红素、直接胆红素、丙氨酸转氨酶、天冬氨酸转氨酶、γ-谷氨酰转移酶水平差异有统计学意义(P<0.05),CCC组及NL组总胆红素、直接胆红素、谷丙转氨酶、谷草转氨酶、γ-谷氨酰转移酶水平差异无统计学意义(P>0.05)。
二、BA组、CCC组和NL组患儿肝组织PDGF-BB、Snail 1、E-cadherin和N-cadherin mRNA的表达BA组、CCC组及NL组患儿肝组织中PDGF-BB mRNA、Snail 1 mRNA、E-cadherin mRNA、N-cadherin mRNA的相对表达量差异有统计学意义(P<0.05)。BA组中PDGF-BB mRNA、Snail 1 mRNA、N-cadherin mRNA的相对表达量显著高于CCC组和NL组,差异有统计学意义(P<0.05),BA组中E-cadherin mRNA的相对表达量显著低于CCC组和NL组,差异有统计学意义(P<0.05),而CCC组和NL组中PDGF-BB mRNA、Snail 1 mRNA、E-cadherin mRNA、N-cadherin mRNA的相对表达量差异无统计学意义(P>0.05)。见表 3。
| 表 2 胆道闭锁组、胆总管囊肿组和对照组患儿临床病理参数(x±s) Table 2 Clinicopathological parameters of three groups(x±s) |
|
|
| 表 3 胆道闭锁组、胆总管囊肿组和对照组患儿肝组织中PDGF-BB、Snail 1、E-cadherin和N-cadherinmRNA的表达情况(x±s) Table 3 Expression of PDGF-BB, Snail 1, E-cadherin and N-cadherin mRNA in liver tissues of three groups(x±s) |
|
|
PDGF-BB阳性产物主要定位于细胞质和细胞核(图 1A至图 1C);Snail 1阳性产物主要定位于细胞质和细胞核(图 1D至图 1F);E-cadherin阳性产物主要定位于细胞膜和细胞质(图 1G至图 1I);N-cadherin阳性产物主要定位于细胞质,部分表达于细胞膜中(图 1J至图 1L)。BA组、CCC组及NL组患儿肝组织PDGF-BB蛋白、Snail 1蛋白、E-cadherin蛋白、N-cadherin蛋白的阳性表达率差异有统计学意义(P<0.05)。BA组PDGF-BB蛋白、Snail 1蛋白、N-cadherin蛋白的表达率显著高于CCC组和NL组,差异有统计学意义(P<0.05),BA组E-cadherin蛋白的表达率显著低于CCC组和NL组,差异有统计学意义(P<0.05),而CCC组和NL组PDGF-BB蛋白的表达率差异无统计学意义(P=1.00)。
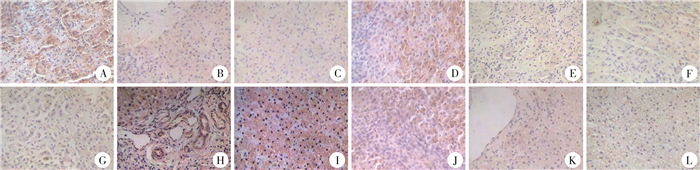
|
图 1 胆道闭锁组患儿肝组织中PDGF-BB、Snail 1、E-cadherin和N-cadherin蛋白的表达情况(SP染色,×400) Fig.1 Immunohistochemical expressions of PDGF-BB, Snail 1, E-cadherin and N-cadherin in liver tissues (SP, ×400) 注 A: PDGF-BB在BA组肝组织中强表达;B: PDGF-BB在CCC组肝组织中弱表达;C: PDGF-BB在NL组肝组织中弱表达;D: Snail 1在BA组肝组织中强表达;E: Snail 1在CCC组肝组织中弱表达;F: Snail 1在NL组肝组织中弱表达;G: E-cadherin在BA组肝组织中弱表达;H: E-cadherin在CCC组肝组织中强表达;I: E-cadherin在NL组肝组织中强表达;J: N-cadherin在BA组肝组织中强表达;K: N-cadherin在CCC组肝组织中弱表达;L: N-cadherin在NL组肝组织中弱表达; BA: 胆道闭锁;CCC: 胆总管囊肿 |
PDGF-BB与Snail 1 mRNA的表达呈正相关(r=0.772,P<0.05);PDGF-BB与E-cadherin mRNA表达呈负相关(r=-0.756,P<0.05);PDGF-BB与N-cadherin mRNA表达呈正相关(r=0.835,P<0.05);Snail 1与E-cadherin mRNA表达呈负相关(r=-0.720,P<0.05);Snail 1与N-cadherin mRNA表达呈正相关(r=0.723,P<0.05)。
五、PDGF-BB、Snail 1、E-cadherin和N-cadherin蛋白表达的相关性PDGF-BB与Snail 1蛋白的表达呈正相关(r=0.780,P<0.05);PDGF-BB与E-cadherin蛋白表达呈负相关(r=-0.696,P<0.05);PDGF-BB与N-cadherin蛋白表达呈正相关(r=0.702,P<0.05);Snail 1与E-cadherin蛋白表达呈负相关(r=-0.636,P<0.05);Snail 1与N-cadherin蛋白表达呈正相关(r=0.702,P<0.05)。
六、PDGF-BB、Snail 1、E-cadherin和N-cadherin表达与肝纤维化程度的相关性肝纤维化程度与PDGF-BB表达呈正相关(r=0.977,P<0.05);肝纤维化程度与E-cadherin蛋白表达呈负相关(r=-0.722,P<0.05);肝纤维化程度与N-cadherin蛋白表达呈正相关(r=0.711,P<0.05);肝纤维化程度与Snail 1表达呈正相关(r=-0.810,P<0.05)。
讨论BA是以肝内胆管大量增生、胆道炎性和纤维化性闭塞为病理特点的疾病,即便早期给予Kasai手术,大多数患儿仍会出现进行性肝纤维化,预后极差。近年来研究发现EMT是增加纤维细胞数量的重要病理途径,被认为是肝纤维化中产生肌成纤维细胞的机制之一。最新研究显示,过度活化的Hedgehog信号通路和肝内胆管的EMT是BA的显著特征,这可能与胆道畸形和纤维化有关[11]。因此,我们力求寻找EMT形成的相关机制,阻止纤维化进展,为患儿的临床治疗提供理论依据。目前,BA患儿肝脏组织中PDGF-BB、Snail 1、E-cadherin和N-cadherin的关系,尚不明确。
一、EMT相关蛋白在BA患儿中的表达情况在上皮细胞获得间充质表型的过程中,E-钙黏蛋白表达降低[12]。波形蛋白的出现、E-钙黏蛋白表达降低以及N-钙黏蛋白表达增高被认为是EMT的特征[13]。本研究显示,与非BA组患儿相比,BA组患儿肝组织中N-cadherin、Snail 1高表达,且与肝纤维化程度呈正相关;E-cadherin低表达,且与肝纤维化程度呈负相关。近年来,有关肝细胞、胆管细胞、肝星状细胞的体外研究发现,这些细胞在刺激因子的作用下,同时表达上皮和间质细胞的蛋白标志物,并具有间质细胞的表型和移动性,即发生EMT[14]。E-cadherin参与同型细胞间的黏附连接且维持细胞极性,在维持上皮细胞形态及组织结构完整中发挥极其重要的作用。N-cadherin作用相反,结果提示BA患儿肝脏中EMT形成,并参与了肝纤维化过程。
锌指转录调控因子Snail 1作为EMT相关转录因子之一,调控E-cadherin的表达水平,同时也是EMT发生过程中的一个关键因子[15]。最新研究表明,Hedgehog通路参与EMT导致的肝纤维化过程。Hedgehog(Hh) 蛋白是一种由上皮细胞分泌的信号蛋白,具有调节组织损伤后重建和再生的功能。可溶性Hh配体(SonicHh、Indian Hh和Desert Hh)与Hh反应性细胞上的Patched(Ptc) 受体相互作用,这种配体- 受体相互作用可防止Ptc抑制其共受体Smo。激活的Smo反过来会引发一系列细胞内反应,最终导致胶质母细胞瘤家族转录因子的激活和核定位,从而促进了Snail和Twist的表达,诱导EMT的发生[16]。结合本研究结果,Snail可通过调控E-cadherin促进EMT的过程。
二、PDGF-BB在BA患儿肝组织中的表达近期研究发现,PDGF-BB可诱导肿瘤相关内皮细胞中NF- B介导的Snail 1表达[17]。在此前提下,我们研究了PDGF-BB在三组中的表达情况,BA患儿肝脏中PDGF-BB mRNA水平和蛋白水平的表达均高于CCC组和NL组(P<0.05),且与Snail的表达呈正相关,同时PDGF-BB的表达与肝纤维化程度呈正相关。
肝纤维化中肌成纤维细胞的主要来源是活化的肝星状细胞(hepatic stellate cells,HSC)。PDGF-BB已被证实在刺激HSC生长和相关细胞间信号传递方面具有重要意义[17]。HSC可通过EMT促进肝纤维化[14]。研究表明,PDGF-BB可诱导肿瘤相关内皮细胞中NF- B介导的Snail 1,提示PDGF-BB可通过激活HSC或调节Snail 1,参与EMT促进肝纤维化[18]。
由于临床标本获得较为困难,本研究样本量有限,可能会影响统计结果,后续本课题组将扩大样本量或进行多中心研究,进一步深入研究其具体机制,以期为BA患儿的诊疗提供新的理论依据。总之,BA患儿肝内外胆管中PDGF-BB可能通过增强转录因子Snail 1的转录活性,降低E-cadherin蛋白及增强N-cadherin蛋白的表达,促进其发生EMT。进而推测,如若减少BA患儿PDGF-BB的表达,或封闭其相应受体,可延缓EMT的发生;而这可能成为BA患儿诊疗的新方向。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 李索林、仲智勇、周辉负责研究的设计、实施和起草文章;方燕斌、杨晓锋、进行病例数据收集及分析;李索林、时保军负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Safwan M, Ramachandran P, Vij M, et al. Impact of ductal plate malformation on survival with native liver in children with biliary atresia[J]. Pediatr Surg Int, 2015, 31(9): 837-843. DOI:10.1007/s00383-015-3728-6 |
| [2] |
Thiery JP, Acloque H, Huang RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871-890. DOI:10.1016/j.cell.2009.11.007 |
| [3] |
孙雪, 任红霞. 胆道闭锁发生与肝纤维化的分子机制研究进展[J]. 临床小儿外科杂志, 2019, 18(5): 432-436. Sun X, Ren HX. Research advances in molecular mechanisms of biliary atresia and hepatic fibrosis[J]. J Clin Ped Sur, 2019, 18(5): 432-436. DOI:10.3969/j.issn.1671-6353.2019.05.019 |
| [4] |
Zhang CY, Yuan WG, He P, et al. Liver fibrosis and hepatic stellate cells: Etiology, pathological hallmarks and therapeutic targets[J]. World J Gastroenterol, 2016, 22(48): 10512-10522. DOI:10.3748/wjg.v22.i48.10512 |
| [5] |
Ying HZ, Chen Q, Zhang WY, et al. PDGF signaling pathway in hepatic fibrosis pathogenesis and therapeutics (Review)[J]. Mol Med Rep, 2017, 16(6): 7879-7889. DOI:10.3892/mmr.2017.7641 |
| [6] |
Weiskirchen R, Weiskirchen S, Tacke F. Organ and tissue fibrosis: molecular signals, cellular mechanisms and translational implications[J]. Mol Aspects Med, 2019, 65: 2-15. DOI:10.1016/j.mam.2018.06.003 |
| [7] |
Jain MK, Adams-Huet B, Terekhova D, et al. Acute and chronic immune biomarker changes during interferon/ribavirin treatment in HIV/HCV co-infected patients[J]. J Viral Hepat, 2015, 22(1): 25-36. DOI:10.1111/jvh.12226 |
| [8] |
Wu X, Liu GZ, Mu M, et al. Augmenter of liver regeneration gene therapy using a novel minicircle DNA vector alleviates liver fibrosis in rats[J]. Hum Gene Ther, 2016, 27(11): 880-891. DOI:10.1089/hum.2016.006 |
| [9] |
Shah R, Reyes-Gordillo K, Rojkind M. Thymosin β4 inhibits PDGF-BB induced activation, proliferation, and migration of human hepatic stellate cells via its actin-binding domain[J]. Expert Opin Biol Ther, 2018, 18(sup1): 177-184. DOI:10.1080/14712598.2018.1478961 |
| [10] |
Maturi V, Morén A, Enroth S, et al. Genomewide binding of transcription factor Snail1 in triple-negative breast cancer cells[J]. Mol Oncol, 2018, 12(7): 1153-1174. DOI:10.1002/1878-0261.12317 |
| [11] |
Cheng JC, Auersperg N, Leung PCK. TGF-beta induces serous bo-rderline ovarian tumor cell invasion by activating EMT but triggers apoptosis in low-grade serous ovarian carcinoma cells[J]. PLoS One, 2012, 7(8): e42436. DOI:10.1371/journal.pone.0042436 |
| [12] |
Díaz R, Kim JW, Hui JJ, et al. Evidence for the epithelial to mesenchymal transition in biliary atresia fibrosis[J]. Hum Pathol, 2008, 39(1): 102-115. DOI:10.1016/j.humpath.2007.05.021 |
| [13] |
Canesin G, Cuevas EP, Santos V, et al. Lysyl oxidase-like 2(LO-XL2) and E47 EMT factor: novel partners in E-cadherin repression and early metastasis colonization[J]. Oncogene, 2015, 34(8): 951-964. DOI:10.1038/onc.2014.23 |
| [14] |
Xie GH, Diehl AM. Evidence for and against epithelial-to-mesenchymal transition in the liver[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305(12): G881-G900. DOI:10.1152/ajpgi.00289.2013 |
| [15] |
Doble BW, Woodgett JR. Role of glycogen synthase kinase-3 in cell fate and epithelial-mesenchymal transitions[J]. Cells Tissues Organs, 2007, 185(1/3): 73-84. DOI:10.1159/000101306 |
| [16] |
Syn WK, Choi SS, Liaskou E, et al. Osteopontin is induced by hedgehog pathway activation and promotes fibrosis progression in nonalcoholic steatohepatitis[J]. Hepatology, 2011, 53(1): 106-115. DOI:10.1002/hep.23998 |
| [17] |
彭龙希, 高思楠, 王媛, 等. 青蒿琥酯在大鼠体内外抗肝纤维化的作用[J]. 中国药理学通报, 2016, 32(5): 658-663. Peng LX, Gao SN, Wang Y, et al. Effect of artesunate on rat liver fibrogenesis in vitro and in vivo[J]. Chin Pharmacol Bull, 2016, 32(5): 658-663. DOI:10.3969/j.issn.1001-1978.2016.05.013 |
| [18] |
Chang KK, Yoon C, Yi BC, et al. Platelet-derived growth factor receptor-α and-β promote cancer stem cell phenotypes in sarcomas[J]. Oncogenesis, 2018, 7(6): 47. DOI:10.1038/s41389-018-0059-1 |
 2023, Vol. 22
2023, Vol. 22


