2. 上海嘉会国际医院小儿骨科, 上海 200031;
3. 上海嘉会国际医院小儿内科, 上海 200031
2. Department of Pediatric Orthopedics, Shanghai Jiahui International Hospital, Shanghai 200031, China;
3. Department of Pediatrics, Shanghai Jiahui International Hospital, Shanghai 200031, China
动脉瘤样骨囊肿(aneurysmal bone cyst, ABC)是一种少见的具有潜在侵袭性的骨良性病变,可导致局部疼痛和肿胀[1]。随着病变范围扩大可出现病理性骨折、跛行或肿胀,目前通常采用切除、刮除及植骨术等进行治疗。发生于骨盆的ABC占所有ABC的8% ~12%,由于骨盆ABC部位特殊,术中止血困难,易损伤髋臼、骶髂关节及附近的重要神经血管束和盆腔脏器,给治疗带来极大的挑战。自2013年Lange等[2]首次应用地舒单抗治疗ABC以来,越来越多的报道显示地舒单抗治疗ABC效果满意。上海嘉会国际医院采用地舒单抗治疗儿童骨盆ABC 1例,现报道如下。
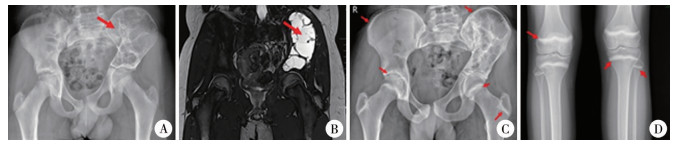
患儿男,12岁,法国籍;因右髋活动后疼痛5年,于本院行骨盆X线平片及MRI,提示左髂骨膨胀性多房囊性改变,内充满液体,考虑动脉瘤样骨囊肿(图 1A、1B)。后返回法国当地医院治疗,病理活检证实为动脉瘤样骨囊肿,予无水酒精注射治疗(每3个月1次),2个疗程后返回中国,中断治疗。6个月前出现左髋疼痛,1个月后加重伴行走不能,为进一步诊治就诊于我科。患者一般情况可,精神胃纳可,睡眠可,大小便正常。无其他特殊既往病史。本研究经上海嘉会国际医院伦理委员会审批通过(A-CR-2023002),患儿家属知情同意。
|
图 1 动脉瘤样骨囊肿患者骨盆影像学表现 Fig.1 Pelvic and lower extremity images of a child in different periods 注 A:X线平片显示左侧髂骨广泛不规则透亮影(箭头所示);B:MRI提示左髂骨T2W1高信号病灶,液液平(箭头所示);C:地舒单抗治疗11个疗程后骨盆X线平片提示少许骨化;同时两侧髂骨翼、髋臼、股骨颈及大转子处硬化带形成(箭头所示);D:停药后3个月下肢X线平片,双侧股骨下端、胫腓骨上端生长板硬化带形成(箭头所示) |
体格检查:双下肢等长,左髂骨处见陈旧性手术瘢痕,左髋关节外展轻度受限,内收可,左侧髂骨翼轻度压痛,骨盆略左侧倾斜;膝关节、踝关节及右侧髋关节活动可,足背动脉搏动可,足趾颜色正常,末梢循环可,双上肢无特殊,脊柱外观未见畸形。查骨盆X线平片及骨盆MRI提示左髂骨多房囊性改变以及骨盆陈旧性骨折可能。
根据患儿病史、体征及影像学检查结果,结合病理诊断,考虑为骨盆ABC。因骨盆ABC为难治性ABC,手术风险高,且该患儿硬化治疗效果不明显;经儿童骨科、儿童内分泌科、儿童内科、肿瘤科、儿童外科、病理科及药剂科等多学科会诊、讨论,充分告知家属治疗相关信息,并与其法国主治医生沟通,家长签署知情同意书,于2021年1月开始行地舒单抗120 mg皮下注射治疗。为防止低钙血症等并发症发生及观察患者的适应性,起初每2周行1次皮下注射,连续3次;后每个月1次,连续8次;共计11个疗程。患者在第3个疗程后4周因腹泻4 d伴手指麻木3 d就诊,血清钙为1.46 mmol/L (正常值为2.1~2.55 mmol/L),血磷为0.94 mmol/L(正常值为1.19~1.74 mmol/L),血甲状旁腺素(parathyroid hormone, PTH)为22.9 pmol/L(正常值为1.6~6.9 pmol/L),为严重低钙血症、低磷血症及继发性甲状旁腺功能亢进。予补钙后低钙血症纠正,后血钙水平趋于平稳并维持整个治疗过程,低血磷在低钙血症纠正后逐步恢复,高PTH血症在低钙血症纠正后4个月恢复正常,25-羟维生素D一直保持正常水平。在注射6个疗程后,患者左髋疼痛明显消失,可直立行走。第11个疗程后,测血清骨转换标志物骨钙素为33.23 ng/mL(正常值为9.8~26.4 ng/mL)、骨性碱性磷酸酶为18.08 ug/L,Ⅰ型胶原前肽氨基端及Beta胶联降解产物均在正常范围;复查骨盆X线平片病灶骨化少许,两侧髂骨翼、髋臼、股骨颈及大转子出现硬化带(图 1C),遂停止地舒单抗治疗。随访3个月,双侧股骨远端、胫腓骨近远端骨骺出现硬化带(图 1D),无其他异常,目前未出现反弹性高钙血症。
文献检索截止时间为2022年3月,共获得地舒单抗治疗ABC相关的文献20篇(外文文献19篇,中文文献1篇)[2-21];共报道52例ABC接受地舒单抗治疗;24例为手术、栓塞、硬化等治疗效果不满意,2例合并病理性骨折,26例因位置特殊或肿瘤巨大、血运丰富无法手术治疗而采取地舒单抗单药治疗或辅助治疗。52例ABC接受治疗后临床症状均有不同程度的缓解,绝大多数患者影像学表现有所改善;停药后复发5例,进展1例。
讨论 ABC是由充满血液的管腔纤维间隔组成,以往认为是骨内局部血流及静脉压力紊乱导致,现已被证明具有以USP6基因重排为特征的肿瘤性质。研究发现,约75%的ABC与16号染色体q22易位至17号染色体p13有关。ABC内含有大量破骨细胞样多核细胞,高表达核因子-κB受体活化因子(receptor activator of nuclear factor kappa-B, RANK),同时含有大量肿瘤样基质细胞,高表达核因子-κB受体活化因子配体(receptor activator of nuclear factor kappa-B ligand, RANKL),RANKL与RANK结合,促进破骨细胞成熟,进而导致骨质吸收与溶解。地舒单抗是一种针对RANKL的全人源化单克隆抗体,能够模仿骨保护素,与RANKL结合,抑制破骨细胞形成、减少骨质吸收、增加骨密度并降低骨折风险,早期用于治疗骨质疏松、骨巨细胞瘤及恶性肿瘤骨转移等骨不良事件[1]。
ABC的常见治疗方式包括动脉栓塞、刮除术、病灶内注射、冷冻疗法和整体切除并放置内固定物等。对脊柱或骨盆等难以手术治疗的区域,传统内科保守治疗效果不满意。地舒单抗治疗ABC属于超说明书用药,目前尚无统一的治疗方案,主要借鉴于骨巨细胞瘤的方案,即70 mg/m2体表面积(body surface area, BSA)或1.2 mg/kg体重,成人最大剂量为120 mg,每周1次,连续4周后改为每个月1次,具体停药时间根据临床症状和患者耐受程度决定[2]。文献报道地舒单抗治疗ABC用药时间2~55个月,本例按1.2 mg/kg剂量,每次约120 mg,治疗9个月。注射方式按照说明书为皮下注射,目前文献报道中,仅Raux[15]在2019年报道5例,均为静脉注射,未发现明显不良反应。起止时间依据方案不同及病灶大小而不同,一般在治疗1个月或4剂后临床症状缓解,本例在治疗6剂后疼痛消失,可直立行走。大部分病例在用药后病灶可出现钙化,部分病例无钙化出现,本例钙化少许,是否与其病灶RANKL低表达有关暂不清楚,有待病理进一步明确。
地舒单抗治疗ABC并发症并不少见,其中低钙血症较为常见,口服钙剂和维生素D可预防。预防剂量目前无统一方案,一般建议每日补钙500~1 000 mg,每日维生素D的剂量400~800 IU,同时在每次治疗前需检测血钙水平,防止用药后低钙血症加重。本例患者在地舒单抗治疗4个疗程后出现严重低钙血症,考虑与患者自行降低钙摄入量及腹泻有关,给予8 h内缓慢静脉滴注10%葡萄糖酸钙共3次后好转。低磷血症及继发性甲状旁腺功能亢进往往在纠正低血钙后逐步恢复,一般无需特别处理。
反弹性高钙血症是另一个较为常见的并发症,多发生在停药后3~6个月,最早发生于停药后1个月,并可多次发生,同时伴急性肾损害[15, 19]。反弹性高钙血症病例均为儿童,可能与儿童钙调节功能不完善及突然停药有关。采用地舒单抗逐步减量直至停药方案可有效预防反弹性高钙血症。
在儿童中,生长板钙化也是地舒单抗治疗过程中值得关注的并发症。上述文献报告中2例儿童分别在用药后6个月和12个月出现生长板钙化现象,停药后消失,其中1例再用药后生长板钙化复现,停药3年后出现膝外翻,但是否与用药有关并未明确[19, 22]。另1例患者曾因高血压、高钙血症及纳差出现体重减轻、生长停滞,停用地舒单抗后生长板钙化消失,生长继续[19]。本例患者在用药11个疗程后发现生长板钙化现象,无其他不适,并未发现身高生长受影响(当前身高176.5 cm)。目前认为暂时性生长板钙化并不影响患者的身高[23]。其他并发症包括急性胃肠炎、疲乏及肌痛等, 较为少见,均为轻度,经对症处理好转。下颌骨骨坏死是地舒单抗治疗的严重并发症,较为少见。
综上,地舒单抗治疗成人骨巨细胞瘤及恶性肿瘤骨转移取得了良好的经验,治疗ABC尚处于早期,部分病例治疗效果良好。儿童相对于成人更容易出现并发症,但多可预防,随着病例的增多和经验的积累,地舒单抗儿童相关并发症可望减少,长期效果及并发症有待进一步研究。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为李会、李庆兴;论文调查设计为李会、师东良;数据收集与分析为李会、师东良;论文结果撰写为李会、倪晓燕;论文讨论分析为李会、倪晓燕、师东良、滕国良、李庆兴
| [1] |
Deventer N, Deventer N, Gosheger G, et al. Current strategies for the treatment of solitary and aneurysmal bone cysts: a review of the literature[J]. J Bone Oncol, 2021, 30: 100384. DOI:10.1016/j.jbo.2021.100384 |
| [2] |
Lange T, Stehling C, Fröhlich B, et al. Denosumab: a potential new and innovative treatment option for aneurysmal bone cysts[J]. Eur Spine J, 2013, 22(6): 1417-1422. DOI:10.1007/s00586-013-2715-7 |
| [3] |
Pelle DW, Ringler JW, Peacock JD, et al. Targeting receptor-activator of nuclear kappaB ligand in aneurysmal bone cysts: verification of target and therapeutic response[J]. Transl Res, 2014, 164(2): 139-148. DOI:10.1016/j.trsl.2014.03.005 |
| [4] |
Pauli C, Fuchs B, Pfirrmann C, et al. Response of an aggressive periosteal aneurysmal bone cyst (ABC) of the radius to denosumab therapy[J]. World J Surg Oncol, 2014, 12: 17. DOI:10.1186/1477-7819-12-17 |
| [5] |
Skubitz KM, Peltola JC, Santos ER, et al. Response of aneurysmal bone cyst to denosumab[J]. Spine (Phila Pa 1976), 2015, 40(22): E1201-E1204. DOI:10.1097/BRS.0000000000001027 |
| [6] |
Dubory A, Missenard G, Domont J, et al. Interest of denosumab for the treatment of giant-cells tumors and aneurysmal bone cysts of the spine.About nine cases[J]. Spine (Phila Pa 1976), 2016, 41(11): E654-E660. DOI:10.1097/BRS.0000000000001350 |
| [7] |
Ghermandi R, Terzi S, Gasbarrini A, et al. Denosumab: non-surgical treatment option for selective arterial embolization resistant aneurysmal bone cyst of the spine and sacrum.Case report[J]. Eur Rev Med Pharmacol Sci, 2016, 20(17): 3692-3695. |
| [8] |
Ntalos D, Priemel M, Schlickewei C, et al. Therapeutic management of a substantial pelvic aneurysmatic bone cyst including the off-label use of denosumab in a 35-year-old female patient[J]. Case Rep Orthop, 2017, 2017: 9125493. DOI:10.1155/2017/9125493 |
| [9] |
Kurucu N, Akyuz C, Ergen FB, et al. Denosumab treatment in aneurysmal bone cyst: evaluation of nine cases[J]. Pediatr Blood Cancer, 2018, 65(4): e26926. DOI:10.1002/pbc.26926 |
| [10] |
Asi KW, Abdelmeguid A, Bell D, et al. Massive aneurysmal bone cyst of the skull base treated with denosumab[J]. Head Neck, 2018, 40(12): E107-E113. DOI:10.1002/hed.25438 |
| [11] |
Fontenot PB, Jesurajan J, Bui M, et al. Recurrent aneurysmal bone cyst of the distal fibula treated with denosumab and curettage[J]. Case Rep Oncol Med, 2018, 2018: 1574343. DOI:10.1155/2018/1574343 |
| [12] |
Patel RS, Dhamne CA, Gopinathan A, et al. Denosumab: a potential treatment option for aneurysmal bone cyst of the atlas[J]. Eur Spine J, 2018, 27(Suppl 3): 494-500. DOI:10.1007/s00586-018-5528-x |
| [13] |
Palmerini E, Ruggieri P, Angelini A, et al. Denosumab in patients with aneurysmal bone cysts: a case series with preliminary results[J]. Tumori, 2018, 104(5): 344-351. DOI:10.1177/0300891618784808 |
| [14] |
Dürr HR, Grahneis F, Baur-Melnyk A, et al. Aneurysmal bone cyst: results of an off label treatment with Denosumab[J]. BMC Musculoskelet Disord, 2019, 20(1): 456. DOI:10.1186/s12891-019-2855-y |
| [15] |
Raux S, Bouhamama A, Gaspar N, et al. Denosumab for treating aneurysmal bone cysts in children[J]. Orthop Traumatol Surg Res, 2019, 105(6): 1181-1185. DOI:10.1016/j.otsr.2019.04.028 |
| [16] |
Kulkarni AG, Patel A. Denosumab: a potential new treatment option for recurrent aneurysmal bone cyst of the spine[J]. SICOT J, 2019, 5: 10. DOI:10.1051/sicotj/2019007 |
| [17] |
Subramanyam K, Sahini SC, Kumar S. Denosumab role in sacral aneurysmal bone cyst: a rare case report[J]. IP Int J Med Paediatr Oncol, 2019, 5(3): 108-111. DOI:10.18231/j.ijmpo.2019.024 |
| [18] |
Sydlik C, Dürr HR, Pozza SBD, et al. Hypercalcaemia after treatment with denosumab in children: bisphosphonates as an option for therapy and prevention?[J]. World J Pediatr, 2020, 16(5): 520-527. DOI:10.1007/s12519-020-00378-w |
| [19] |
Harcus M, Aldridge S, Abudu A, et al. The efficacy of denosumab in the management of a tibial paediatric aneurysmal bone cyst compromised by rebound hypercalcaemia[J]. Case Rep Pediatr, 2020, 2020: 8854441. DOI:10.1155/2020/8854441 |
| [20] |
Fadavi P, Arefpour AM, Hariri R, et al. Dramatic response of aneurysmal bone cyst to denosumab: case report and literature review[J]. Clin Case Rep, 2021, 9(10): e04993. DOI:10.1002/ccr3.4993 |
| [21] |
杨毅, 梁海杰, 郭卫, 等. Denosumab联合手术治疗动脉瘤样骨囊肿效果和安全性的初步观察[J]. 中华外科杂志, 2018, 56(2): 153-156. Yang Y, Liang HJ, Guo W, et al. Preliminary observation on efficacy and safety of denosumab plus surgery for aneurysmal bone cysts[J]. Chin J Surg, 2018, 56(2): 153-156. DOI:10.3760/cma.j.issn.0529-5815.2018.02.014 |
| [22] |
Del Sindaco G, Berlanga P, Brugières L, et al. Mineral and bone consequences of high dose denosumab therapy to treat an aneurysmal bone cyst, a child case report[J]. Front Endocrinol (Lausanne), 2021, 12: 698963. DOI:10.3389/fendo.2021.698963 |
| [23] |
Wang HD, Boyce AM, Tsai JY, et al. Effects of denosumab treatment and discontinuation on human growth plates[J]. J Clin Endocrinol Metab, 2014, 99(3): 891-897. DOI:10.1210/jc.2013-3081 |
 2023, Vol. 22
2023, Vol. 22


