2. 广州市妇女儿童医疗中心广东省结构性出生缺陷疾病研究重点实验室, 广州 510623
2. Guangdong Provincial Key Laboratory of Research in Structural Birth Defect Disease, Guangzhou Women and Children's Medical Center, Guangzhou 510623, China
胆道闭锁(biliary atresia, BA)是引起婴幼儿梗阻性黄疸的常见原因,预后差,发病机制不明。其基本病理变化是肝内、外胆管进行性损伤,胆管闭锁,致胆汁淤积及肝功能受损。由于该病在临床尚无有效治疗药物,即便是进行了Kasai手术,仍有至少约70%的患儿在成年前会发展为肝硬化,乃至亟待肝移植的肝衰竭[1-3]。
BA被认为是一种针对胆管的自身免疫性疾病[1]。该病肝内胆管周围包绕着大量免疫细胞如CD4+T细胞、CD8+T细胞、B细胞、自然杀伤细胞(natural killer cell, NK细胞)和巨噬细胞等,上述细胞可攻击胆道上皮细胞(biliary epithelial cell, BEC)引起胆管损伤[1, 4-7]。我们的前期研究表明,BA中CD177+中性粒细胞处于活化状态,通过释放胞外诱捕网(neutrophil extracellar traps,NETs)引起胆管损伤,但引起CD177+中性粒细胞活化的环境因素未明[8]。
大量研究表明,高胆固醇与多种自身免疫性疾病(如类风湿性关节炎、多发性硬化、哮喘等)相关,限制胆固醇摄入量已成为这些疾病的治疗策略之一[9-10]。此外,肝脏疾病也会改变甾醇代谢稳定。BA作为一种严重的新生儿自身免疫性疾病,至目前为止有关胆固醇在BA中的含量及胆固醇对该病免疫反应的影响及相关机制研究鲜有报道。
因此,我们通过分析临床BA患儿的总胆固醇(total cholesterol, TC)含量,并与肝功能中胆汁淤积及胆管损伤相关指标γ-谷氨酰转移酶(gamma-glutamyltransferase, GGT)、直接胆红素(direct bilirubin, DBIL)、总胆汁酸(total bile acid, TBA)等进行相关性分析,同时检测BEC的凋亡情况,以期阐明其引起胆管损伤的免疫学机制,进而明确BA的可能发病机制,为该病的临床治疗提供实验依据。
资料与方法 一、临床资料及实验材料 (一) 临床资料回顾性收集广州市妇女儿童医疗中心2011年至2020年共118例经术中胆管造影确诊的BA患儿、80例同龄婴儿肝炎综合征(infantile hepatitis syndrome, IHS)患儿及165例同年龄正常对照(normal control, NC,无肝病证据且无肝功能异常并诊断为血管瘤等) 组儿童术前外周血肝功能指标及TC含量;组织染色实验中,本院检验科系统提示TC正常值为3.4~5.2 mmol/L,故本研究以5.2 mmol/L为临界值,根据外周血TC检测数值将BA患儿分为高胆固醇BA组和正常胆固醇BA组。BA组患儿(n=7)肝脏标本取自患儿术中肝脏病理活检组织标本,并以肝组织正常的门脉海绵样畸形患儿(n=4)的肝活检组织标本作为对照。本研究获得广州市妇女儿童医疗中心临床研究机构评审委员会批准[穗妇儿科伦批字(2021)第401B01号]。
(二) 主要实验材料人肝内胆道上皮细胞(#5100)及上皮细胞培养基(#4101)购自美国ScienCell公司;PE conjugated mouse anti-human CD177(ab69777)、rabbit anti-human/mouse cytokeratin 19(ab52625)、100× Tris-EDTA Buffer, pH9.0(ab93684)、TOMM20(ab186734)、8-OHdG(ab62623)、MPO(ab9535)、H2B(ab52484)购自美国Abcam公司;anti-PE microbeads (130 — 105 — 807)购自德国Miltenyi Biotec公司;anti-human CD45-APC-Cy7(25 — 0459)购自美国Tonbo Biosciences公司;anti-human CD66b-BV421(562940)购自美国BD biosciences公司;DAB(SA-HRP)TUNEL Cell Apoptosis Detection Kit(G1507 — 50T)购自中国Servicebio公司;胆固醇(C3045)购自美国Sigma Aldrich公司。
二、研究方法 (一) BA患儿临床病理数据收集术前收集118例未经抗生素干预的BA患儿外周血进行肝功能、血脂等生化指标检测,包括:GGT、总胆红素(total bilirubin, TBIL)、DBIL、TBA、丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)和TC水平。
(二) 流式分析BA患儿外周血CD177+中性粒细胞比例并收集BA患儿外周血免疫细胞数据收集术前无抗生素干预的BA患儿外周血样本,使用红细胞裂解液将其裂解成单细胞悬液,加入FcR Blocking室温孵育10 min,加入anti-CD45、anti-CD66b、anti-CD177抗体, 孵育后再加入7-AAD孵育5 min, 在BD FACS Aria Ⅱ(BD Biosciences, USA)流式细胞仪上检测并收集CD177+中性粒细胞检测结果;同时收集BA患儿的外周血相关免疫细胞检测数据。
(三) 患儿肝脏石蜡组织切片免疫组织化学染色将来自患者的肝脏组织样本固定后制作成石蜡切片并进行TUNEL(TdT-mediated dUTP nick end labeling)染色及细胞角蛋白19(cytokeratin 19, CK19)免疫组化染色。TUNEL染色使用DAB(SA-HRP) TUNEL Cell Apoptosis Detection Kit,严格按照说明书步骤进行染色。TUNEL显色结束后,进行抗原修复,然后anti-cytokeratin 19 antibody [EP1580Y-cytoskeleton marker一抗4℃孵育过夜,稀释比例1 ∶ 400。与对应二抗在室温下孵育1 h后进行显色。ImmPACT DAB(VECTOR, CA, U.S.A)和HIGHDEFⓇ Green AP Chromogen/Substrate(ENZ-ACC130-0030, Enzo Life Sciences) 分别用于TUNEL及CK19显影。每组使用3~10个独立切片,并在每个切片随机挑选5个门脉区域于×40高倍镜下拍照,分别计数每个视野中TUNEL阳性与CK19阳性细胞,采取TUNEL阳性细胞在CK19阳性细胞中的占比作为统计值。
(四) 磁珠分选CD177+中性粒细胞收集术前无抗生素干预的同龄血管瘤或马蹄足患儿新鲜外周血样本作为正常对照。将血样按比例进行红细胞裂解后制成外周血单细胞悬液,调整单细胞悬液浓度为1×108个/mL,在100 μL单细胞悬液体系中加入PE conjugated mouse anti-human CD177避光孵育30 min后离心并洗涤细胞2次,取160 μL细胞悬液,加入anti-PE microbeads避光孵育20 min,孵育后洗涤并离心细胞2次,调整细胞浓度至2×108个/mL。在使用流式染色缓冲液润洗好的LS分离柱中加入已标记的细胞悬液,待所有细胞流经分离柱后,再加入流式染色缓冲液冲洗分离柱,使用配套活塞将分选所得CD177+中性粒细胞推入15 mL离心管中,流式检测细胞纯度,并使用细胞纯度>95%的细胞进行下一步实验。
(五) CD177+中性粒细胞与BEC体外共培养实验将上述分选所得CD177+中性粒细胞加入BEC中,同时加入5 mg/mL胆固醇刺激,于37℃、5% CO2条件下培养5 d,镜下观察BEC增殖凋亡情况,并收集各组BEC,使用MTT法检测BEC增殖情况。
(六) 免疫荧光检测NETs成分及线粒体氧化标志物表达将上述分选的CD177+中性粒细胞加入胆固醇刺激1 h后涂片,4%的多聚甲醛固定30 min,磷酸缓冲盐溶液(phosphatebuffersaline,PBS)清洗3次后,用0.02%聚乙二醇辛基苯基醚(2-(2-[4-(1, 1, 3, 3, -Tetramethylbutyl) phenoxy] ethoxy) ethanol,Triton X-100)破膜15 min,PBS清洗3次后孵育一抗线粒体外膜转位酶20(translocase of outer mitochondrial membrane 20, TOMM20)、8-羟基脱氧鸟苷(8-hydroxy-2′ -deoxyguanosine, 8-OHdG)、髓过氧化物酶(myeloperoxidase, MPO)、组蛋白2B(histone 2B, H2B)过夜,PBS清洗3次后孵育anti-mouse/rabbit二抗1 h,PBS清洗3次后进行细胞核染色,4′, 6-二脒基-2苯基吲哚(4′, 6-diamidino-2′-phenylindole, DAPI)染色20 min,封片后进行共聚焦拍照并作定量分析。
(七) 高胆固醇BA组与正常胆固醇BA组差异表达基因分析在对BA患儿肝脏组织CD177+中性粒细胞RNA测序数据分析基础上,进一步分别对正常胆固醇BA组和高胆固醇BA组在表达上具有显著性差异的基因进行统计分析。
三、统计学处理采用SPSS 26.0和GraphPad Prism 8.0进行统计学分析。使用Image J对免疫组化及免疫荧光结果进行分析。服从正态分布的数据用x±s表示;非正态分布数据用M(Q1, Q3)表示;两组间正态分布数据采用独立样本t检验;两组间平均荧光强度(mean fluorescence intensity, MFI)比较采用配对样本t检验;两组间非正态数据比较采用独立样本Mann-Witney秩和检验;多组间正态分布数据比较采用单因素方差分析, 并进一步通过LSD检验进行两两比较;差异表达基因分析采用Wilcoxon两样本秩和检验;服从正态分布数据相关性分析采用Pearson积差相关;非正态数据指标相关性分析采用Spearman等级相关;以P < 0.05为差异有统计学意义。
结果 一、一般资料本研究共纳入118例BA患儿、80例IHS患儿及165例NC患儿。所有纳入患儿的临床基本特征及病理参数特征如表 1所示。其中基本特征层面,三组患儿年龄差异有统计学意义(P < 0.05),BA组与IHS组相比,性别差异无统计学意义(P>0.05)。病理参数层面,BA组和IHS组相比,GGT、ALT、AST、TBIL、DBIL差异均有统计学意义(P < 0.05)。
| 表 1 正常对照组、婴儿肝炎综合征组及胆道闭锁组儿童临床特征 Table 1 Clinical characteristics of children in three groups |
|
|
各组外周血TC含量:NC组3.7(3.1,4.1)mmol/L、IHS组4.2(3.3,5.4)mmol/L、BA组4.9(4.0,6.1)mmol/L,组间差异有统计学意义(P < 0.05);BA组TC含量显著高于NC组及IHS组,差异有统计学意义(P < 0.05)。
三、BA患儿外周血TC含量与胆管损伤相关指标的相关性BA组外周血TC含量4.9(4.0,6.1)mmol/L, 与胆管损伤指标GGT 497.0(298.5,843.0)U/L呈显著正相关(r=0.401,P < 0.05),与胆汁淤积指标DBIL 122.0(103.9,144.5)μmol/L呈显著正相关(r=0.338,P < 0.05),与TC代谢分解产物TBA 124.0(103.7,154.1)μmol/L呈显著正相关(r=0.235,P < 0.05)。
四、BA患儿外周血TC含量升高与胆管损伤密切相关CK19阳性主要定位于BEC,TUNEL染色定位凋亡细胞中细胞核断裂DNA,可反映细胞凋亡情况(图 1A-C)。高胆固醇BA组患儿肝脏组织BEC凋亡数量比例0.724±0.146显著高于正常胆固醇BA组0.232±0.141及NC组0.242±0.228,差异均有统计学意义(P < 0.05);见表 2。
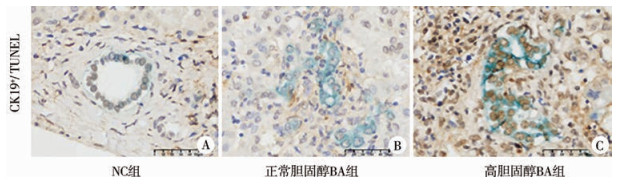
|
图 1 NC组、正常胆固醇BA组和高胆固醇BA组患儿肝脏组织胆管细胞凋亡情况免疫组化染色结果(×400) Fig.1 Immunohistochemical staining results of cholangiocyte apoptosis in liver tissues of children in NC, normal-cholesterol BA and high-cholesterol BA groups(×400) 注 A:CK19及TUNEL在NC组肝脏组织中弱表达;B:在正常胆固醇BA组中TUNEL弱表达,CK19强表达;C:TUNEL及CK19在高胆固醇BA组中均强表达; NC:正常对照组;BA:胆道闭锁 |
| 表 2 对照组、正常胆固醇BA组和高胆固醇BA组肝脏组织胆管细胞凋亡数量比例比较 Table 2 Comparison of the proportion of apoptotic cholangiocytes in liver tissue among NC, normal-cholesterol BA and high-cholesterol BA groups |
|
|
26例BA患儿外周血TC含量4.4(3.1,5.5)mmol/L与外周血CD177+中性粒细胞比例(26.5±6.4)%呈正相关(r=0.503,P < 0.05);而外周血TC含量与外周血单核细胞数量1.0(0.8,1.2)× 109/L和外周血中性粒细胞数量(3.2±1.4)×109/L之间均无相关性(P>0.05)。
25例BA患儿外周血TC含量(4.7±1.6)mmol/L与外周血T细胞数量(4 952.1±1 985.0)个/μL呈正相关(r=0.488,P < 0.05);外周血TC含量与外周血B细胞数量971.0(664.8,1 636.1)个/μL之间无相关性(P>0.05)。
六、细胞共培养结果在体外正常CD177+中性粒细胞与BEC共培养体系中加入胆固醇,结果显示,加入胆固醇刺激后,BEC凋亡数量显著增加(P < 0.05,图 2A-E)。上述结果表明,BA中TC含量的升高可通过刺激CD177+中性粒细胞引起BEC凋亡。
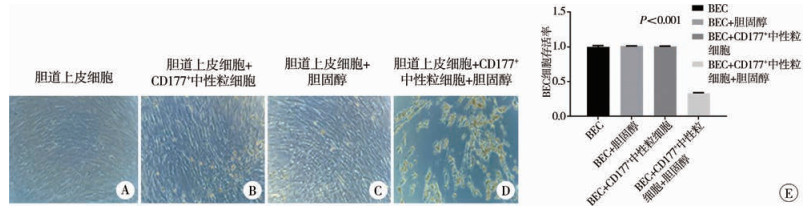
|
图 2 细胞共培养体系中加入胆固醇刺激前后各组BEC细胞形态变化及BEC细胞活率结果 Fig.2 Morphological changes of BEC and results of BEC cell viability in each group in cell co-culture system 注 A-D:胆道上皮细胞与外周血CD177+中性粒细胞体外共培养实验培养5 d后各组BEC细胞形态变化(×100),A~D分别为BEC组、BEC+ CD177+中性粒细胞组、BEC+胆固醇组、BEC+ CD177+中性粒细胞+胆固醇组;E:MTT法测定培养后各组BEC细胞活率,BEC+ CD177+中性粒细胞+胆固醇组BEC细胞活率较其余各组差异有统计学意义(P < 0.05) |
与正常胆固醇BA组相比,高胆固醇BA组线粒体氧化磷酸化相关基因CYBB、CALR、MT-CYB、MT-ND5、MT-ND1表达均显著上调,差异有统计学意义(P < 0.05),见表 3。
| 表 3 高胆固醇BA组与正常胆固醇BA组差异表达基因分析[M(Q1, Q3)] Table 3 Analysis of differentially expressed genes between high-cholesterol BA and normal-cholesterol BA groups[M(Q1, Q3)] |
|
|
在体外正常CD177+中性粒细胞中加入胆固醇后,代表线粒体氧化磷酸化指标的TOMM20及DNA 8-OHdG明显增加(图 3A-H),MFI值均显著升高,差异有统计学意义(P < 0.05),见表 4。同时,经胆固醇刺激后,正常CD177+中性粒细胞释放的NETs成分MPO和H2B明显增加(图 4A-H),MFI值均显著升高,差异有统计学意义(P < 0.05),见表 4。上述结果表明胆固醇通过上调CD177+中性粒细胞线粒体氧化磷酸化水平促进NETs的释放,引起胆管损伤。
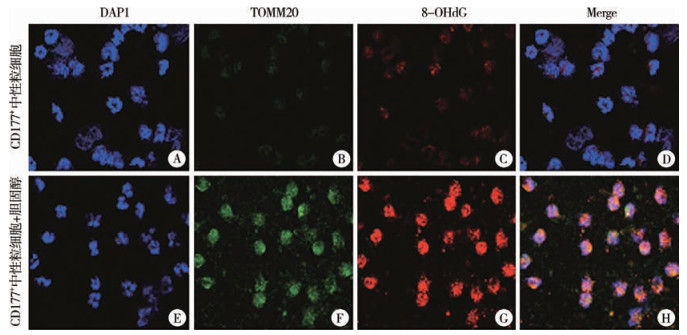
|
图 3 胆固醇刺激正常CD177+中性粒细胞前后氧化磷酸化指标TOMM20、8-OHdG免疫荧光染色结果(×630) Fig.3 Immunofluorescent staining results of TOMM20 and 8-OHdG, indicators of oxidative phosphorylation, before and after cholesterol stimulation of normal CD177+ neutrophils(×630) 注 A-D:胆固醇体外刺激前正常CD177+中性粒细胞DAPI、TOMM20、8-OHdG表达及Merge结果;E-H:胆固醇体外刺激后正常CD177+中性粒细胞DAPI、TOMM20、8-OHdG表达及Merge结果 |
| 表 4 NC组患儿外周血CD177+中性粒细胞加入胆固醇刺激前后各指标平均荧光强度值比较(x±s) Table 4 Comparison of MFI values for each index before and after cholesterol stimulation of peripheral blood CD177+ neutrophils in NC group(x±s) |
|
|
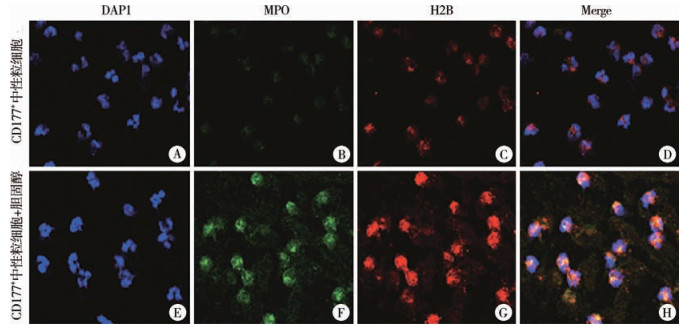
|
图 4 胆固醇刺激正常CD177+中性粒细胞前后胞外诱捕网相关指标MPO、H2B免疫荧光染色结果(×630) Fig.4 Immunofluorescent staining results of MPO and H2B, indicators related to NETs before and after cholesterol stimulation of normal CD177+ neutrophils(×630) 注 A-D:胆固醇体外刺激前正常CD177+中性粒细胞DAPI、MPO、H2B表达及Merge结果;E-H:胆固醇体外刺激后正常CD177+中性粒细胞DAPI、MPO、H2B表达及Merge结果 |
本研究发现BA患儿外周血总胆固醇含量升高,且与胆管损伤密切相关,胆固醇通过刺激CD177+中性粒细胞产生NETs引起BEC凋亡。
研究表明,高胆固醇可引起组织细胞损伤,但损伤的机制是由胆固醇自身直接引起的还是间接引起尚无定论[11-12]。本研究体外实验中,我们观察到在BEC中直接加入胆固醇并不会引起细胞数量的改变,只有在CD177+中性粒细胞的介导下细胞数量才会显著减少,表明高胆固醇对BEC的损伤作用是间接的。
CD177属于Ly-6家族中的58-64-kDa蛋白,其通过糖基磷脂酰肌醇键在嗜中性粒细胞中表达,在生理条件下,约60%的中性粒细胞上表达CD177,然而,机体发生急性炎症时,CD177+中性粒细胞数量明显增加[13-14]。胆固醇对中性粒细胞具有活化作用目前有少量报道,但其活化机制尚未见报道。Warnatsch等[15]研究发现,胆固醇结晶通过刺激中性粒细胞释放NETs,从而进一步活化巨噬细胞和Th17,放大炎症反应。此外,循环中的胆固醇水平也能影响中性粒细胞的活性,高胆固醇水平可通过降低CXCL12水平来降低中性粒细胞的清除率[16]。本研究结果显示,在胆固醇的刺激下,CD177+中性粒细胞线粒体氧化磷酸化水平上调。研究表明,中性粒细胞线粒体氧化磷酸化水平上调可产生过量ROS,在ROS的影响下,细胞内颗粒和核膜破裂,释放的核颗粒和细胞质内容物混合,形成NETs所必须的DNA、组蛋白、NE、MPO和PAD4,最终质膜破裂导致细胞溶解,并释放NETs至胞外,引起组织细胞损伤[17-18]。
综上,我们的研究首次发现了胆固醇在胆道闭锁患儿中含量升高且可引起胆管损伤,首次阐明了胆固醇可通过上调CD177+中性粒细胞线粒体氧化磷酸化水平,促进胆管上皮细胞的凋亡。然而,目前我们的研究还存在治疗靶点探索的局限性,未来我们将在动物实验基础上进一步探索胆固醇和胆管上皮细胞之间的关系,并在此基础上尝试使用胆固醇抑制剂治疗慢性BA小鼠,建立慢性BA小鼠模型,使用降胆固醇药物进行干预和评估治疗效果,拓展研究将进一步阐明胆固醇致BA的发病机制,并为该病的临床治疗提供实验依据。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 肖依依负责研究的设计、实施和起草文章;赵子阳负责研究的实施;童燕陆、王贺珍、陈虹交负责病例数据收集及分析;夏慧敏负责对文章知识性内容进行审阅;张锐忠负责研究设计,并对文章知识性内容进行审阅
| [1] |
Lakshminarayanan B, Davenport M. Biliary atresia: a comprehensive review[J]. J Autoimmun, 2016, 73: 1-9. DOI:10.1016/j.jaut.2016.06.005 |
| [2] |
Schreiber RA. Newborn screening for biliary atresia[J]. JAMA, 2020, 323(12): 1137-1138. DOI:10.1001/jama.2020.2727 |
| [3] |
詹江华, 孙溶涓, 王智茹, 等. 日本《胆道闭锁临床实践指南》解读[J]. 临床小儿外科杂志, 2023, 22(3): 205-210. Zhan JH, Sun RJ, Wang ZR, et al. Interpretations of Clinical Practice Guidelines for Biliary Atresia in Japan[J]. J Clin Ped Sur, 2023, 22(3): 205-210. DOI:10.3760/cma.j.cn101785-202212025-002 |
| [4] |
Mack CL, Falta MT, Sullivan AK, et al. Oligoclonal expansions of CD4+ and CD8+ T-cells in the target organ of patients with biliary atresia[J]. Gastroenterology, 2007, 133(1): 278-287. DOI:10.1053/j.gastro.2007.04.032 |
| [5] |
Zhang Y, Zhou L, Gu GX, et al. CXCL8highinflammatory B cells in the peripheral blood of patients with biliary atresia are involved in disease progression[J]. Immunol Cell Biol, 2020, 98(8): 682-692. DOI:10.1111/imcb.12366 |
| [6] |
Miethke AG, Saxena V, Shivakumar P, et al. Post-natal paucity of regulatory T cells and control of NK cell activation in experimental biliary atresia[J]. J Hepatol, 2010, 52(5): 718-726. DOI:10.1016/j.jhep.2009.12.027 |
| [7] |
阿里木江·阿不都热依木, 林峰, 王皓洁, 等. Notch信号通路活化协同巨噬细胞对胆道闭锁肝纤维化的作用研究[J]. 临床小儿外科杂志, 2021, 20(4): 376-381. Abudureyimu ALMJ, Lin F, Wang HJ, et al. Activation of notch signaling pathway collaborated with macrophages for promoting liver fibrosis in biliary atresia[J]. J Clin Ped Sur, 2021, 20(4): 376-381. DOI:10.12260/lcxewkzz.2021.04.014 |
| [8] |
Zhang RZ, Su L, Fu M, et al. CD177+ cells produce neutrophil extracellular traps that promote biliary atresia[J]. J Hepatol, 2022, 77(5): 1299-1310. DOI:10.1016/j.jhep.2022.06.015 |
| [9] |
Manzel A, Muller DN, Hafler DA, et al. Role of "western diet" in inflammatory autoimmune diseases[J]. Curr Allergy Asthma Rep, 2014, 14(1): 404. DOI:10.1007/s11882-013-0404-6 |
| [10] |
Chen YC, Tung KY, Tsai CH, et al. Lipid profiles in children with and without asthma: interaction of asthma and obesity on hyperlipidemia[J]. Diabetes Metab Syndr, 2013, 7(1): 20-25. DOI:10.1016/j.dsx.2013.02.026 |
| [11] |
Chen XY, Yin QH, Ma L, et al. The role of cholesterol homeostasis in diabetic kidney disease[J]. Curr Med Chem, 2021, 28(36): 7413-7426. DOI:10.2174/0929867328666210419132807 |
| [12] |
Janoudi A, Shamoun FE, Kalavakunta JK, et al. Cholesterol crystal induced arterial inflammation and destabilization of atherosclerotic plaque[J]. Eur Heart J, 2016, 37(25): 1959-1967. DOI:10.1093/eurheartj/ehv653 |
| [13] |
Kim MC, Borcherding N, Ahmed KK, et al. CD177 modulates the function and homeostasis of tumor-infiltrating regulatory T cells[J]. Nat Commun, 2021, 12(1): 5764. DOI:10.1038/s41467-021-26091-4 |
| [14] |
Hu N, Mora-Jensen H, Theilgaard-Mönch K, et al. Differential expression of granulopoiesis related genes in neutrophil subsets distinguished by membrane expression of CD177[J]. PLoS One, 2014, 9(6): e99671. DOI:10.1371/journal.pone.0099671 |
| [15] |
Warnatsch A, Ioannou M, Wang Q, et al. Inflammation. neutrophil extracellular traps license macrophages for cytokine production in atherosclerosis[J]. Science, 2015, 349(6245): 316-320. DOI:10.1126/science.aaa8064 |
| [16] |
Drechsler M, Megens RTA, van Zandvoort M, et al. Hyperlipidemia-triggered neutrophilia promotes early atherosclerosis[J]. Circulation, 2010, 122(18): 1837-1845. DOI:10.1161/CIRCULATIONAHA.110.961714 |
| [17] |
Lood C, Blanco LP, Purmalek MM, et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease[J]. Nat Med, 2016, 22(2): 146-153. DOI:10.1038/nm.4027 |
| [18] |
Dan Dunn J, Alvarez LA, Zhang XZ, et al. Reactive oxygen species and mitochondria: a nexus of cellular homeostasis[J]. Redox Biol, 2015, 6: 472-485. DOI:10.1016/j.redox.2015.09.005 |
 2023, Vol. 22
2023, Vol. 22


