亚急性骨髓炎多见于儿童和青少年,有学者根据病程长短定义亚急性骨髓炎,认为病程超过2周可定义为亚急性骨髓炎;也有学者定义亚急性骨髓炎为任何病程超过2周且无急性症状的骨感染过程,但亚急性骨髓炎与慢性骨髓炎之间暂无明确的病程长短界定阈值[1-5]。因为干骺端血流缓慢,缺乏内皮细胞,且细菌容易定植,因此亚急性骨髓炎好发于长骨的干骺端,最常见于胫骨,其次是股骨,也可见于椎体[6-11]。致病菌主要是金黄色葡萄球菌(60% ~70%),随着医学检验技术的发展,金氏杆菌的检出率越来越高[12]。该病的发病机制可能与宿主抵抗力增强、病原体毒力减弱以及抗生素的使用有关[1]。免疫系统活跃的机体可以将急性骨髓炎转变为亚急性骨髓炎[13]。研究表明,亚急性骨髓炎的发病率不断升高,达5/100 000左右,中低收入国家发病率更高[6, 13-15]。因亚急性骨髓炎起病隐匿,症状轻微,患儿白细胞计数(white blood cell, WBC)、红细胞沉降率(erythrocyte sedimentation rate, ESR)、C-反应蛋白(C-reactive protein, CRP)结果多为正常或轻度升高,X线以及CT通常表现为皮质增厚或缺失、骨质破坏、新骨形成、骨膜反应等,但上述表现特异性均较低,容易误诊为骨样骨瘤、尤文肉瘤、骨肉瘤、骨巨细胞瘤等[1-3, 16]。本文就亚急性骨髓炎的流行病学特征、临床表现、诊断、治疗及预后进行综述,以实现亚急性骨髓炎临床更早期、更准确的诊断与治疗。
一、诊断 (一) 临床表现亚急性骨髓炎患者在疾病初期,相较于急性骨髓炎一般无全身发热等症状,局部红、肿、热、痛不明显,主要表现为局部轻中度疼痛,如累及下肢可表现为跛行,很少会出现患肢功能丧失甚至影响日常活动[6, 13, 17-18]。
(二) 实验室检查亚急性骨髓炎患者实验室检查常无明显异常,WBC、ESR及CRP等炎性指标正常或略升高[14, 19]。由于患者CRP水平上升和恢复正常的速度均快于ESR,所以CRP可以用于评估当前治疗是否有效,其诊断敏感性也高于ESR[20-21]。降钙素原(procalcitonin, PCT)水平升高常见于严重的急性细菌感染,是小儿急性骨髓炎的诊断手段之一,但在亚急性骨髓炎中,PCT水平通常正常[22]。与急性骨髓炎较高的血培养阳性率相反,亚急性骨髓炎患者血培养结果往往为阴性,只有少数可以培养出金黄色葡萄球菌[6, 23-24]。
(三) 影像学检查1. X线及CT X线检查对于鉴别骨样骨瘤、尤文肉瘤、骨肉瘤以及骨巨细胞瘤至关重要[24-25]。亚急性骨髓炎典型X线表现为长骨干骺端或骨干圆形或椭圆形低密度骨质破坏区,边缘较整齐,无死骨影,当病变局限于干骺端时会出现边界清楚、密度增高的硬化带[17]。当病变穿过骺板时,硬化带常不明显。不典型表现为硬化带不连续,骨破坏区密度混杂,出现点状或条状稍高密度影,有层状骨膜反应[24]。各种不典型的X线表现容易导致误诊,最常被误诊为类似骨样骨瘤的透亮瘤巢;骨溶解和硬化、透光区或骨膜反应的混合模式可能与恶性骨肿瘤相似[16]。急性骨髓炎早期可见软组织肿胀影,后期骨破坏呈弥漫性和广泛透亮区,骨膜反应和皮质破坏均明显。白血病、尤文肉瘤、朗格汉斯细胞组织增生症也可见伴有层状骨膜反应的溶骨性病变[24]。
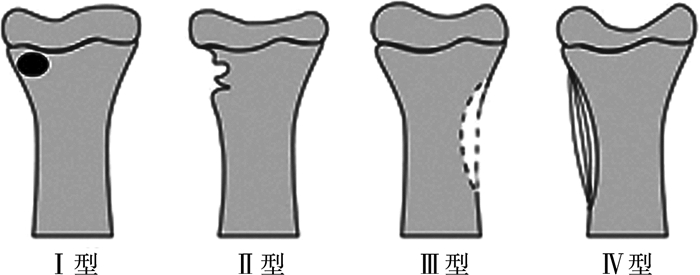
Gledhill[2]将亚急性骨髓炎分为四型(图 1)。Ⅰ型:病变特征为病灶被反应性新骨所形成硬化带包围;Ⅱ型:病变特征为病灶皮质丢失或干骺端见偏心性透亮区;Ⅲ型:病变特征为干骺端过度的皮质反应;Ⅳ型:病灶特征为病变处可见骨膜下新骨呈洋葱皮样。
|
图 1 基于Gledhill描述的亚急性骨髓炎4种分型示意图[2] Fig.1 Schematic diagram of four types of subacute osteomyelitis based upon Gledhill's description |
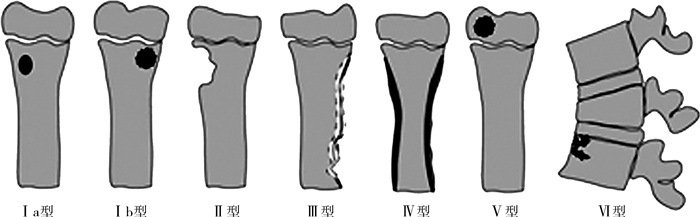
Roberts等[3]将Gledhill分型进行了修改,将其分为六型(图 2)。Ⅰ型通过病灶边缘形状又分为Ⅰb型与Ⅰa型,Ⅰa型为长骨干骺端圆形或椭圆形透光区,需与嗜酸性肉芽肿等良性肿瘤鉴别;Ⅰb型与Ⅰa型相似,但边缘硬化,表现为典型的Brodie's脓肿,可能被误认为骨样骨瘤,该型有可能穿过骺板;Ⅱ型病变侵蚀干骺端皮质,应与骨肉瘤相鉴别;Ⅲ型病变为长骨骨干的骨破坏,伴有皮质增厚和骨膜反应,类似于骨样骨瘤;Ⅳ型病变类似于伴有洋葱皮样骨膜反应的尤文肉瘤(Ⅲ型和Ⅳ型病变均发生在骨干);Ⅴ型为骨骺中心性破坏,可能被误诊为软骨母细胞瘤;Ⅵ型病变累及椎体,具有侵蚀性及破坏性。该分型仅依据影像学表现,可作为一种辅助诊断,但不能指导治疗或评估预后。
|
图 2 基于Roberts描述的亚急性骨髓炎6种分型示意图[3] Fig.2 Schematic diagram of six types of subacute osteomyelitis based upon Roberts's description |
CT相较于X线能更精准地显示局限病变范围,更清楚地展示皮质破坏、骨质破坏和骨膜反应的情况,但上述影像学表现通常到疾病后期才出现,可用作其他影像学方法的补充[25-26]。因此,当早期X线片显示上述典型表现且患者无急性症状时,应高度怀疑亚急性骨髓炎,病程中也应定期复查X线查看病灶变化情况。
2. MRI MRI是检测骨髓炎准确度最高的成像方式[27]。同时MRI早期诊断价值明显优于X线,因为大多数亚急性骨髓炎病例在就诊后2周甚至更长时间才可在X线片上观察到特征性骨病变[24, 28-29]。通常,亚急性骨髓炎在MRI上表现为伴有反应性骨髓水肿、骨膜反应和临近肌肉水平的水肿充血,典型病例可见半影征。MRI可将亚急性与急慢性骨髓炎进行区分,急性骨髓炎特征包括骨膜下脓肿、软组织明显肿胀、关节积液十分明显;而慢性骨髓炎特征包括皮质重塑、窦道和死骨形成。增强MRI可用于区分脓肿与坏死骨,也是区分骨感染与骨肿瘤的首选检查方式[24, 27, 30-31]。
半影征是亚急性骨髓炎的特征性而非诊断性MRI表现,其有四层结构[6, 28-31]。中心、内环、外环和外晕,脓肿腔即中心在T1加权像呈低信号;中心外环绕一圈肉芽组织即内环,又称半暗带,在所有MRI序列上都呈高信号;外环由硬化骨或纤维化组织形成,在所有图像上都呈低信号;外晕在T1加权像上呈低信号,有些学者认为可能代表水肿[28]。MRI上表现为半影征的病例,病变周围有一圈活动的、高度血管化的炎性肉芽组织,此时行闭合穿刺培养阳性率会更高[28]。在Shin等[16]的研究中,13例行MRI检查,其中10例(77%)可在MRI上见到明显半影征,最后经活检证实为亚急性骨髓炎。Mohamed等[32]也报道了1例亚急性舟骨骨髓炎,该病例MRI上清晰可见半影征。但需注意,并非所有亚急性骨髓炎病例都能观察到半影征,且半影征并非诊断亚急性骨髓炎的特异性MRI表现,部分嗜酸性肉芽肿及软骨肉瘤在MRI上亦可见不明显的半影征[28]。
3. 骨扫描 骨扫描对亚急性骨髓炎的鉴别诊断有一定帮助,能及时发现病变(通常在症状出现48 h内),灵敏度较高,当症状不局限或临床怀疑多灶性骨髓炎时可以考虑行骨扫描,也可以明确活检部位,从而提高活检阳性率[24]。Ayati等[33]研究认为,动态成像的骨扫描在区分感染性和肿瘤性病变方面非常有用,且具有很高的准确性。但是该检查方法缺乏特异性(特异度为73% ~79%),需结合临床表现及其他辅助检查[24]。考虑骨扫描对于儿童而言辐射量过大,我们不作首选推荐。
4. 活体组织检查 目前亚急性骨髓炎面临的最困难问题是如何准确诊断,临床表现及其他辅助检查虽然能初步诊断,但容易误诊,尤其难以与部分骨肿瘤相鉴别,通常不典型病例只有活检后才明确诊断,由于亚急性骨髓炎外周血培养阳性率极低,所以活检对于明确致病菌是很有必要的[34]。当然不是所有病例均需行活检,90%的病例可以通过影像学检查判断为良性病变,再进行试验性内科治疗,仅当抗生素治疗没有反应或病变进展时,才行开放活检或者手术治疗;剩下的10%无法与恶性肿瘤相鉴别,而恶性肿瘤治疗不容延误,故这部分病例需立即行活检术[14]。亚急性骨髓炎的典型组织学特征是含有散在浸润的中性粒细胞、淋巴细胞、浆细胞、肉芽组织等,无恶性迹象,均为慢性非特异性炎症[13, 17, 35]。
对于活检方式,目前存在较大争议。有学者认为应行开放活检,而非闭合穿刺活检,因为活检需要足量的骨膜、皮质骨和髓质,而穿刺活检达不到该效果[13]。闭合穿刺所得组织培养阳性率较低(约27%),而手术获得的组织或脓液阳性率较高(40%~75%)[10, 34]。在Shin等[16]的研究中,19例亚急性骨髓炎患者行开放活检后,活检阳性率为100%。而在Yen等[34]的研究中,82份(79例骨髓炎患者)经皮活检样本中,只有22份培养结果为阳性(27%),同时他们认为,骨活检只有在MRI、症状体征不明确或抗生素治疗无效时才考虑使用。
综上,亚急性骨髓炎的初步诊断标准为:病程至少2周,无发热等急性症状,实验室检查无明显异常,X线或CT可见患肢骨质异常(如皮质破坏、骨膜反应等),MRI加权成像可见软组织及髓内异常信号,排除镰刀细胞病、白血病、良性或恶性(原发性或转移性)骨肿瘤。
二、治疗亚急性骨髓炎治疗是否成功主要取决于适当的抗生素治疗和必要的外科手术。Pabla等[14]的研究认为:手术治疗和非手术治疗(包括口服剂型或肠外抗生素)都是有效的。此外,他们也强调仅口服抗生素就足以成功治愈亚急性骨髓炎,手术治疗可能导致永久性并发症。部分学者提倡单独使用抗生素治疗,手术干预用于诊断不确定(尤其无法排除恶性肿瘤)以及抗生素治疗无效的病例,并在术中收集组织和脓液样本进行病理检查及药物敏感试验,这样可以明确诊断及针对性使用有效抗生素[25, 30]。也有报道称患者未经任何治疗,随访发现临床症状消失、病灶完全愈合的情况[19]。
(一) 保守治疗保守治疗主要为连续静脉注射抗生素,一定疗程后更换为口服抗生素。对于儿童干骺端或骨骺病变,应首选抗生素治疗[35]。尤其是Brodie's脓肿,除手术外同样需要抗生素治疗,当病灶被死骨包裹时,在感染病灶处抗生素不能达到有效浓度,但抗生素能够使病灶局限,避免感染扩散,可在病灶侵犯骺板前保护骺板[36]。
在明确病原体之前首选针对金黄色葡萄球菌的抗生素,在培养结果出来后,应根据微生物易感性对抗生素进行有效调整[37]。考虑部分地区6个月至4岁患儿的主要致病菌为金氏杆菌,所以该地区对于年龄 < 4岁的患者建议首选针对金氏杆菌的抗生素(头孢呋辛、氨苄西林);4岁以上的患儿推荐使用针对金黄色葡萄球菌的药物,包括半合成青霉素(苯唑西林、萘呋西林)、头孢菌素(头孢唑林、头孢曲松等)[10, 23, 37-38];治疗耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)引起的骨髓炎应该静脉注射万古霉素或利奈唑胺;由于万古霉素骨渗透性较差,在疗效一般时可考虑加用渗透性较好的利福平,也有学者认为克林霉素良好的骨渗透性和口服生物利用度对MRSA骨髓炎非常有用[39-41]。
传统观点认为,抗生素治疗时间应在6~8周,但最新研究表明,儿童骨髓炎静脉注射抗生素1周后,再口服抗生素2~3周安全有效[17, 37, 40]。2002年的一项研究中,所有亚急性骨髓炎患儿在使用1~3周的肠外抗生素和2~4周的口服抗生素治疗后均达到愈合[25]。迄今为止文献报道的治疗方案都包括最初的静脉注射抗生素,以及后续的口服抗生素。至于给药方式的转换以及抗生素总疗程,主要取决于临床表现(压痛、体温)是否好转和实验室结果(CRP/ESR)是否恢复;同时也取决于是否有合适的口服抗生素、患儿口服药物的能力、患儿及其家属依从性[39-40]。
(二) 手术治疗手术的主要作用是清除化脓、坏死组织和死骨,从而改善局部环境,允许抗生素到达病变所在部位,从而防止疾病迁延成慢性[37]。手术内容包括骨膜切开,去除所有坏死组织,骨质缺损面积较大时,可用抗生素混合骨水泥珠填充,或局部使用含有高浓度抗生素的链珠,最近新推出的生物活性玻璃-S53P4是一种经证实具有抗菌、促进血管生成和骨粘合特性的骨替代物,可用于局部填充[43]。手术治疗的成功率为95% ~98%,在未使用任何抗生素的情况下,充分的手术清创可以成功治愈亚急性骨髓炎病变[2, 30]。
抗生素的联合使用也至关重要。在Silva等[37]的研究中,患者进行手术刮除引流并联合静脉使用抗生素14 d后改为口服抗生素2个月,这些患者最终预后尚可。Hogea等[26]对1例确诊为Brodie's脓肿的患者行手术清创,局部抗生素冲洗后采用单纯骨水泥填塞,术后依据脓液培养结果予敏感抗生素治疗6周,术后随访1年见患者患肢活动状况、影像学结果正常。Howard-jones等[15]认为骨血管重建需要在手术清创后3~4周再进行,所以术后可使用4~6周的肠外抗生素治疗。由于手术治疗可能导致相关后遗症,但对于脓肿性病变必须行手术治疗,所以我们倾向于单纯抗生素治疗或联合治疗。抗生素类别的选择、疗程以及手术时机的选择至关重要。
三、预后亚急性骨髓炎通常预后良好,但少部分可能出现生长障碍、病理性骨折,或转化为慢性骨髓炎等并发症[9, 14]。Blyth等[23]对儿童骨髓炎患者进行8年随访发现,亚急性骨髓炎患儿无一例并发症,其他类型骨髓炎患儿并发症发生率为12%(6/50)。有学者报道了4例病变集中在骨骺附近的Brodie's脓肿,其产生的远期影响为患肢生长刺激,但生长刺激均不明显,在测量X线双下肢长度时才能被发现;除疼痛或轻度膝外翻外,无其他明显异常[30];Ross等[44]报道一例病变位于股骨近端侵犯骺板的患儿,最终该患儿生长停滞;1984年一项有关6例病灶侵犯骺板的Brodie's脓肿患者的临床研究中,所有患者经14年随访均未发现生长异常[36]。
综上所述,儿童亚急性骨髓炎如早期诊断明确,无论经保守或手术治疗,通常均可获得良好预后。但下列问题仍存在争议:①儿童亚急性骨髓炎缺乏特异性临床表现,诊断依赖于临床医师的经验及综合判断,目前缺乏明确诊断标准;②明确诊断亚急性骨髓炎后应采取何种治疗方式暂不统一,单纯外科刮除病灶或联用抗生素治疗,术中是否需同时局部使用抗生素,或保守治疗即可,暂未达成共识;③儿童亚急性骨髓炎尚无理想的分期/分型体系可用于指导临床治疗及评估预后。以上均是国内外尚未明确的问题,仍需大量临床研究进一步证实。
利益冲突 所有作者声明不存在利益冲突
| [1] |
King DM, Mayo KM. Subacute haematogenous osteomyelitis[J]. J Bone Joint Surg Br, 1969, 51(3): 458-463. |
| [2] |
Gledhill RB. Subacute osteomyelitis in children[J]. Clin Orthop Relat Res, 1973, 96: 57-69. |
| [3] |
Roberts JM, Drummond DS, Breed AL, et al. Subacute hematogenous osteomyelitis in children: a retrospective study[J]. J Pediatr Orthop, 1982, 2(3): 249-254. DOI:10.1097/01241398-198208000-00003 |
| [4] |
Rasool MN. Primary subacute haematogenous osteomyelitis in children[J]. J Bone Joint Surg Br, 2001, 83(1): 93-98. DOI:10.1302/0301-620x.83b1.11180 |
| [5] |
St Jeor JD, Thomas KB, Thacker PG, et al. Multifocal subacute osteomyelitis in adjacent bones in the ankle without septic joint[J]. Radiol Case Rep, 2020, 15(10): 1927-1930. DOI:10.1016/j.radcr.2020.07.073 |
| [6] |
Foster CE, Taylor M, Schallert EK, et al. Brodie abscess in children: a 10-year single institution retrospective review[J]. Pediatr Infect Dis J, 2019, 38(2): e32-e34. DOI:10.1097/INF.0000000000002062 |
| [7] |
Hunter S, Chan H, Baker JF. Global epidemiology of childhood bone and joint infection: a systematic review[J]. Infection, 2022, 50(2): 329-341. DOI:10.1007/s15010-021-01741-3 |
| [8] |
Krzysztofiak A, Roversi M, Musolino A, et al. Clinical report and predictors of sequelae of 319 cases of pediatric bacterial osteomyelitis[J]. Sci Rep, 2022, 12(1): 14846. DOI:10.1038/s41598-022-19208-2 |
| [9] |
Salik M, Mir MH, Philip D, et al. Brodie's abscess: a diagnostic conundrum[J]. Cureus, 2021, 13(7): e16426. DOI:10.7759/cureus.16426 |
| [10] |
Ceroni D, Belaieff W, Cherkaoui A, et al. Primary epiphyseal or apophyseal subacute osteomyelitis in the pediatric population: a report of fourteen cases and a systematic review of the literature[J]. J Bone Joint Surg Am, 2014, 96(18): 1570-1575. DOI:10.2106/JBJS.M.00791 |
| [11] |
Ben Ghozlen H, Kaziz H, Abid F, et al. Management of subacute acetabular osteomyelitis in a child[J]. Arch Pediatr, 2015, 22(8): 861-864. DOI:10.1016/j.arcped.2015.05.001 |
| [12] |
Jaramillo D, Dormans JP, Delgado J, et al. Hematogenous osteomyelitis in infants and children: imaging of a changing disease[J]. Radiology, 2017, 283(3): 629-643. DOI:10.1148/radiol.2017151929 |
| [13] |
Zairi M, Boussetta R, Msakni A, et al. Subacute osteomyelitis of the tibial diaphysis associated with Brodie's abscess: a rare case report of a four-year-old child[J]. Int J Surg Case Rep, 2021, 89: 106453. DOI:10.1016/j.ijscr.2021.106453 |
| [14] |
Pabla R, Tibrewal S, Ramachandran M, et al. Primary subacute osteomyelitis of the talus in children: a case series and review[J]. Acta Orthop Belg, 2011, 77(3): 294-298. |
| [15] |
Howard-Jones AR, Isaacs D. Systematic review of systemic antibiotic treatment for children with chronic and sub-acute pyogenic osteomyelitis[J]. J Paediatr Child Health, 2010, 46(12): 736-741. DOI:10.1111/j.1440-1754.2010.01831.x |
| [16] |
Shih HN, Shih LY, Wong YC. Diagnosis and treatment of subacute osteomyelitis[J]. J Trauma, 2005, 58(1): 83-87. DOI:10.1097/01.ta.0000114065.25023.85 |
| [17] |
Olasinde AA, Oluwadiya KS, Adegbehingbe OO. Treatment of Bro-die's abscess: excellent results from curettage, bone grafting and antibiotics[J]. Singapore Med J, 2011, 52(6): 436-439. |
| [18] |
Agha RA, Franchi T, Sohrabi C, et al. The SCARE 2020 guideline: updating consensus Surgical CAse REport (SCARE) guidelines[J]. Int J Surg, 2020, 84: 226-230. DOI:10.1016/j.ijsu.2020.10.034 |
| [19] |
Aloui-Kasbi N, Hassad R, Nessib N, et al. L'ostéomyélite subai-guë: apport de l'imagerie à propos de 19 observations[J]. Feuillets de Radiologie, 2004, 44(4): 265-269. DOI:10.1016/S0181-9801(04)94752-5 |
| [20] |
Jaña Neto FC, Ortega CS, De Oliveira Goiano E. Epidemiological study of osteoarticular infections in children[J]. Acta Ortop Bras, 2018, 26(3): 201-205. DOI:10.1590/1413-785220182603145650 |
| [21] |
Michail M, Jude E, Liaskos C, et al. The performance of serum inflammatory markers for the diagnosis and follow-up of patients with osteomyelitis[J]. Int J Low Extrem Wounds, 2013, 12(2): 94-99. DOI:10.1177/1534734613486152 |
| [22] |
Cui CM, Fu MY, Gao BQ. Procalcitonin and pancreatic stone protein function as biomarkers in early diagnosis of pediatric acute osteomyelitis[J]. Med Sci Monit, 2017, 23: 5211-5217. DOI:10.12659/msm.904276 |
| [23] |
Blyth MJ, Kincaid R, Craigen MA, et al. The changing epidemiology of acute and subacute haematogenous osteomyelitis in children[J]. J Bone Joint Surg Br, 2001, 83(1): 99-102. DOI:10.1302/0301-620x.83b1.10699 |
| [24] |
Karmazyn B. Imaging approach to acute hematogenous osteomyelitis in children: an update[J]. Semin Ultrasound CT MR, 2010, 31(2): 100-106. DOI:10.1053/j.sult.2009.12.002 |
| [25] |
Ezra E, Cohen N, Segev E, et al. Primary subacute epiphyseal osteomyelitis: role of conservative treatment[J]. J Pediatr Orthop, 2002, 22(3): 333-337. |
| [26] |
Hogea BG, Patrascu JM, J r, Lazarescu AE, et al. Rare intercondylar distal femoral Brodie's abscess in a 21-year-old man who refused medical care for three years after initial symptoms[J]. Medicina (Kaunas), 2021, 57(6): 544. DOI:10.3390/medicina57060544 |
| [27] |
Alaia EF, Chhabra A, Simpfendorfer CS, et al. MRI nomenclature for musculoskeletal infection[J]. Skeletal Radiol, 2021, 50(12): 2319-2347. DOI:10.1007/s00256-021-03807-7 |
| [28] |
Grey AC, Davies AM, Mangham DC, et al. The 'penumbra sign' on T1-weighted MR imaging in subacute osteomyelitis: frequency, cause and significance[J]. Clin Radiol, 1998, 53(98): 587-592. DOI:10.1016/s0009-9260(98)80150-5 |
| [29] |
Davies AM, Grimer R. The penumbra sign in subacute osteomyelitis[J]. Eur Radiol, 2005, 15(6): 1268-1270. DOI:10.1007/s00330-004-2435-9 |
| [30] |
van der Naald N, Smeeing DPJ, Houwert RM, et al. Brodie's abscess: a systematic review of reported cases[J]. J Bone Jt Infect, 2019, 4(1): 33-39. DOI:10.7150/jbji.31843 |
| [31] |
Marui T, Yamamoto T, Akisue T, et al. Subacute osteomyelitis of long bones: diagnostic usefulness of the "penumbra sign" on MRI[J]. Clin Imaging, 2002, 26(5): 314-318. DOI:10.1016/s0899-7071(02)00440-0 |
| [32] |
Mohamed Z, Msakni A, Boussetta R, et al. Primary subacute hematogenous osteomyelitis of navicular bone: a rare case report in 7-year-old child[J]. Ann Med Surg (Lond), 2021, 71: 102911. DOI:10.1016/j.amsu.2021.102911 |
| [33] |
Ayati N, Norouzi M, Sadeghi R, et al. Diagnostic value of 99mTc-ubiquicidin scintigraphy in differentiation between osteomyelitis and bone tumors[J]. Nucl Med Commun, 2017, 38(11): 885-890. DOI:10.1097/MNM.0000000000000744 |
| [34] |
Yen C, Kaushik S, Desai SB. Image-guided percutaneous bone biopsy for pediatric osteomyelitis: correlating MRI findings, tissue pathology and culture, and effect on clinical management[J]. Skeletal Radiol, 2023, 52(1): 39-46. DOI:10.1007/s00256-022-04131-4 |
| [35] |
Bayram S, Bilgili F, Anarat FB, et al. Subacute osteomyelitis of the fibula due to Corynebacterium striatum in an immunocompetent child: a case report[J]. JBJS Case Connect, 2019, 9(2): e0220. DOI:10.2106/JBJS.CC.18.00220 |
| [36] |
Bogoch E, Thompson G, Salter RB. Foci of chronic circumscribed osteomyelitis (Brodie's abscess) that traverse the epiphyseal plate[J]. J Pediatr Orthop, 1984, 4(2): 162-169. DOI:10.1097/01241398-198403000-00003 |
| [37] |
Silva CI, Figueroa GMJ, Cañete CI, et al. Brodie's abscess, a pathology difficult to diagnose[J]. Rev Chil Pediatr, 2020, 91(6): 947-952. DOI:10.32641/rchped.vi91i6.1752 |
| [38] |
Kalu IC, Kao CM, Fritz SA. Management and prevention of Staphylococcus aureus infections in children[J]. Infect Dis Clin North Am, 2022, 36(1): 73-100. DOI:10.1016/j.idc.2021.11.006 |
| [39] |
Gutierrez K. Bone and joint infections in children[J]. Pediatr Clin North Am, 2005, 52(3): 779-794. DOI:10.1016/j.pcl.2005.02.005 |
| [40] |
Huang CY, Hsieh RW, Yen HT, et al. Short- versus long-course antibiotics in osteomyelitis: a systematic review and meta-analysis[J]. Int J Antimicrob Agents, 2019, 53(3): 246-260. DOI:10.1016/j.ijantimicag.2019.01.007 |
| [41] |
Congedi S, Minotti C, Giaquinto C, et al. Acute infectious osteomyelitis in children: new treatment strategies for an old enemy[J]. World J Pediatr, 2020, 16(5): 446-455. DOI:10.1007/s12519-020-00359-z |
| [42] |
Peltola H, Pääkkönen M, Kallio P, et al. Short- versus long-term antimicrobial treatment for acute hematogenous osteomyelitis of childhood: prospective, randomized trial on 131 culture-positive cases[J]. Pediatr Infect Dis J, 2010, 29(12): 1123-1128. DOI:10.1097/INF.0b013e3181f55a89 |
| [43] |
Cossio A, Graci J, Lombardo AS, et al. Bilateral tibial Brodie's abscess in a young patient treated with BAG-S53P4:case report[J]. Ital J Pediatr, 2019, 45(1): 91. DOI:10.1186/s13052-019-0685-z |
| [44] |
Ross ER, Cole WG. Treatment of subacute osteomyelitis in childhood[J]. J Bone Joint Surg Br, 1985, 67(3): 443-448. DOI:10.1302/0301-620X.67B3.3997957 |
 2023, Vol. 22
2023, Vol. 22


