患儿,男,9日龄,因呕血、血便4 d,发现腹部肿物3 d入院。患儿为G1P1,胎龄39+2周,体重2.75 kg。查体:上腹部可触及约6 cm×7 cm肿物,质地中等,边缘欠清,活动度差。血常规:白细胞计数(white blood cell, WBC)10.08×109/L、血红蛋白(hemoglobin, Hb)117 g/L、血小板计数(platelet, PLT)16 g/L;甲胎蛋白(alpha fetoprotein, AFP) 22 901.0 g/L;肝功能:总胆红素(total bilirubin, TBIL)134.2 mol/L、直接胆红素(direct bilirubin, DBIL)70.3 mol/L、间接胆红素(indirect bilirubin, IBIL)63.9 mol/L;凝血功能:纤维蛋白原(fibrinogen, Fg)0.65 g/L、纤溶酶原(plasminogen, PLG)28.5%;腹部彩超:肝门部混合性占位,大小约6.5 cm×4.5 cm,考虑肿物并内部出血,胰头显示不清,胰体尾、胆囊、脾脏未见异常回声,腹腔少量积液;CT:肝胃间隙软组织肿块,大小约6.4 cm×4.8 cm×7.0 cm,伴出血坏死,与相邻胃、十二指肠及胰腺分界不清,考虑胰母细胞瘤或外生性婴儿血管内皮瘤,增强CT提示肝门区肝动脉及其近段分支显示不清,肿块上部伴血管样强化(图 1A至图 1C);MRI:肝胃间隙软组织肿块伴出血坏死,怀疑外生性婴儿型血管内皮细胞瘤;与相邻胃、十二指肠及胰腺分界不清,右肾前缘受压。结合患儿有出血倾向及血小板明显减少,诊断为肝门部血管内皮瘤合并Kasabach-Merritt综合征(Kasabach-Merritt syndrome, KMS)。患儿有呕血及血便,给予禁食、胃肠减压、输血、输血浆、输血小板等治疗,2 d后患儿无呕血、排黑便或血便等消化道出血表现,留置胃管引流出墨绿色液体,大便呈淡黄色。6 d后复查血常规:PLT 70 g/L、Hb 82 g/L;肝功能:TBIL 138.3 mol/L、DBIL 89.1 mol/L;AFP 12 470 mol/L;给予甲基强的松龙、长春新碱加西罗莫司治疗,后PLT上升至198 g/L,但患儿出现反复呕吐、腹胀、血便、黄疸加重,改为单用西罗莫司。1个月后复查血常规:PLT 154 g/L、Hb 97 g/L;肝功能:TBIL 58.1 mol/L、DBIL 45.3 mol/L;复查超声:肝门部实性包块明显缩小,约5.0 cm×2.5 cm×2.1 cm大小,考虑为血管瘤。症状好转后出院继续口服西罗莫司,1个月后复查指标明显好转,血常规:PLT 276 g/L、Hb 119 g/L;肝功能:丙氨酸氨基转移酶(alanine aminotransferase, ALT)270 IU/L、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)201 IU/L、TBIL 39.2 mol/L、DBIL 30.4 mol/L;腹部超声提示肝门部实性包块较前缩小,大小约3.6 cm×1.9 cm×2.0 cm,考虑为血管瘤。

|
图 1 肝门部血管内皮瘤合并Kasabach-Merritt综合征患儿治疗前后腹部CT平扫及增强图片 Fig.1 Plain and enhanced abdominal CT images of this patient before and after treatment 注 A:治疗前CT平扫肝胃间隙可见一混杂密度软组织肿块,上部分突入肝内,稍低密度影;B:增强CT见动脉期肿块周边实性部分明显强化,随时间延迟实性部分强化程度减退,门静脉显示不清;C:腹主动脉血管造影见肝门区肝动脉及近段分支显示不清,肿块上方内部见血管强化;D:治疗5个月后肿块明显缩小,肝门区胆管周围见团片状不均匀强化影 |
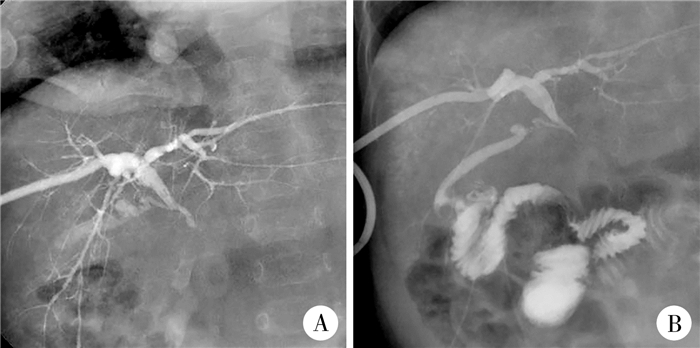
患儿6月龄时出现黄疸,大便呈陶土样,至当地医院就诊,超声提示:门静脉海绵样变,怀疑胆道闭锁,再次到本院就诊。查体:全身皮肤黄染,肝脾大,上腹部未触及肿物。血常规:PLT 199 g/L、Hb 127 g/L;凝血功能:Fg 1.62 g/L;肝功能:TBIL 219.1 mol/L、DBIL 187.0 mol/L、ALT 106 IU/L、AST 140 IU/L;腹部超声:肝门部片状低回声,大小约2.6 cm×1.2 cm,考虑为肝门部血管瘤治疗后改变,其内可见门静脉狭窄,肝内胆管扩张,胆囊、脾、胰无异常;CT:肝内胆管及肝门区胆管扩张,胆总管轻度扩张;肝门区胆管周围见团片状不均匀强化影,门静脉主干未见明显显示,肝内门静脉显影,较细小,怀疑门静脉海绵样变性(图 1D);MRI:门静脉主干显影不清,胆总管走行区周围见团状稍短T2信号影包绕,结合CT不排除门静脉海绵样变可能,胆总管中下段管径变窄,肝内胆管及左右肝管增宽,胆囊稍增大。诊断为:①梗阻型黄疸;②肝门部血管内皮瘤;③门静脉海绵样变。给予消炎利胆、护肝、退黄治疗,黄疸未消退,行经皮肝穿刺胆道引流术(percutaneous transhepatic cholangiography and drainage, PTCD)。术中造影示:肝内外胆管中重度扩张,胆囊及胆囊管扩张,胆总管胰头段梗阻,造影剂不能进入十二指肠,导丝不能通过梗阻部位,暂行胆道外引流管置入术,留置8F外引流管,胆汁引流通畅。术后黄疸逐渐消退,1周后复查肝功能:TBIL 58.5 mol/L、DBIL 46.5 mol/L,ALT 130 IU/L、AST 102 IU/L,胆道造影提示肝内外胆管中重度扩张,胆囊及胆囊管扩张,胆总管远端梗阻(图 2A)。患儿胆道远端梗阻持续不能解除,胆汁引流量大,每日300~400 mL,易出现水电解质失衡,遂决定手术治疗。术中见胆囊及胆总管扩张,合并门静脉海绵样变,肿瘤环绕胰腺段胆管生长,行胰十二指肠切除及胆总管空肠吻合风险较大,遂行腹腔镜胆囊空肠吻合术。术后1周PTC管造影提示:胆囊空肠吻合术后,吻合口未见明确狭窄及对比剂外漏征象,肝总管稍扩张,对比剂经胆囊空肠吻合口流入肠管内(图 2B);复查肝功能:TBIL 8.2 mol/L,DBIL 6.3 mol/L,ALT 112 IU/L,AST 91 IU/L;患儿黄疸明显消退,大便色黄,夹闭PTCD管无异常,予以拔除,病情好转后出院。1个月后复查肝功能,胆红素显著降低:TBIL 9.4 mol/L、DBIL 5.2 mol/L、ALT 29 IU/L、AST 45 IU/L,患儿黄疸消退,大便正常。6个月后复查彩超结果提示:肝门部未见明确肿物,肝门区未见独立门静脉主干,可见多处细小管腔回声,有入肝血流信号,胆囊与空肠吻合口通畅;肝功能:TBIL 16.8 mol/L、DBIL 4.7 mol/L、ALT 43 IU/L、AST 59 IU/L。10个月后复查彩超:肝门部未见明确肿物,门静脉高压,胆囊与空肠吻合口通畅;肝功能:TBIL 134.0 mol/L、DBIL 89.1 mol/L、ALT 43 IU/L、AST 59 IU/L。
|
图 2 肝门部血管内皮瘤合并Kasabach-Merritt综合征患儿手术前后胆道造影图像对比 Fig.2 Comparison of cholangiographic images before and after operation 注 A:胆道造影提示肝内外胆管中重度扩张,胆囊及胆囊管扩张,胆总管远端梗阻;B:术后经PTC管造影,提示胆囊空肠吻合术后吻合口通畅,未见明确狭窄及对比剂外漏征象,肝总管稍扩张 |
通过万方、维普、CNKI、PubMed数据库检索相关文献,检索关键词为:肝血管瘤(hepatic hemangioma)及Kasabach-Merritt综合征(Kasabach-Merritt syndrome),文献发表时间截至2021年12月。经筛选共纳入9例KMS病例(含本例),见表 1。除1例在孕期产检时发现肝脏占位外,其余8例均在出生后发病,7例发病年龄为出生后1~14 d,1例在14月龄时发病。临床表现均无特异性,辅助检查提示血小板及纤维蛋白原显著减少,肝脏可见巨大占位。直接行手术切除1例;2例行经皮肝动脉栓塞介入治疗,其中1例术后给予激素治疗;6例采用药物治疗,药物主要选用激素、西罗莫司、依维莫司或普萘洛尔等,肿瘤均有不同程度缩小,其中1例药物治疗后行肝段切除术,1例行介入治疗;本例患儿使用西罗莫司治疗后出现梗阻性黄疸,行胆囊- 空肠吻合术。9例患儿随访时间不一,治疗后肿瘤均不同程度缩小,治疗效果较满意。
| 表 1 2000—2021年文献报道肝血管瘤合并KMS的病例临床资料 Table 1 Reviewing cases of hepatic hemangioma plus KMS over the last two decades |
|
|
KMS以巨大血管瘤伴血小板减少和全身出血倾向为主要特征,可表现为全身出血倾向,发病急,短期内进行性加重,危及生命。KMS在儿童及成人均有报道,但以6个月以内儿童较为多见,男性发病率略高于女性。本组9例均为男性患儿,8例在新生儿期发病。血管瘤多发生于大腿及臀部,也有心脏、肝脏、脾脏、肾脏等部位血管瘤合并KMS的病例报道[8]。婴幼儿肝血管瘤(infantile hepatic hemangioma, IHH)是婴幼儿肝脏最常见的肿瘤,临床上也可引起血小板减少,但IHH引起的贫血及血小板减少是轻微的,而KMS患儿血小板显著减少,通常为10×109~40×109/L[9-10]。IHH好发于肝内,以肝右叶最为常见,文献报道的8例KMS均发生在肝内。本院收治的患儿为9日龄,血小板显著减少(16×109/L),考虑诊断为KMS,患儿肿瘤位于肝门部,临床未见报道。
KMS常表现为血管瘤突然迅速增大、扩散,表面紫红、质硬,似急性炎症,伴有血小板减少及凝血功能异常,尤其是纤维蛋白原降低,严重可致出血及弥散性血管内疑血[11]。文献报道的8例患儿均有不同程度的出血倾向,部分病例合并心动过速、呼吸衰竭及心力衰竭等,临床表现较为复杂。B超、CTA、MRI及DSA对本病有一定诊断价值,但病变位于内脏和腹膜后时诊断较为困难,确诊常需依靠病理检查[12]。本例患儿肿瘤位于肝胃间隙,肿瘤极为巨大,早期因呕血、便血在当地医院治疗,后因检查发现腹部肿块转入本院,临床表现缺乏特异性。入院后查血常规提示血小板明显降低,纤维蛋白原降低,影像学检查提示肝胃间隙软组织肿块内伴血管样渐进式强化,符合血管内皮瘤表现,经多学科会诊后诊断为肝门部血管内皮瘤合并KMS。
KMS病情进展极快,一旦发病应尽快采取有效方法控制血小板减少,改善低凝状态,去除血管瘤或促进其消退。治疗方案主要包括:输入血小板或血浆等支持治疗、手术治疗、激素治疗、干扰素及普萘洛尔治疗、放疗、化疗、介入治疗等,常需根据病情采用个体化治疗方案[8]。手术切除血管瘤病灶、改善低凝状态,是KMS最快、最有效的治疗方法,但术前必须通过药物治疗或输入血小板,使血小板计数接近正常后再行手术,以减少术中大出血[13]。有文献指出,血小板输注仅适用于紧急情况或术前增加血小板,不提倡作为常规治疗,因为血管瘤会消耗血小板,输注血小板可通过诱发凝血,使血管瘤增大,加重KMS[14-15]。张元元等[16]提出KMS的治疗多采用糖皮质激素,应用大剂量冲击治疗后给予维持治疗,效果优于单用常规小剂量维持治疗。《小儿肝血管瘤诊断和治疗专家共识》提出,普萘洛尔是目前治疗小儿肝血管瘤的一线用药[17]。然而,仍有一些患者使用普萘洛尔治疗失败[18]。有研究发现西罗莫司对于普萘洛尔治疗失败的患儿可以取得满意治疗效果,且不良反应较轻。西罗莫司是一种新型的大环内酯类免疫抑制剂,具有免疫抑制和抑制肿瘤增生效果[19]。2010年西罗莫司用于治疗卡波西样血管内皮瘤(kaposiform hemangioendothelioma, KHE)以来,多项研究报道了西罗莫司治疗KMS和KHE的成功案例。其用药方式为口服,相对安全,但长期使用有暴露于免疫抑制的风险,易继发感染[5, 20-21]。文献回顾中早期多采用积极手术或介入治疗,但近年来随着研究深入,越来越多的病例采用药物治疗取得满意结果,文献中有5例药物治疗后肿瘤均有不同程度缩小,其中使用最多的是激素类药物。本例患儿肿瘤包裹肝门部的重要血管及胆道,凝血功能差,难以手术切除肿瘤,肿瘤血供来源不清,介入手术困难,故给予西罗莫司口服,治疗2个月后肿瘤缩小至3.6 cm×1.9 cm×2.0 cm,复查血小板、凝血功能均恢复正常,治疗5个月后患儿肿瘤缩小至2.6 cm×1.2 cm×1.0 cm,这进一步证实了西罗莫司治疗肝门部血管瘤的有效性。
患儿治疗5个月后出现黄疸、排陶土样便等胆道梗阻症状,病因不明。当肝脏血管瘤靠近肝门时,可因外在压迫引起胆管狭窄,且KMS可引起消耗性凝血功能障碍,使胆管血流障碍、局部缺血后发生纤维化改变,引起胆道梗阻[8, 22]。Harmanci等[9]总结了门静脉海绵样变性导致胆道梗阻的原因,认为门静脉海绵样变可诱导胆道纤维化、胆道动力丧失、慢性胆汁淤积和胆结石形成增加而导致胆道梗阻。本例患儿肿瘤位于肝门部,合并门静脉海绵样变性,两者均可引起胆道梗阻。在治疗方案选择上,肿瘤位于胰头部,若切除肿瘤,需行胰十二指肠切除术,但患儿合并门静脉海绵样变,分离肿瘤时易损伤侧支循环,加重门静脉高压,手术主要为解决胆道梗阻,遂行PTCD,术中发现患儿胆道完全梗阻,造影剂及导丝难以通过,扩张治疗难以实施,予放置外引流管,解除梗阻后患儿黄疸症状好转。然而,PTCD使梗阻的胆汁排出体外而并非排入肠道,减少了高胆红素血症的发生,延长了存活时间,但也可能引起消化不良、电解质紊乱、胆道感染等并发症,因此,体外引流是为根治性切除做准备,不宜长期留置[23]。本例患儿术后胆道持续不能排入肠管内,胆汁外引流量大,需长期补液以维持水电解质平衡,同样难以长期保留,遂决定行手术治疗。手术方案选择较为困难,胆总管空肠吻合或胰十二指肠切除术均需对胆管进行充分解剖,损伤门静脉侧支循环可能性大,可加重门静脉高压。腹腔镜胆囊空肠吻合术临床应用较少,Li等[23]分析了13例成功行腹腔镜改良袢式胆囊空肠吻合术的病例资料,提出传统的Roux-en-Y吻合术需要手术切除胆囊和胆总管,并进行端侧吻合,容易导致吻合口狭窄、反流性胆管炎和胆漏,改良胆囊空肠吻合术安全、简便,不需要切除胆囊或横断空肠,手术时间、术后肠道功能恢复时间、住院时间均明显短于Roux-en-Y吻合术。本例患儿胆总管下段梗阻后,胆囊、胆囊管被动充盈性扩张,胆囊管内层螺旋状黏膜瓣变为扁平,通畅性较好,取胆囊底部与空肠吻合,术后退黄效果良好,复查胆汁引流通畅,短期随访效果满意。
综上所述,对于婴儿巨大血管瘤合并顽固性血小板减少及纤维蛋白原下降的患儿应考虑KMS。本病治疗方法多样,需根据患儿病情综合评估后制定个体化诊疗方案。肝门部血管瘤常与肝动脉、门静脉关系紧密,实施手术治疗困难,药物治疗是首选。糖皮质激素及普萘洛尔为常用药物,近年来,西罗莫司在临床上应用越来越广泛,本例患儿应用后取得良好效果。血管瘤累及肝门部常引起门静脉高压,治疗主要针对门静脉高压引起的并发症,对于食管静脉曲张没有出血的患儿以护肝为主,如发生出血可行内镜治疗、外科断流及分流手术,近年来实施的Rex手术对于门静脉海绵样变性引起的门静脉高压可以达到根治的效果,应用越来越广泛[24-25]。胆道梗阻的患儿行胆管空肠吻合更为有效,但难以实施时选择胆囊空肠吻合也是可行的。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 李楠、王健俊、罗彩云、侯欣微负责病人管理及随访、病例数据收集及起草论文,黄昭榕、杨惠荣、杨佳明完成文献检索及图表绘制,吴凯负责研究指导及对文章进行审阅
| [1] |
Akiyoshi K, Mizote H, Tanaka Y, et al. Capillary hemangioma of the liver with Kasabach-Merritt syndrome in a neonate: report of a case[J]. Surg Today, 2000, 30(1): 86-88. DOI:10.1007/PL00010055 |
| [2] |
Billio A, Pescosta N, Rosanelli C, et al. Treatment of Kasabach-Merritt syndrome by embolisation of a giant liver hemangioma[J]. Am J Hematol, 2001, 66(2): 140-141. DOI:10.1002/1096-8652(200102)66:2<140::AID-AJH1031>3.0.CO;2-5 |
| [3] |
Shen WC, Liang PC, Wu JF, et al. Combined transarterial embolization and propranolol as effective treatment for hepatic hemangioma with Kasabach-Merritt syndrome and heart failure in a neonate[J]. Pediatr Neonatol, 2017, 58(2): 191-193. DOI:10.1016/j.pedneo.2016.01.008 |
| [4] |
Watanabe S, Manabe M, Miyata M, et al. A case of neonate effectively treated with everolimus for giant hepatic hemangioma complicated with congenital duodenal atresia and Kasabach-Merritt syndrome[J]. J Neonatal Perinatal Med, 2021, 14(3): 437-440. DOI:10.3233/NPM-200504 |
| [5] |
王英豪, 戴立英, 王丽丽, 等. 16例新生儿卡梅综合征临床分析[J]. 中国当代儿科杂志, 2021, 23(7): 696-701. Wang YH, Dai LY, Wang LL, et al. Clinical features of Kasabach-Merritt syndrome: a report of 16 neonates[J]. Chin J Contemp Pediatr, 2021, 23(7): 696-701. DOI:10.7499/j.issn.1008-8830.2103146 |
| [6] |
李先红, 张健, 戴立英, 等. 5例新生儿婴儿型肝血管内皮瘤报道[J]. 重庆医学, 2022, 51(5): 783-785, 790. Li XH, Zhang J, Dai LY, et al. Diagnosis and treatment of infantile hepatic hemangioendothelioma: a report of 5 cases[J]. Chongqing Med, 2022, 51(5): 783-785, 790. DOI:10.3969/j.issn.1671-8348.2022.05.013 |
| [7] |
Selzer Soria EM, Malla I. Propranolol treatment in Kasabach-Merritt Syndrome secondary to congenital hepatic hemangioma: clinical case[J]. Arch Argent Pediatr, 2021, 119(1): e65-e69. DOI:10.5546/aap.2021.e65 |
| [8] |
吴凯, 王健俊, 何继贤, 等. 结肠系膜血管瘤合并Kasabach-Merritt综合征破裂伴失血性休克1例并文献复习[J]. 临床小儿外科杂志, 2019, 18(3): 247-249. Wu K, Wang JJ, He JX, et al. Rupture of mesenteric Kasabach-Merritt syndrome associated with hemorrhagic shock: one case report with a literature review[J]. J Clin Ped Sur, 2019, 18(3): 247-249. DOI:10.3969/j.issn.1671-6353.2019.03.018 |
| [9] |
Harmanci O, Bayraktar Y. How can portal vein cavernous transformation cause chronic incomplete biliary obstruction?[J]. World J Gastroenterol, 2012, 18(26): 3375-3378. DOI:10.3748/wjg.v18.i26.3375 |
| [10] |
杨开颖, 彭素华. 婴幼儿肝血管瘤诊治现状[J]. 临床小儿外科杂志, 2020, 19(8): 746-751. Yang KY, Peng SH. Current status of diagnosing and treating infantile hepatic hemangioma[J]. J Clin Ped Sur, 2020, 19(8): 746-751. DOI:10.3969/j.issn.1671-6353.2020.08.016 |
| [11] |
O'Rafferty C, O'Regan GM, Irvine AD, et al. Recent advances in the pathobiology and management of Kasabach-Merritt phenomenon[J]. Br J Haematol, 2015, 171(1): 38-51. DOI:10.1111/bjh.13557 |
| [12] |
Chen YJ, Wang CK, Tien YC, et al. MRI of multifocal kaposiform haemangioendothelioma without Kasabach-Merritt phenomenon[J]. Br J Radiol, 2009, 82(975): e51-e54. DOI:10.1259/bjr/16482217 |
| [13] |
齐鸿燕, 马琳, 张金哲. 婴儿巨大血管瘤合并血小板减少综合征8例[J]. 临床小儿外科杂志, 2008, 7(6): 47-48, 50. Qi HY, Ma L, Zhang JZ. Infantile giant hemangioma with thrombocytopenia syndrome: a report of 8 cases[J]. J Clin Ped Sur, 2008, 7(6): 47-48, 50. DOI:10.3969/j.issn.1671-6353.2008.06.016 |
| [14] |
Peker E, Kırımı E, Tuncer O, et al. Brachial plexus paralysis due to giant cavernous hemangioma with Kasabach-Merritt syndrome: successful management with interferon alpha[J]. Platelets, 2009, 20(8): 603-605. DOI:10.3109/09537100903247790 |
| [15] |
Wang P, Zhou W, Tao L, et al. Clinical analysis of Kasabach-Merritt syndrome in 17 neonates[J]. BMC Pediatr, 2014, 14(1): 146. DOI:10.1186/1471-2431-14-146 |
| [16] |
张元元, 张永红, 罗洁, 等. 血管瘤伴血小板减少综合征11例[J]. 中国小儿血液与肿瘤杂志, 2007, 12(2): 64-67. Zhang YY, Zhang YH, Luo J, et al. Kasabach-Merritt syndrome: a report of 11 cases[J]. J China Pediatr Blood Cancer, 2007, 12(2): 64-67. DOI:10.3969/j.issn.1673-5323.2007.02.005 |
| [17] |
中华医学会小儿外科学分会肝胆外科学组, 中华医学会小儿外科学分会肿瘤学组. 小儿肝血管瘤诊断和治疗专家共识[J]. 中华小儿外科杂志, 2020, 41(11): 963-970. Group of Hepatobiliary Surgery, Branch of Pediatric Surgery, Group of Oncology, Branch of Pediatric Surgery, Chinese Medical Association. Expert Consensus on Diagnosing and Treating Hepatic Hemangioma in Children[J]. Chin J Pediatr Surg, 2020, 41(11): 963-970. DOI:10.3760/cma.j.cn421158-20200228-00124 |
| [18] |
吴泽键, 林四平, 潘彧, 等. 雷帕霉素对普萘洛尔治疗无效的血管瘤患儿临床疗效分析[J]. 岭南现代临床外科, 2018, 18(4): 383-385. Wu ZJ, Lin SP, Pan Y, et al. Clinical efficacy of rapamycin for infantile hemangioma after failed propranolol treatment[J]. Lingnan Mod Clin Surg, 2018, 18(4): 383-385. DOI:10.3969/j.issn.1009-976X.2018.04.003 |
| [19] |
Cho YJ, Kwon H, Kwon YJ, et al. Effects of sirolimus in the treatment of unresectable infantile hemangioma and vascular malformations in children: a single-center experience[J]. J Vasc Surg Venous Lymphat Disord, 2021, 9(6): 1488-1494. DOI:10.1016/j.jvsv.2021.03.014 |
| [20] |
Wang Y, Kong LL, Sun BH, et al. Sirolimus for Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon in two infants[J]. J Craniofac Surg, 2020, 31(4): 1074-1077. DOI:10.1097/SCS.0000000000006301 |
| [21] |
Lackner H, Karastaneva A, Schwinger W, et al. Sirolimus for the treatment of children with various complicated vascular anomalies[J]. Eur J Pediatr, 2015, 174(12): 1579-1584. DOI:10.1007/s00431-015-2572-y |
| [22] |
Yano T, Kobayashi T, Kuroda S, et al. Obstructive jaundice caused by a giant liver hemangioma with Kasabach-Merritt syndrome: a case report[J]. Surg Case Rep, 2015, 1(1): 93. DOI:10.1186/s40792-015-0095-4 |
| [23] |
Li JX, Zhuo SJ, Chen BH, et al. Clinical efficacy of laparoscopic modified loop cholecystojejunostomy for the treatment of malignant obstructive jaundice[J]. J Int Med Res, 2020, 48(2): 300060519866285. DOI:10.1177/0300060519866285 |
| [24] |
温哲, 张宾宾. 儿童肝前性门静脉高压的术前评估及手术治疗[J]. 临床小儿外科杂志, 2019, 18(12): 994-998. Wen Z, Zhang BB. Preoperative assessments and operations for prehepatic portal hypertension in children[J]. J Clin Ped Sur, 2019, 18(12): 994-998. DOI:10.3969/j.issn.1671-6353.2019.12.002 |
| [25] |
孙蕊, 李龙. 儿童门静脉海绵样变性的外科手术治疗研究进展[J]. 临床小儿外科杂志, 2020, 19(12): 1145-1151. Sun R, Li L. Research advances of surgery for cavernous transformation of portal vein in children[J]. J Clin Ped Sur, 2020, 19(12): 1145-1151. DOI:10.3969/j.issn.1671-6353.2020.12.016 |
 2023, Vol. 22
2023, Vol. 22


