2. 粤北人民医院小儿外科, 韶关 512026;
3. 华中科技大学协和深圳医院小儿外科, 深圳 518000
2. YueBei People's Hospital, Shaoguang 512026, China;
3. Huazhong University of Science and Technology Union Shenzhen Hospital (Nanshan Hospital), Shenzhen 518000, China
胰岛素样因子3(insulin-like factor 3, INSL3)是结构类似于胰岛素的小肽类激素,其受体为松弛素家族受体2(relaxin family peptide receptor 2, RXFP2)。INSL3与RXPF2形成受体配体复合物,对睾丸引带发育起到重要作用,为睾丸下降所必须,其通路异常会导致睾丸下降不全。国内外针对INSL3-RXFP2的研究虽然较多,但大多局限于其对男性睾丸引带的影响。事实上,RXFP2受体不仅表达于睾丸引带,还表达于雄性生殖系统的其他位置,且INSL3-RXFP2也并非雄性所特有,在雌性个体中也见分布,且发挥相应作用。本文对INSL3-RXFP2与两性生殖系统的关系进行综述。
一、INSL3的分布与结构INSL3主要由男性睾丸间质细胞(Leydig cell)及女性卵泡上的膜细胞(thecal cell)分泌,除此之外亦可表达于前列腺(基底细胞)、子宫内膜(腺细胞、上皮细胞及基质细胞)、乳腺、胎盘(滋养层细胞)[1]。睾丸在胚胎时期已能分泌INSL3并能在母体羊水中被检测出[2-3]。INSL3中文名称为胰岛素样蛋白,顾名思义,其结构与胰岛素类似,有类似于胰岛素的B — C — A结构(C链连接A链和B链)。将C链经酶切后,A链和B链仍由两个二硫键连接(图 1)[4]。其中A链第10、11、15、24位和B链的第10、22位均有胱氨酸,胱氨酸基团之间可形成保守的二硫键。A链的10、15位胱氨酸形成链内二硫键,A链的11、24位分别和B链的第10、22位形成链间二硫键。INSL3 B链第27位的色氨酸是与RXFP2结合的重要因素。此外,B链上的H12、R16、V19、R20均会影响其与RXFP2的结合[5]。A链与RXFP2的结合力不如B链,但单独的B链与RXFP2结合后无法激活受体,故A链对受体激活起到重要作用[6]。
|
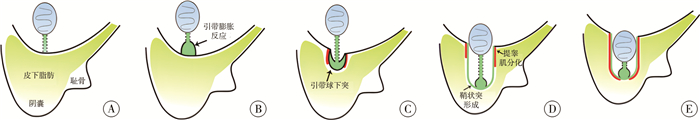
图 1 睾丸逐步降至阴囊过程图 Fig.1 Progressive descent of testis into scrotum 注 A:睾丸引带为图中标记的绿色索带,此时尚未发生膨胀反应;B:睾丸引带的远端发生膨胀反应;C:引带球逐步向腹股沟区脂肪垫迁移;D:引带球在迁移的过程中,内衬逐步演化为鞘状突,外层逐步分化为提睾肌;E:睾丸在引带的牵引下最终到达阴囊 |
RXFP2是INSL3的特异性受体,主要表达于睾丸引带及睾丸(睾丸间质细胞、输精小管上的生殖细胞、间质细胞),还表达于卵巢(卵细胞)、脑(下丘脑、纹状体、特定部位的大脑皮质)、肾(肾小球及系膜细胞)、肌肉、甲状腺、骨、前列腺、子宫、外周淋巴细胞[1, 7]。睾丸间质细胞和卵泡膜细胞既能分泌INSL3,又表达INSL3的受体RXFP2[8-10]。INSL3-RXFP2在两性生殖系统中同时存在自分泌及旁分泌调节。
RXFP2属于G蛋白耦连受体之一,其结构包括胞外N端、胞内C端及七次穿模结构。胞外结构主要包括10个富含亮氨酸的重复序列(leucine-rich repeats,LRRs)及LDL-A模块(图 2)[1]。LRR是RXFP2与配体的一个结合位点。INSL3与RXFP2的结合主要依赖其B链和LRR域的各基团协同,如B链上的R16与RXFP2的D227、H12与RXFP2的W177、V19与RXFP2的I179、R20与RXFP2的E229和D181、W27与RXFP2的F131和Q133结合。其中W27和R20对于RXFP2的结合最重要[11]。而LDL-A模块不参与受体与INSL3的结合,却与下游通路的激活相关。LDL-A具有以下特点:①敲除LDL-A模块后RXFP受体将无法产生下游信号;②游离的LDL-A不能产生下游信号,且还会对受体的激活产生拮抗;③LDL-A具有特异性,用不同类型松弛素家族肽受体之间的LDL-A混搭后,即使与配体结合,也无法完全激活下游通路[12-14]。因此有学者提出,LDL-A是激活RXFP2受体上的G蛋白的真正“钥匙”,只有当INSL3与RXFP2结合后,受体发生结构改变,LDL-A模块才有机会与RXFP2受体上的某个具有高度特异性的结构域结合,进而启动G蛋白及下游信号[12]。七次穿膜结构的胞内环,是G蛋白锚定的位置,而胞外环是INSL3 A链与受体结合的另一个位点[1]。

|
图 2 卵泡结构示意图 Fig.2 Schematic diagram of follicular structure |
RXFP2在内质网合成完毕后,需要对5个位点进行天冬酰胺-糖基化修饰才能转运至细胞膜[15]。这5个位点位于受体的LRR区域、N末端及LDLa模块。若这5个位点对应的基因突变导致天冬酰胺-糖基化修饰失败,并不影响受体表达,也不影响受体激活及下游信号的传导,但会使RXFP2无法正常转运至细胞膜,导致受体数量减少。
INSL3与RXFP2结合后,若受体激活了Gαs,则激活了腺苷酸环化酶(adenylyl cyclase, AC),使得cAMP增加。若激活了Gi(GαoB, Gβγ)则抑制AC,降调cAMP的产生。受体结合G蛋白的类型取决于不同的细胞。睾丸引带细胞的RXFP2与INSL3结合后激活的Gαs,而生殖细胞的RXFP2与INSL3结合后激活的是Gi[1]。
三、INSL3-RXFP2与雄性睾丸下降在胚胎时期,睾丸位于肾周,睾丸引带一端连接着睾丸,一端连接着“内环口”(图 1)。在引带的牵引下,睾丸逐步降至阴囊,下降过程分为腹腔阶段及腹股沟阴囊阶段。INSL3-RXFP2与睾丸下降密切相关。
(一) 腹腔阶段在腹腔阶段(人妊娠第20~23周,小鼠妊娠第15.5~17.5天),INSL3-RXFP2介导引带细胞增殖分化,主要表现为细胞增殖分化并向引带远端迁移,透明质酸、粘多糖沉积,最终导致引带远端发生膨胀,形成引带球[6, 16-17]。在敲除RXFP2的小鼠中,引带无法发生膨胀反应,引带内部细胞的凋亡速度明显大于野生型小鼠[17]。故INSL3-RXFP2参与了引带的发育,膨大的引带拓宽了腹股沟管管径,利于睾丸下降入阴囊。
(二) 腹股沟阴囊阶段在腹股沟阴囊阶段(人类妊娠第24~34周,小鼠妊娠第18天至出生后第19天),一开始凸向腹腔的引带球逐渐向腹股沟方向下突,最后凸向阴囊。引带球向腹股沟方向迁徙的过程中,会打开一条通道(腹股沟管),引带的内层结构形成鞘状突,外层的间叶细胞会进一步分化成提睾肌。在睾丸下降的第二阶段,提睾肌细胞的RXFP2受体表达较前更活跃[18]。RXFP2被敲除的小鼠,其引带外层的间叶细胞无法分化为提睾肌,仅发育为细长、没有肌肉包裹的纤维残迹[17]。故INSL3-RXFP2可能参与了提睾肌的分化。
(三) INSL3-RXFP2调控wnt及Notch参与提睾肌分化引带分化为提睾肌需要INSL3-RXFP2及其下游基因共同参与。Kaftanovskaya等[17]利用Cre/loxp系统及转基因Tg(shRNA)选择性抑制引带细胞RXFP2的表达,结果发现,引带最外层间叶细胞不仅无法分化为提睾肌,且下游的Wnt/β-catenin及Notch等表达也明显下调。Johnson等[19]学者也证明INSL3-RXFP2能上调引带细胞中Wnt基因的表达。通过免疫组化染色发现,Notch1及Wnt/β-catenin主要存在于雄性小鼠的引带小球外缘,且与肌肉分化的标志物desmin共同表达[17]。敲除Wnt/β-catenin或Notch的小鼠均表现为睾丸引带发育不良,引带外层缺乏横纹肌,只有散乱的成肌细胞,这与敲除RXFP2的小鼠表现类似[17]。因此Wnt/β-catenin及Notch为INSL3-RXFP2的下游通路,共同参与引带外周的成肌分化。
四、INSL3-RXFP2与雄性生殖细胞 (一) INSL3-RXFP2作用于雄性生殖细胞后激活Gi而非GsRXFP2受体锚定Gi及Gs蛋白,Gs会激活腺苷酸环化酶并产生cAMP,而Gi与之相反[1]。INSL3作用于非生殖细胞(如引带细胞)上的RXFP2而激活Gs,引起cAMP升高[5]。与睾丸引带细胞不同,Kawamura等[7]通过实验发现,INSL3作用于生殖细胞后激活了Gi而非Gs,并降低了细胞内cAMP浓度,加入百日咳毒素(Gi抑制剂),却几乎完全抑制INSL3的作用。
(二) INSL3-RXFP2具有抗雄性生殖细胞凋亡作用动物实验证明,INSL3-RXFP2具有抗雄性生殖细胞凋亡作用[20-21]。Kawamura等[7]利用GnRH拮抗剂(GnRH antagonist, GnRH-ant)处理小鼠睾丸,从而制造生殖细胞凋亡模型,将小鼠分为实验组(INSL3+GnRH-ant组、GnRH-ant组)及空白对照组,干预培养相同时间后对三组小鼠睾丸组织内的DNA末端行蓝色荧光标记并完成电泳实验。凋亡细胞的DNA会裂解成小片段,电泳后呈阶梯状分布。实验结果提示,相比于INSL3+ GnRH-ant组,GnRH-ant组的生殖细胞DNA更为碎片化,呈阶梯状分布,这意味着INSL3对雄性生殖细胞具有抗凋亡作用[7]。
(三) INSL3-RXFP2表达缺失并非雄性不育及生殖细胞凋亡的直接原因将INSL3或者RXFP2基因敲除的小鼠,会出现不同程度的睾丸下降不全,且睾丸内的精原细胞、精细胞及精子大量凋亡,进而导致不育[22]。虽然INSL3-RXFP2具有抗雄性生殖细胞凋亡作用,但INSL3-RXFP2的缺失并非生殖细胞凋亡的直接原因。Huang等[23]通过转入Stra8-icre选择性抑制生殖细胞中RXFP2的表达(不影响引带细胞,排除了睾丸下降不全等因素对生殖细胞存活的影响),结果显示转基因组小鼠的附睾、精囊、睾丸的净重和正常小鼠无明显差异,精子的发生、数量、活力及小鼠的生育能力也完全正常。利用荧光激活细胞分选技术对各阶段生殖细胞进行分析的结果提示,敲除RXFP2对处于各时期生殖细胞的数量及比例没有影响。利用TUNEL技术进行凋亡细胞测定提示敲除RXFP2并未加速生殖细胞凋亡[23]。因此推断,INSL3-RXFP2缺失不会直接导致雄性生殖细胞凋亡及不育。
有学者指出,INSL3-RXFP2的异常并非导致隐睾患者生育能力下降的直接原因,精原干细胞(spermatogonia stem cell, SSC)的耗竭才是问题所在。敲除RXFP2基因的隐睾小鼠精原细胞数目虽明显减少,但精原细胞凋亡率与对照组相比未见明显差异[24]。在小鼠中,As精原细胞及Ap精原细胞分泌的NANOS2是维持SSC静默状态(不参与分化)的关键因素,支持细胞分泌的GDNF、FGF2是维持SSC自我更新的关键因子。GDNF作用于SSC上的GFRα1及协同受体RET[24]。在RXFP2敲除小鼠中,GDNF、FGF2、NANOS2及RET均明显下调。因此在INSL3-RXFP2异常的隐睾小鼠中,其SSC的耗竭更可能与SSC代偿性分化的增加及自我更新的减少有关。虽然RXFP2在分化的雄性生殖细胞上有表达,但在SSC以及为SSC提供保护的支持细胞中均未见表达[23]。所以INSL3-RXFP2异常并不会直接引起隐睾中SSC的储备下降。我们推断,INSL3-RXFP2信号缺失导致睾丸下降不全,而下降不全的睾丸所处的温度环境不利于生殖细胞存活,引起生殖细胞凋亡,因此SSC代偿性分化增多,但SSC自我复制减少,最终干细胞池中的SSC耗尽,引起生育能力下降[24-25]。因此在诱导生殖细胞凋亡的异常环境中(如GnRH拮抗、环境干扰激素存在或睾丸温度上升等),INSL3-RXFP2有抗凋亡作用,但INSL3-RXFP2缺失并非生殖细胞凋亡的直接原因,而是隐睾所致睾丸温度上升[26]。对INSL3或RXFP2敲除的隐睾小鼠进行睾丸下降固定术后,小鼠生育能力得到一定程度的恢复,也说明了这一点[16]。
四、INSL3-RXFP2对雌性生殖系统的关系 (一) INSL3与雌激素合成的新“两细胞学说”女性卵巢中INSL3主要由卵泡上的膜细胞(theca cell, TC)分泌,而RXFP2仅表达于卵细胞,在卵泡颗粒层及卵丘细胞中均未见表达。在新的“两细胞学说”中,INSL3参与了女性的生理周期,在旧版教材关于雌激素合成的“两细胞学说”中却没有提及,我们将对新的“两细胞学说”进行简要介绍(图 2、图 3)。

|
图 3 新“两细胞学说”示意图 Fig.3 Schematic diagram of new two-cell theory 注 LH处于基础水平时刺激卵泡膜细胞合成雄烯二酮(雌激素前体),再经颗粒细胞进一步加工为雌激素。LH也刺激卵泡膜细胞分泌INSL3,INSL3能刺激卵泡膜细胞分泌雌激素前体(雄烯二酮),雌激素及其前体也可作用于卵泡膜细胞,正反馈上调INSL3表达,加之INSL3又能刺激自身合成,形成正反馈闭环调节,INSL3就相当于LH的信号放大器。然而LH达到峰值时,LH峰会抑制INSL3合成,使雌激素停止合成, 到达到第一个雌激素峰,雌激素峰也会抑制LH产生,最后雌激素和LH逐渐趋于基础水平,就此形成一个生理周期 |
当LH处于基础水平时,能刺激TC分泌INSL3,而INSL3又会作用于TC自身的RXFP2,一方面正反馈刺激INSL3的合成,另一方面上调了雄烯二酮(4-androstenedione, A4)的合成[10, 27]。A4是卵泡颗粒细胞(granulose cell, GC)合成雌激素的前体,A4穿过基底膜到达卵泡颗粒细胞,在芳香酶的作用下转化为雌激素(E1、E2)。而E1、E2、A4亦可作用于卵泡膜细胞内的雌激素受体,继续正反馈上调INSL3的表达[10]。这意味着INSL3-RXFP2在女性卵巢中充当着LH-LHR的信号放大器。但当女性生理周期LH达到峰值时,大剂量LH反而抑制INSL3的表达(通过上调骨成型蛋白BMP来抑制INSL3),使雌激素的合成停止,而雌激素达到第一个峰值后反而会抑制LH产生,和LH一起逐渐趋于基础水平,就此成一个生理周期[28]。
(二) LH、hCG及INSL3相互协同促进卵细胞成熟卵泡发育程度和INSL3的分泌水平基本吻合,卵泡分泌INSL3的高峰期为窦状卵泡期,在卵泡退化时INSL3分泌水平开始下降,可见INSL3与卵泡的成熟度密切相关。有学者取雌鼠的卵母细胞在不同激素环境下进行体外培养,然后观察卵细胞生发泡破裂(germinal vesicle breakdown,GVBD),GVBD是卵细胞成熟的标志[7]。该实验证明:①哺乳动物未成熟的卵细胞通过维持胞内高水平的cAMP使自身在排卵前停滞在减数第一次分裂前期,只有当cAMPs水平下降才能恢复减数第一次分裂;②LH、hCG能促进INSL3表达,而这三者都能促进卵细胞成熟;③INSL3通过Gi降调cAMP的方式促进GVBD,即促进卵细胞成熟并完成减数第一次分裂;④INSL3能促进卵细胞成熟,但不同于LH及hCG的是,INSL3并不能促排卵(卵泡破裂排卵),所以促排卵与卵细胞促熟的调节机制是不完全一致的。
(三) INSL3与女性生殖系统疾病在动物实验中,将INSL3基因敲除的雌鼠,生理周期明显延长,生育能力下降(产仔数减少),出现卵泡闭锁,黄体退化速度增快, 而转基因后过表达INSL3的雌鼠会发育出类似于睾丸引带的结构,并伴随卵巢异位及腹股沟斜疝[29-30]。人类某些卵巢疾病也伴随INSL3浓度的异常,但二者的因果关系并不明确,如多囊卵巢患者血液中INSL3的浓度明显高于常人,而在卵巢早衰的女性中,INSL3浓度明显降低[9, 31-33]。目前关于INSL3与女性生殖系统疾病关系的研究并不深入,进一步研究有助于相关妇科疾病的诊断及治疗。
五、结语INSL3-RXFP2与两性生殖系统密切相关。INSL3-RXFP2调控了雄性睾丸引带发育及分化,并具有抗雄性生殖细胞凋亡的作用。在雌性中则参与了女性生理周期,并调控卵细胞的成熟。了解INSL3-RXFP2对两性生殖系统的生理作用,有助于两性生殖系统相关疾病的诊断及治疗。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 欧文辉负责文章撰写;肖文峰、谢新泉负责文献检索,陈凯洪、符马贤负责文献翻译及分类,段守兴和李建宏负责对文章知识性内容进行审阅
| [1] |
Bathgate RAD, Halls ML, van der Westhuizen ET, et al. Relaxin family peptides and their receptors[J]. Physiol Rev, 2013, 93(1): 405-480. DOI:10.1152/physrev.00001.2012 |
| [2] |
Anand-Ivell R, Cohen A, Nørgaard-Pedersen B, et al. Amniotic fluid INSL3 measured during the critical time window in human pregnancy relates to cryptorchidism, hypospadias, and phthalate load: a large case-control study[J]. Front Physiol, 2018, 9: 406. DOI:10.3389/fphys.2018.00406 |
| [3] |
Harrison SM, Bush NC, Wang Y, et al. Insulin-like peptide 3(INSL3)serum concentration during human male fetal life[J]. Front Endocrinol(Lausanne), 2019, 10: 596. DOI:10.3389/fendo.2019.00596 |
| [4] |
Albrethsen J, Juul A, Andersson AM. Mass spectrometry supports that the structure of circulating human insulin-like factor 3 is a heterodimer[J]. Front Endocrinol(Lausanne), 2020, 11: 552. DOI:10.3389/fendo.2020.00552 |
| [5] |
Rosengren KJ, Zhang SD, Lin F, et al. Solution structure and characterization of the LGR8 receptor binding surface of insulin-like peptide 3[J]. J Biol Chem, 2006, 281(38): 28287-28295. DOI:10.1074/jbc.M603829200 |
| [6] |
Esteban-Lopez M, Agoulnik AI. Diverse functions of insulin-like 3 peptide[J]. J Endocrinol, 2020, 247(1): R1-R12. DOI:10.1530/JOE-20-0168 |
| [7] |
Kawamura K, Kumagai J, Sudo S, et al. Paracrine regulation of mammalian oocyte maturation and male germ cell survival[J]. Proc Natl Acad Sci U S A, 2004, 101(19): 7323-7328. DOI:10.1073/pnas.0307061101 |
| [8] |
Feng S, Bogatcheva NV, Truong A, et al. Developmental expression and gene regulation of insulin-like 3 receptor RXFP2 in mouse male reproductive organs[J]. Biol Reprod, 2007, 77(4): 671-680. DOI:10.1095/biolreprod.107.060442 |
| [9] |
Zhu CD, Luo W, Li ZQ, et al. New theca-cell marker insulin-like factor 3 is associated with premature ovarian insufficiency[J]. Fertil Steril, 2021, 115(2): 455-462. DOI:10.1016/j.fertnstert.2020.08.005 |
| [10] |
Dai YZI, Ivell R, Anand-Ivell R. Theca cell INSL3 and steroids together orchestrate the growing bovine antral follicle[J]. Front Physiol, 2017, 8: 1033. DOI:10.3389/fphys.2017.01033 |
| [11] |
Scott DJ, Wilkinson TN, Zhang SD, et al. Defining the LGR8 residues involved in binding insulin-like peptide 3[J]. Mol Endocrinol, 2007, 21(7): 1699-1712. DOI:10.1210/me.2007-0097 |
| [12] |
Scott DJ, Layfield S, Yan Y, et al. Characterization of novel splice variants of LGR7 and LGR8 reveals that receptor signaling is mediated by their unique low density lipoprotein class A modules[J]. J Biol Chem, 2006, 281(46): 34942-34954. DOI:10.1074/jbc.M602728200 |
| [13] |
Bruell S, Sethi A, Smith N, et al. Distinct activation modes of the Relaxin Family Peptide Receptor 2 in response to insulin-like peptide 3 and relaxin[J]. Sci Rep, 2017, 7(1): 3294. DOI:10.1038/s41598-017-03638-4 |
| [14] |
Kong RCK, Bathgate RAD, Bruell S, et al. Mapping key regions of the RXFP2 low-density lipoprotein class-A module that are involved in signal activation[J]. Biochemistry, 2014, 53(28): 4537-4548. DOI:10.1021/bi500797d |
| [15] |
Yan Y, Scott DJ, Wilkinson TN, et al. Identification of the N-linked glycosylation sites of the human relaxin receptor and effect of glycosylation on receptor function[J]. Biochemistry, 2008, 47(26): 6953-6968. DOI:10.1021/bi800535b |
| [16] |
Bay K, Main KM, Toppari J, et al. Testicular descent: INSL3, testosterone, genes and the intrauterine milieu[J]. Nat Rev Urol, 2011, 8(4): 187-196. DOI:10.1038/nrurol.2011.23 |
| [17] |
Kaftanovskaya EM, Feng S, Huang ZH, et al. Suppression of insulin-like3 receptor reveals the role of β-catenin and Notch signaling in gubernaculum development[J]. Mol Endocrinol, 2011, 25(1): 170-183. DOI:10.1210/me.2010-0330 |
| [18] |
Feng S, Ferlin A, Truong A, et al. INSL3/RXFP2 signaling in testicular descent[J]. Ann N Y Acad Sci, 2009, 1160: 197-204. DOI:10.1111/j.1749-6632.2009.03841.x |
| [19] |
Johnson KJ, Robbins AK, Wang YP, et al. Insulin-like 3 exposure of the fetal rat gubernaculum modulates expression of genes involved in neural pathways[J]. Biol Reprod, 2010, 83(5): 774-782. DOI:10.1095/biolreprod.110.085175 |
| [20] |
Crespo D, Assis LHC, Zhang YT, et al. Insulin-like 3 affects zebrafish spermatogenic cells directly and via Sertoli cells[J]. Commun Biol, 2021, 4(1): 204. DOI:10.1038/s42003-021-01708-y |
| [21] |
Shokri S, Tavalaee M, Ebrahimi SM, et al. Expression of RXFP2 receptor on human spermatozoa and the anti-apoptotic and antioxidant effects of insulin-like factor 3[J]. Andrologia, 2020, 52(9): e13715. DOI:10.1111/and.13715 |
| [22] |
Ceyhan Y, Zhang MQ, Guo JT, et al. Deletion of inositol polyphosphate 4-phosphatase type-Ⅱ B affects spermatogenesis in mice[J]. PLoS One, 2020, 15(5): e0233163. DOI:10.1371/journal.pone.0233163 |
| [23] |
Huang ZH, Rivas B, Agoulnik AI. Insulin-like 3 signaling is important for testicular descent but dispensable for spermatogenesis and germ cell survival in adult mice[J]. Biol Reprod, 2012, 87(6): 143. DOI:10.1095/biolreprod.112.103382 |
| [24] |
Ferguson L, How JJ, Agoulnik AI. The fate of spermatogonial stem cells in the cryptorchid testes of RXFP2 deficient mice[J]. PLoS One, 2013, 8(10): e77351. DOI:10.1371/journal.pone.0077351 |
| [25] |
Toliczenko-Bernatowicz D, Matuszczak E, Tylicka M, et al. Overexpression of ubiquitin carboxyl-terminal hydrolase 1(UCHL1)in boys with cryptorchidism[J]. PLoS One, 2018, 13(2): e0191806. DOI:10.1371/journal.pone.0191806 |
| [26] |
Aldahhan RA, Stanton PG. Heat stress response of somatic cells in the testis[J]. Mol Cell Endocrinol, 2021, 527: 111216. DOI:10.1016/j.mce.2021.111216 |
| [27] |
Bathgate R, Moniac N, Bartlick B, et al. Expression and regulation of relaxin-like factor gene transcripts in the bovine ovary: differentiation-dependent expression in theca cell cultures[J]. Biol Reprod, 1999, 61(4): 1090-1098. DOI:10.1095/biolreprod61.4.1090 |
| [28] |
Glister C, Satchell L, Bathgate RAD, et al. Functional link between bone morphogenetic proteins and insulin-like peptide 3 signaling in modulating ovarian androgen production[J]. Proc Natl Acad Sci U S A, 2013, 110(15): E1426-E1435. DOI:10.1073/pnas.1222216110 |
| [29] |
Pitia AM, Minagawa I, Abe Y, et al. Evidence for existence of insulin-like factor 3(INSL3)hormone-receptor system in the ovarian corpus luteum and extra-ovarian reproductive organs during pregnancy in goats[J]. Cell Tissue Res, 2021, 385(1): 173-189. DOI:10.1007/s00441-021-03410-1 |
| [30] |
Richards JS, Ren YA, Candelaria N, et al. Ovarian follicular theca cell recruitment, differentiation, and impact on fertility: 2017 update[J]. Endocr Rev, 2018, 39(1): 1-20. DOI:10.1210/er.2017-00164 |
| [31] |
Phylactou M, Clarke SA, Patel B, et al. Clinical and biochemical discriminants between functional hypothalamic amenorrhoea(FHA)and polycystic ovary syndrome(PCOS)[J]. Clin Endocrinol(Oxf), 2021, 95(2): 239-252. DOI:10.1111/cen.14402 |
| [32] |
Ivell R, Anand-Ivell R. Insulin-like peptide 3(INSL3)is a major regulator of female reproductive physiology[J]. Hum Reprod Update, 2018, 24(6): 639-651. DOI:10.1093/humupd/dmy029 |
| [33] |
França MM, Funari MFA, Lerario AM, et al. Screening of targeted panel genes in Brazilian patients with primary ovarian insufficiency[J]. PLoS One, 2020, 15(10): e0240795. DOI:10.1371/journal.pone.0240795 |
 2023, Vol. 22
2023, Vol. 22


