肝外型门静脉梗阻(extrahepatic portal vein obstruction, EHPVO)是儿童门脉高压的主要类型,治疗以手术为主,肠系膜上静脉- 肝内门静脉左支搭桥术(mero rex bypass, Rex)最早由de Ville DGJ[1]报道,由于该术式在生理上恢复了入肝血流,目前已成为治疗该疾病的首选术式[2]。近期广州市妇女儿童医疗中心收治1例急诊实施Rex手术的患儿,现对其临床特点、治疗过程进行介绍,旨在探讨急诊Rex手术的指征,并评价手术预后。
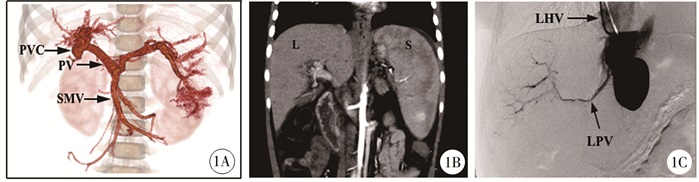
患儿女,7岁,15.5 kg,因Rex术后3个月反复消化道出血于2020年3月入院。入院前3个月在外院因肝外型门脉高压行Rex术,术后2周出血复发,保守治疗后缓解,后3个月内出血4次。于当地医院予止血、补液等对症治疗,但症状反复,遂来我院就诊。查体:全身皮肤巩膜无黄染,上腹正中部可见一纵形手术疤痕,腹部平软,肝肋下未及,脾肋下5 cm。实验室检查:白细胞12.85×109/L,血红蛋白66.50 g/L,血小板96.00×109 /L;肝功能:谷丙转氨酶11 U/L,谷草转氨酶25 U/L,总蛋白51.1 g/L,白蛋白33.3 g/L,总胆红素4.7 umol/L,直接胆红素1.4 umol/L。凝血功能:凝血酶原时间15.60 s,D-二聚体2.21 mg/L。三维CT门脉血管重建显示:肝门区门静脉海绵样变(图 1A),肝内门静脉系统显示不清,脾静脉、肠系膜上静脉通畅。肝胆脾螺旋CT平扫:肝实质内未见异常密度影,肝内胆管及胰管未见明显扩张,肝门区结构紊乱,见多发迂曲血管影;脾脏明显增大,下缘超过肝脏下缘达第3腰锥体水平(图 1B)。楔形肝静脉门静脉造影(wedeged hepatic venous portography,WHVP)未见原桥血管;肝内门静脉左右支及Rex窝显影(图 1C)。住院准备手术期间再次出血,应用生长抑素、止血药等治疗后缓解,1周后再次出血,且呕血及黑便情况逐渐加重,单纯药物无法有效止血,予内镜下硬化剂注射治疗;内镜治疗后出血停止,拟择期手术。手术当天患儿突发心率增快,血压、血红蛋白呈进行性下降,诊断为失血性休克,考虑发生急性曲张静脉破裂大出血,抗休克治疗的同时留置三腔二囊管,置管后6 h冲洗回抽胃管,管中持续引流出新鲜不凝血液,考虑合并异位静脉曲张破裂,决定行急诊探查手术。
|
图 1 肝外型门脉高压出血急诊手术患儿门静脉系统的术前评估资料 Fig.1 Preoperative evaluation of portal vein system in emergency surgery patient 注 1A: 术前门静脉系统血管三维重建图,PVC为门静脉海绵样变,PV为门静脉,SMV为肠系膜上静脉; 1B: 术前肝、脾CT图像; 1C: 楔形WHVP图,造影过程中部分造影剂进入肝实质,LHV为肝左静脉,LPV为门静脉左支 |
术中见肝脏大小及颜色正常,脾大,胃胀,三腔二囊管放气后切开胃前壁,胃内见大量凝血块积聚,清除凝血块后可见胃底一孤立性曲张血管破裂并伴有活动性出血,予血管缝扎止血,再次观察胃内无活动性出血;进一步行Rex手术,探查原搭桥血管闭锁,解剖后可见Rex窝仍存在,门静脉左支通畅,直径约3 mm,肠系膜上静脉直径约1.2 cm,游离Rex静脉和肠系膜上静脉后,取左侧颈内静脉作为搭桥血管,沿Rex静脉及肠系膜上静脉长轴方向各做一平行切口,长度分别约8.0 mm及10.0 mm,将颈内静脉修剪后近端与Rex静脉切口行端侧吻合,远端与肠系膜上静脉切口行端侧吻合,术中吻合口分别为5.0 mm及5.5 mm大小;搭桥前测门静脉压力31 mmHg(1 mmHg=0.133 kPa),搭桥后22 mmHg。
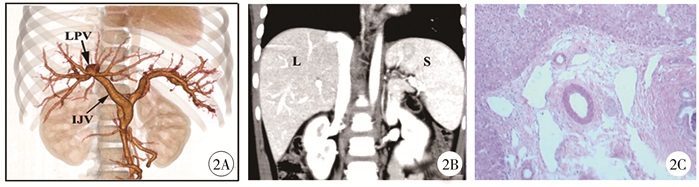
术后予肝素(术后0~3 d)和速碧林(术后4~7 d)抗凝治疗,其后替换为潘生丁和阿司匹林肠溶片维持至术后6个月,予奥美拉唑1个月。术后6个月门脉血管重建提示,原肝门区增粗血管影基本消失,门脉左支矢状部内径9.7 mm,门脉左支吻合口通畅,约6.4 mm,肠系膜上静脉吻合口约4.8 mm,桥静脉未见狭窄(图 2A);术后6个月肝胆胰脾CT提示,肝脏体积增大,肝实质未见异常密度影,肝内胆管及胰管未见扩张;脾脏上下径约8.3 cm,较前缩小(图 2B);术后病理检查提示:肝细胞未见明显病变,符合门静脉压力增高的形态学改变(图 2C)。随访6个月,搭桥血管通畅,白细胞8.05×109/L,血红蛋白122.42 g/L,血小板153.67×109/L;肝功能正常。
|
图 2 急诊手术患儿肝、脾系统的术后评估资料 Fig.2 Postoperative evaluation of liver and spleen system in emergency surgery patient 注 2A: 术后门静脉系统血管三维重建图,LPV为门静脉左支,IJV为颈内静脉; 2B: 术后肝、脾CT图像; 2C: 术后肝活检示肝细胞未见明显病变,符合门静脉压力增高的形态学改变(HE染色,×200) |
讨论 食管胃底静脉曲张出血是门静脉高压症的严重并发症,儿童静脉曲张破裂出血的病死率在10%以下[3-4];而成人肝硬化型的有关数据为30%,这可能与EHPVO患儿的肝功能代偿能力较成人强有关[5]。急性出血是指发生在患儿入院后48 h内的出血,本例患儿入院时无出血表现,首次出血发生于入院后第1天,表现为排黑便1次,查血红蛋白61 g/L,诊断为急性食管胃底静脉曲张破裂出血。对于急性出血的处理,主流观点认为,药物止血是首要措施,根据病情严重程度,循序采用内镜治疗、三腔二囊管压迫,最后是急诊手术[6-7]。我们使用了生长抑素、奥美拉唑及酚磺乙胺、蛇毒血凝酶等止血以及抑酸治疗:生长抑素是一种肽激素,通过诱导内脏血管收缩而减少静脉曲张出血,降低门静脉及侧支血管的血流压力;质子泵抑制剂(proton pump inhibitor, PPI) 通过与H-K-ATP ase的不可逆结合来减少胃酸的含量,保护胃黏膜。治疗初期出血情况得到了控制,连续用药后4 d未出现消化道出血症状,说明早期使用此类药物作为一线止血用药是有效的[8-9]。患儿在病情稳定期间进行了WHVP检查,患儿肝内门静脉左右支显影清晰,但桥血管未显示,说明其肝内门静脉分支发育情况良好,Rex窝通畅,具备施行Rex手术的可能性,同时也提示我们前次Rex手术的搭桥血管发生了栓塞。WHVP可作为了解患儿Rex窝通畅性及肝内门静脉情况的可靠方法,为评估施行Rex术提供有价值的参考,施行WHVP检查需要满足一定的生理条件,如出血停止、生命体征稳定等。该患儿经药物止血后出血停止,经评估可进行该项检查,且该患儿为Rex术后再出血患儿,术前对Rex窝的评估可指导手术方案的制定,减轻手术创伤[10-11]。患儿在WHVP检查后出现了二次出血的情况,经药物及输血治疗无好转,因本院无法行内镜下止血,遂安排至外院行胃镜下硬化剂注射治疗。当药物治疗效果不理想时,内镜下止血是首选[12]。内镜下治疗分为曲张静脉结扎和硬化剂注射,Kim SJ等[13]报道,结扎法与硬化疗法在控制急性出血中都具有相对较高的治疗成功率(约90%),两种疗法的并发症发生率无明显差异,但静脉结扎法中需要使用结扎夹,不适合应用于年龄小的儿童,所以此例患儿进行了硬化剂治疗,治疗后出血症状消失。患儿经内镜止血后择期手术治疗,手术当日出现了第3次出血:术前突发心率增快,血红蛋白值进行性下降,经输血、药物止血、气管插管辅助呼吸等措施后,休克症状仍无法改善,考虑存在活动性大出血,遂采取三腔二囊管压迫。对于食管胃底静脉出血,内镜下止血效果确切,通常能对大部分急性出血进行有效止血,但对于出血迅猛、无法维持有效血容量的患儿,三腔二囊管的压迫效果显著,是首选的应急措施,能为患儿赢得进一步治疗的时间,该患儿此时出血量大且呈休克状态,本院无法行急诊胃镜止血,遂采取该方式进行了紧急止血。置管后6 h,胃管持续引流出不凝鲜血,经积极扩容补液、胃内注入凝血酶冻干粉、肾上腺素止血等处理后,休克症状仍无改善,考虑患儿存在异位静脉破裂出血,遂进行急诊手术治疗。三腔二囊管充气后利用气囊压力分别压迫食管下段和胃底出血的曲张静脉,可达到止血的目的,其治疗原理揭示了其作用的范围,通常情况下止血效果可靠,此例患儿采用双气囊压迫后仍有大量出血,说明出血部位来自于气囊范围以外位置,考虑存在异位血管破裂。异位静脉曲张本质上是门脉高压所致侧支循环开放的一种类型,诊断通常是以胃镜为主,但仅限于内镜可以观察的范围内,且黏膜下的病变无法诊断,此例患儿在首次胃镜止血治疗时,发现了食管及胃底静脉曲张破裂的出血点,但并未发现存在异位血管的情况,我们分析可能与当时异位血管存在于黏膜下或异位静脉裂孔较小,经硬化剂注射后自行停止出血有关。
对于急诊手术时机的判断,相关文献报道保守治疗后短期内(治疗后24~48 h)反复出血或伴发异位曲张静脉破裂时,具有急诊手术指征[14-15]。该患儿经保守治疗反复出血,且同时考虑合并异位血管破裂,此种情况下,只能通过急诊手术止血。术中我们在胃底发现了异位曲张血管活动性出血,证实了术前的判断。关于Rex手术指征方面,Baveno VI儿科卫星专题讨论会上建议,将Rex手术作为治疗EHPVO并发出血的初级和次级预防手术方式,所谓初级预防指的是在患儿未出血时进行治疗,次级预防是已经出血后的进一步预防措施。对于Rex手术来讲,急诊手术是可行的,de ville DGJ等[16]曾报道两例因出现严重静脉曲张出血和休克,硬化治疗失败而行急诊Rex手术成功的案例。本例患儿在急诊情况下得以施行Rex术,具备以下基本条件:第一,术前充分纠正休克后生命体征能够暂时平稳,经评估可耐受手术;第二,具有合适的Rex静脉和肠系膜上静脉;第三,有通畅可用的左颈内静脉[17];第四,术中良好的血管吻合技术,保障血管吻合操作的精准到位。搭桥后门静脉压力从术前的31 mmHg下降至22 mmHg,降压效果显著。术后6个月随访,血小板、血红蛋白值均较术前明显升高,术后肝门区曲张血管团基本消失,术后桥血管吻合口通畅,血管流速正常,门静脉左支管径增宽,相较于术前,肝脏体积增大,脾脏体积缩小,术后效果理想。
术后的抗凝管理是预防血栓形成的重要措施之一。之前我们进行过相关的报道,具体方案如下:目前国内外尚无关于Rex术后抗凝管理的标准方案,从文献报道来看,不同中心的抗凝方案各不相同,我们借鉴了心脏外科和肝移植外科的抗凝治疗经验,结合患儿具体情况,制定了普通肝素-低分子肝素-潘生丁+阿司匹林的抗凝方案:术后使用肝素(术后0~3 d),使活化凝血酶时间(activated clotting time,ACT)维持在170~190 s之间,之后改为低分子肝素钠(50~100 u/kg)于术后4~7 d皮下注射,其后替换为口服潘生丁(3~5 mg/kg,分3次口服)+阿司匹林(3~5 mg/kg,每日一次,不超过75 mg/d),维持至术后6个月[18]。Rex术后在应用抗凝药物的情况下,血管仍存在再次自发出血的可能,为预防此种情况发生,术后我们留置了三腔二囊管,再次出血时可及时压迫止血。术后规范的随访可以及时发现问题及时处理,也是提高治疗效果的关键因素。
综上,儿童肝外型门静脉高压合并不可控出血时,可以进行急诊手术治疗。把握好手术时机、术中选择正确的术式、术后规范的抗凝及随访管理,可使Rex手术患儿获得良好的治疗效果。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为杨阳,论文调查设计为杨阳、温哲,数据收集与分析为杨阳,论文结果撰写为杨阳,论文讨论分析为杨阳、温哲
| [1] |
de Ville DGJ, Clapuyt P, Otte JB. Extrahilar mesenterico-left portal shunt to relieve extrahepatic portal hypertension after partial liver transplant[J]. Transplantation, 1992, 53(1): 231-232. |
| [2] |
Shneider BL, de Ville DGJ, Leung DH, et al. Primary prophylaxis of variceal bleeding in children and the role of MesoRex Bypass: Summary of the Baveno VI Pediatric Satellite Symposium[J]. Hepatology, 2016, 63(4): 1368-1380. DOI:10.1002/hep.28153 |
| [3] |
Maksoud JG, Goncalves ME, Porta G, et al. The endoscopic and surgical management of portal hypertension in children: analysis of 123 cases[J]. J Pediatr Surg, 1991, 26(2): 178-181. DOI:10.1016/0022-3468(91)90904-8 |
| [4] |
Howard ER, Stringer MD, Mowat AP. Assessment of injection sclerotherapy in the management of 152 children with oesophageal varices[J]. Br J Surg, 1988, 75(5): 404-408. DOI:10.1002/bjs.1800750504 |
| [5] |
Sharara AI, Rockey DC. Gastroesophageal variceal hemorrhage[J]. N Engl J Med, 2001, 345(9): 669-681. DOI:10.1056/NEJMra003007 |
| [6] |
Yachha SK, Sharma BC, Kumar M, et al. Endoscopic sclerotherapy for esophageal varices in children with extrahepatic portal venous obstruction: a follow-up study[J]. J Pediatr Gastroenterol Nutr, 1997, 24(1): 49-52. DOI:10.1097/00005176-199701000-00012 |
| [7] |
Duche M, Ducot B, Ackermann O, et al. Portal hypertension in children: High-risk varices, primary prophylaxis and consequences of bleeding[J]. J Hepatol, 2017, 66(2): 320-327. DOI:10.1016/j.jhep.2016.09.006 |
| [8] |
Noronha FC, Seijo S, Plessier A, et al. Natural history and management of esophagogastric varices in chronic noncirrhotic, nontumoral portal vein thrombosis[J]. Hepatology, 2016, 63(5): 1640-1650. DOI:10.1002/hep.28466 |
| [9] |
Henkel S, Vetterly C, Squires R, et al. Pharmacological management of portal hypertension and its complications in children: lessons from adults and opportunities for the future[J]. Expert Opin Pharmaco, 2021, 22(3): 291-304. DOI:10.1080/14656566.2020.1825685 |
| [10] |
Bertocchini A, Falappa P, Grimaldi C, et al. Intrahepatic portal venous systems in children with noncirrhotic prehepatic portal hypertension: anatomy and clinical relevance[J]. J Pediatr Surg, 2014, 49(8): 1268-1275. DOI:10.1016/j.jpedsurg.2013.10.029 |
| [11] |
Shinohara T, Ando H, Watanabe Y, et al. Extrahepatic portal vein morphology in children with extrahepatic portal hypertension assessed by 3-dimensional computed tomographic portography: a new etiology of extrahepatic portal hypertension[J]. J Pediatr Surg, 2006, 41(4): 812-816. DOI:10.1016/j.jpedsurg.2005.12.027 |
| [12] |
Duche M, Ducot B, Tournay E, et al. Prognostic value of endoscopy in children with biliary atresia at risk for early development of varices and bleeding[J]. Gastroenterology, 2010, 139(6): 1952-1960. DOI:10.1053/j.gastro.2010.07.004 |
| [13] |
Kim SJ, Oh SH, Jo JM, et al. Experiences with endoscopic interventions for variceal bleeding in children with portal hypertension: a single center study[J]. Pediatr Gastroenterol Hepatol Nutr, 2013, 16(4): 248-253. DOI:10.5223/pghn.2013.16.4.248 |
| [14] |
Sarin SK, Lahoti D, Saxena SP, et al. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients[J]. Hepatology, 1992, 16(6): 1343-1349. DOI:10.1002/hep.1840160607 |
| [15] |
Noronha FC, Seijo S, Plessier A, et al. Natural history and management of esophagogastric varices in chronic noncirrhotic, nontumoral portal vein thrombosis[J]. Hepatology, 2016, 63(5): 1640-1650. DOI:10.1002/hep.28466 |
| [16] |
de Ville DGJ, Alberti D, Clapuyt P, et al. Direct bypassing of extrahepatic portal venous obstruction in children: a new technique for combined hepatic portal revascularization and treatment of extrahepatic portal hypertension[J]. J Pediatr Surg, 1998, 33(4): 597-601. DOI:10.1016/s0022-3468(98)90324-4 |
| [17] |
温哲, 张宾宾. 儿童肝前性门静脉高压的术前评估及手术治疗[J]. 临床小儿外科杂志, 2019, 18(12): 994-998. Wen Z, Zhang BB. Preoperative assessments and operations for prehepatic portal hypertension in children[J]. J Clin Ped Sur, 2019, 18(12): 994-998. DOI:10.3969/j.issn.1671-6353.2019.12.002 |
| [18] |
温哲, 王哲, 刘涛, 等. 颈内静脉搭桥Rex手术治疗小儿肝外门静脉梗阻的初步探讨[J]. 中华小儿外科杂志, 2016, 37(2): 124-130. Wen Z, Wang Z, Liu T, et al. Preliminary experiences of Rex shunt for extrahepatic portal vein obstruction via a conduit of internal jugular vein[J]. J Clin Pediatr Surg, 2016, 37(2): 124-130. DOI:10.3760/cma.i.issn.0253-3006.2016.02.010 |
 2022, Vol. 21
2022, Vol. 21


