胸壁肿瘤是一类相对少见的疾病,根据组织来源分为胸壁骨组织肿瘤和软组织肿瘤,后者起源于皮肤、皮下、肋间和胸壁内侧的肌肉、筋膜。依据病理类型不同,胸壁肿瘤主要分为胸壁良性肿瘤、交界性肿瘤、原发性恶性肿瘤以及恶性转移性肿瘤等[1]。有关儿童胸壁肿瘤的文献报道不多,本文回顾性分析重庆医科大学附属儿童医院收治的儿童胸壁肿瘤患儿临床资料,为临床上儿童胸壁肿瘤的诊疗提供参考。
材料与方法 一、临床资料以2011年1月至2021年12月于重庆医科大学附属儿童医院就诊并接受手术的127例胸壁肿瘤患儿为研究对象。病例纳入标准:年龄18岁以下,病理检查明确诊断为肿瘤者。排除标准:临床资料不完整者。患儿均于门诊就诊后入院,手术前完善心电图、胸片、血、尿、大便等检查,必要时行胸部CT平扫+增强、胸部CT平扫+胸廓三维重建、胸部超声、胸部磁共振、Pet-CT显像或全身骨扫描。必要时于手术治疗后予放疗、化疗,定期门诊随访。记录患儿病史、手术相关资料(手术时间、出血量、手术方式)、病理诊断、并发症、诊治方案、随访资料等。本研究经重庆医科大学附属儿童医院伦理委员会审核同意。
二、手术方案患儿静吸复合全身麻醉后,根据病变位置和范围,取健侧卧位或者侧俯卧位、侧仰卧位,必要时悬吊或者外展上肢。常规消毒铺无菌手术巾后,取皮肤直切口或梭形切口。对病灶边界清楚,考虑为良性肿瘤者,均沿病变边界完整切除。对肿瘤性质不明,术中需要根据肿瘤性质来确定肿瘤切除范围者,行术中冰冻切片检查。如果边界不清,则结合术前影像学(如磁共振、超声检查)所示病灶范围及术中肉眼判断病灶边界,必要时适当扩大切除至病灶外1~2 cm,切除病灶上下肋骨以及病变侵犯的肺组织。术中如果切除3根以上较长段肋骨,术后可能出现胸壁软化和反常呼吸,需使用人工材料重建胸廓。切除肋骨段不超过3根,使用0号可吸收线或者钢丝将上、下肋骨适当靠近缝合后将临近软组织、皮肤直接拉拢缝合,必要时转移肌皮瓣行胸壁重建。术中壁层胸膜损伤者,术中常规安置胸腔闭式引流管,连接胸腔闭式引流瓶。手术未涉及胸膜者,术中根据情况,必要时安置高负压引流管,连接高负压引流瓶,或放置橡皮引流片引流。
结果 一、一般资料127例中,男83例,女44例;年龄(45.62±19.13)个月(2天至16岁5个月);体重(16.71±8.58)kg (3.5~8.3 kg)。
二、临床表现以胸壁包块为主要临床表现122例(96.1%),以胸痛为主诉3例(2.4%),因其他原因行胸部影像检查偶然发现者2例(1.5%)。胸壁原发肿瘤126例(99.2%),恶性转移性肿瘤1例(0.8%)。术前均经过胸片、胸部CT平扫+增强、胸部CT平扫+胸廓三维重建、胸部超声、胸部磁共振检查中至少1项影像学检查,获得诊断(图 1)。
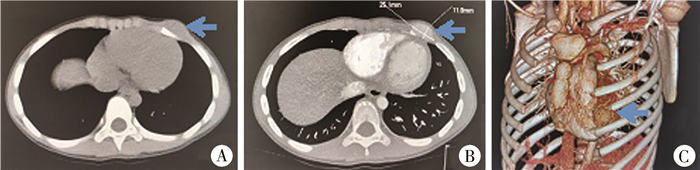
|
图 1 1例7岁女性患儿胸壁肿瘤CT检查结果A:CT平扫;B:CT增强扫描;C:胸壁三维重建 Fig.1 CT examination of chest wall tumor |
本组行肿瘤部分切除/活检术5例、肿瘤扩大切除术1例,其余121例均行肿瘤切除术,其中术中冰冻切片1例(脂肪母细胞瘤)。本组7例术中行肋骨切除,其中切除两个肋骨段1例(错构瘤),切除一个肋骨段5例(尤文氏肉瘤3例、骨软骨瘤2例)。手术时间12~167 min,术中出血1~500 mL。术中放置胸腔引流管5例,高负压引流管7例,橡皮片引流5例。术后无一例大出血,引流量5~86 mL。病理检查结果显示良性肿瘤115例(90.6%),交界性肿瘤3例(2.4%),恶性肿瘤9例(7.0%)。无一例手术死亡, 住院期间切口渗液2例,肺炎2例。1例恶性肿瘤患儿术后自行出院,6例恶性肿瘤患儿术后接受化疗和(或)放疗、靶向药物治疗。5例良性肿瘤和1例骨肉瘤患儿失访,121例患儿获得随访,随访时间1个月至10年,平均4.9年。3例恶性肿瘤患儿随访期间肿瘤远处转移死亡,余118例均存活,其中局部复发再手术6例(5.4%)。详见表 1。
| 表 1 127例胸壁肿瘤患儿手术、病理及预后资料 Table 1 Data of surgery, pathology and prognosis |
|
|
胸壁的解剖结构包含浅层结构(皮肤、浅筋膜)和深层结构,后者包括深筋膜、胸廓外肌层、骨性胸廓、肋间软组织(肋间肌肉、神经、血管、淋巴管、淋巴结)以及胸内筋膜、壁层胸膜等。虽然胸壁肿瘤的总体发病率低,但所有胸壁组织均可能发生肿瘤性病变。资料显示成人胸壁肿瘤占全身软组织与骨肿瘤的5% ~10%,而儿童胸壁肿瘤只占全身实体肿瘤的1.8%左右[2]。
从组织胚胎发育的角度看,胸壁是由外胚层和中胚层发育分化形成的。由于儿童发育不成熟,因此婴幼儿胸壁肿瘤谱和成人的胸壁肿瘤谱存在一定差异。国内资料报道胸壁肿瘤以良性居多,且原发性胸壁肿瘤多见,而国外有文献报道胸壁肿瘤多为恶性(占比达50% ~80%),且继发性胸壁肿瘤的发生率多于原发性胸壁肿瘤[1]。本组127例儿童胸壁肿瘤,良性肿瘤(115例,90.6%)占绝大多数,恶性肿瘤次之(9例,7%),交界性肿瘤3例(2.4%),更接近于国内文献资料的报道。
二、胸壁肿瘤的临床特点儿童胸壁肿瘤的诊断需结合病史、体格检查、影像学资料、实验室检查以及肿瘤组织活检或病理检查等。胸壁无痛性包块是儿童胸壁最常见的症状,本组122例(96.1%)主诉为胸壁包块。如果胸壁肿瘤侵犯或者压迫神经组织,如肋间神经,则临床上可出现胸痛,本组3例(2.4%)以胸痛为首发症状。部分胸壁肿瘤位置隐蔽,或者肿瘤向胸壁内侧生长,未侵犯压迫神经以及其他重要脏器者,临床症状不明显,常因其他原因行胸部影像学检查偶然发现。体格检查需仔细触摸感知肿块的质地、边界、活动度、有无触痛、波动感等,对肿瘤的良恶性有一定提示价值。对于既往患胸壁外恶性肿瘤者,则需要警惕转移瘤可能。本组1例肾母细胞瘤患儿,虽经原发灶切除手术及术后化疗,但5年后转移至胸壁。临床诊断胸壁肿瘤后须进行针对性的辅助检查,包括胸片、超声、磁共振、增强CT等,胸廓三维重建对骨性肿瘤的诊断有重要价值。影像学检查可进一步提示肿瘤的良恶性、病变范围及其与周围脏器组织的毗邻关系。实验室检查亦有一定帮助,如尿本周氏蛋白阳性提示骨髓瘤可能,血清碱性磷酸酶升高则提示骨恶性肿瘤可能,但阴性结果不能排除相关诊断。
三、胸壁肿瘤的手术选择关于针吸活检在胸壁肿瘤诊治中的价值尚有争议,部分学者认为针吸活检的正确诊断率尚不足50%,误导诊疗的风险较高,也有产生肿瘤细胞血行播散和种植的风险,不支持胸壁肿瘤的针吸活检[1]。我们也基本认同以上意见,故本组病例均未进行针吸活检。但也有研究者认为,针吸活检简便、经济、创伤小、并发症发生率低,有助于鉴别胸壁肿瘤的良恶性,提出在转移性肿瘤和原发性骨肿瘤中有诊断价值。对于可以完整切除的、较小的胸壁肿瘤,最佳方案是完整切除后行病理检查,可获得全面而准确的诊断。对于不能完全切除的胸壁肿瘤,可行部分切除活检,术中切取活检的组织既应包含肿瘤组织,也应包含部分肿瘤组织旁的非肿瘤组织。对于术前未能确定肿瘤性质,术中又需要根据肿瘤性质来确定肿瘤切除范围,或者术中难以判断切除范围是否足够的病例,可行术中冰冻检查。但骨性成分多的病变不适合行术中冰冻切片检查。本组仅1例行术中冰冻切片检查,结果为脂肪母细胞瘤。本组115例良性肿瘤中,最多见的是皮样囊肿(44例,38.3%),其余良性肿瘤依次为脂肪纤维瘤(10例)、脂肪血管瘤(10例)、脂肪瘤(9例)、脉管瘤(7例)、婴儿纤维性错构瘤(6例)等,和文献报道成人胸壁良性肿瘤谱存在较明显的差异。本组恶性肿瘤9例,其中3例(33.3%)为尤文氏肉瘤,明显较成人组报告的比例不同[2-3]。
儿童胸壁肿瘤的治疗以手术切除为主,治疗目的是完全清除局部肿瘤,充分恢复胸壁对胸部脏器的保护功能,并维持胸部的美容效果,儿童患者尚需兼顾胸壁的生长潜能。手术方案应基于肿瘤组织学、毗邻关系、局部浸润程度和肿瘤转移等多方面的评估[2-4]。良性软组织肿瘤边界通常较清楚,切除范围以边界或包膜为界是足够的。对于侵袭性生长的交界性肿瘤或者低度恶性肿瘤,如侵袭性纤维瘤、隆突性皮肤纤维肉瘤、卡波西样血管内皮瘤等,宜施行局部扩大切除术,即切缘距肿瘤边缘约1~2 cm。术前不能明确是否为交界性或低度恶性肿瘤者,不宜选择肿瘤扩大切除。对无病理学诊断的原发性肿瘤,首次手术适合限制性根治切除,切除范围应包括病变肋骨上下肋间肌、浅面的胸壁肌肉,以及深面的壁层胸膜,两端超出病变范围1~3 cm。如果病理结果提示为恶性肿瘤,应积极进行化疗,如果切缘为阳性,宜行新辅助化疗后,再进行扩大根治术,必要时进行胸壁重建,术后继续化疗,必要时结合放疗。如果胸壁肿瘤侵及肺或纵隔组织,应术中同期手术切除。胸壁转移性肿瘤均为恶性,在原发病灶和其他部位转移瘤控制良好的情况下可行根治性切除,否则仅能行姑息性切除,以缓解症状、提高生活质量为目的。大面积胸壁缺损可导致胸壁塌陷和反常呼吸,需进行胸壁重建。成人胸壁重建的适应证为前、侧胸壁缺损大于5 cm×5 cm,或连续缺损4根及以上肋骨,肩胛骨前方胸壁缺损大于10 cm×10 cm,肩胛下角处骨性缺损,胸骨整块缺损。重建包括骨骼重建、软组织重建和胸膜重建[5-10]。儿童胸壁重建的适应证尚不明确,但影响呼吸功能的胸壁软化是胸壁重建的绝对适应证[11]。本组有1例患儿使用转移肌皮瓣进行软组织重建,无使用人工材料进行胸壁重建病例,可能和儿童患儿更受家长关注,胸壁肿瘤发现较早,导致切除范围相对局限有关。
四、胸壁肿瘤的预后良性胸壁肿瘤预后良好,手术后可能面临的主要问题是局部复发,但准确的复发概率暂无报道[11-13]。本组6例术后局部复发,复发率5.5%,复发病例为血管瘤1例、脂肪纤维瘤1例、纤维瘤1例、错构瘤1例、脂母细胞瘤2例。本组复发病例均为良性肿瘤,无交界性、恶性肿瘤病例,分析原因,可能与手术医生术中判断病变范围不够准确,导致局部病变残留有关,而非真正的新发肿瘤[14-16]。
总之,儿童胸壁肿瘤临床相对少见,缺乏大宗病例(尤其是多中心)的研究报道,也缺乏相关诊疗的专家共识和诊疗规范。本研究显示,儿童胸壁肿瘤绝大多数为良性,手术治疗效果良好。儿童恶性胸壁肿瘤罕见,但预后不良。恶性肿瘤应根据不同的分期分型采用不同的化疗方案。未来有必要研究儿童恶性胸壁肿瘤评估、诊治的新方法,以期提高儿童恶性胸壁肿瘤的远期治疗效果。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 文献检索为邓舒萍、李勇刚、金鑫, 论文调查设计为邓舒萍、李勇刚、潘征夏、吴春, 数据收集与分析为邓舒萍、袁翠霞、曾玉佩, 论文结果撰写为邓舒萍,论文讨论分析为邓舒萍、李勇刚
| [1] |
徐启明, 周乃康, 刘颖, 等. 105例胸壁肿瘤的诊断和外科治疗[J]. 中国肿瘤临床, 2007, 34(13): 750-753. Xu QM, Zhou NK, Liu Y, et al. Diagnosis and surgical treatment of 105 cases with chest wall tumors[J]. Chinese Journal of Clinical Oncology, 2007, 34(13): 750-753. DOI:10.3969/j.issn.1000-8179.2007.13.009 |
| [2] |
金煜翔, 赵学维, 王良哲, 等. 常见胸壁肿瘤临床诊治分析[J]. 人民军医, 2019, 62(3): 244-246. Jin YX, Zhao XW, Wang LZ, et al. Analysis on the clinical diagnosis and treatment of common chest wall tumor[J]. People's Military Surgeon, 2019, 62(3): 244-246. |
| [3] |
Van den Berg H, Van Rijn RR, Merks JH. Management of tumors of the chest wall in childhood: a reviews[J]. J Pediatr Hematol Oncol, 2008, 30(3): 214-221. DOI:10.1097/MPH.0b013e318162bd54 |
| [4] |
Tsukushi S, Nishida Y, Sugiura H, et al. Soft tissue sarcomas of the chest wall[J]. J Thorac Oncol, 2009, 4(7): 834-837. DOI:10.1097/JTO.0b013e3181a97da3 |
| [5] |
中国医师协会胸外科医师分会. 胸壁肿瘤切除及胸壁重建手术中国专家共识(2018版)[J]. 中国胸心血管外科临床杂志, 2019, 26(1): 1-7. Thoracic surgeon branch of Chinese Medical Association. Chinese expert consensus on chest wall tumor resection and reconstruction of chest wall[J]. Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2019, 26(1): 1-7. DOI:10.7507/1007-4848.201809058 |
| [6] |
Foroulis CN, Kleontas AD, Tagarakis G, et al. Massive chest wall resection and reconstruction for malignant disease[J]. Oncotargets Ther, 2016, 9(1): 2349-2358. DOI:10.2147/OTT.S101615 |
| [7] |
Anderson CJ, Spruill MD, Wylie EF, et al. A technique for pediatric chest wall reconstruction using custom-designed titanium implants: description of technique and report of two cases[J]. J Child Orthop, 2016, 10(1): 1-7. DOI:10.1007/s11832-015-0709-1 |
| [8] |
Berthet JP, Wihlm JM, Canaud L, et al. The combination of polytetrafluoroethylene mesh and titanium rib implants: an innovative process for reconstructing large full thickness chest wall defectss[J]. Eur J Cardiothorac Surg, 2012, 42(3): 444-453. DOI:10.1093/ejcts/ezs028 |
| [9] |
Kamel M, Port J, Altorki NK. Sternal resections: new materials for reconstructions[J]. Curr Surg Rep, 2015, 3(6): 16. DOI:10.1007/s40137-015-0094-1 |
| [10] |
Wald O, Islam I, Amit K, et al. 11-year experience with Chest Wall resection and reconstruction for primary Chest Wall sarcomas[J]. J Cardiothorac Surg, 2020, 28, 15(1): 29. DOI:10.1186/s13019-020-1064-y |
| [11] |
Dingemann C, Linderkamp C, Weidemann J, et al. Thoracic wall reconstruction for primary malignancies in children: short- and long-term results[J]. Eur J Pediatr Surg, 2012, 22(1): 34-39. DOI:10.1055/s-0031-1285873 |
| [12] |
Weyant MJ, Bains MS, Venkatraman E, et al. Results of chest wall resection and reconstruction with and without rigid prosthesis[J]. Ann Thorac Surg, 2006, 81(1): 279-285. DOI:10.1016/j.athoracsur.2005.07.001 |
| [13] |
Abdel R, Ahman A, Rahouma M, et al. Contributing factors to the outcome of primary malignant chest wall tumors[J]. J Thorac Dis, 2017, 12(9): 5184-5193. DOI:10.21037/jtd.2017.11.61 |
| [14] |
Marulli G, Duranti L, Cardillo G, et al. Primary chest wall chondrosarcomas: results of surgical resection and analysis of prognostic factors[J]. Eur J Cardiothorac Surg, 2014, 45(6): e194-e201. DOI:10.1093/ejcts/ezu095 |
| [15] |
Krasin MJ, Davidoff AM, Rodriguez-Galindo C, et al. Definitive surgery and multiagent systemic therapy for patients with localized Ewing sarcoma family of tumors: local outcome and prognostic factors[J]. Cancer, 2005, 104(2): 367-373. DOI:10.1002/cncr.21160 |
| [16] |
Zapala MA, Ho-Fung VM, Lee EY. Thoracic neoplasms in children: contemporary perspectives and imaging assessment[J]. Radiol Clin North Am, 2017, 55(4): 657-676. DOI:10.1016/j.rcl.2017.02.008 |
 2022, Vol. 21
2022, Vol. 21


