先天性食管闭锁(congenital esophageal atresia,CEA)伴或不伴食管气管瘘是一种常见的先天性食管畸形,发病率为1 ∶ 4 000~1 ∶ 2 500。随着近年医疗技术的发展,CEA的存活率明显升高,达90%以上,但气道问题仍然是影响CEA患者中远期生存质量的主要因素,其中气管软化(tracheomalacia,TM)是CEA患者常见的呼吸系统合并症,也是CEA患者晚期死亡的主要原因[1-7]。
TM是指由于气管软骨和(或)后膜结构异常而引起的气管塌陷加重,包括膜部纵向弹性纤维减少和(或)萎缩,或软骨完整性受损而使气道变得更软、更容易随着压力的变化而塌陷[8]。有研究报道62% ~90%的CEA患者合并TM,其中严重TM的患病率为11% ~33%;与单纯CEA相比,TM在CEA合并食管气管瘘(tracheoesophageal fistula,TEF)患者中的发病率更高[9, 10]。早期识别TM并进行针对性的治疗可能有助于预防因TM导致的严重并发症(如窒息)。
支气管镜检查是诊断TM的金标准,其中软式支气管镜检查的优势在于可避免全身麻醉,减少对气管软化评估的干扰,是直接显示气道和动态评估气道的首选方式[11]。目前大多数学者认为,超过50%的腔内狭窄伴呼气困难是诊断TM的标准。大多数TM患者存在75%以上的气管管腔塌陷,其中完全气管塌陷患者占比达33%[8]。本研究通过回顾性分析CEA合并TM患者的临床资料及术前、术后电子支气管内窥镜检查结果,探讨Ⅲ型CEA合并TM的早期诊断及临床结局,为CEA合并TM提供临床诊疗经验。
材料与方法 一、临床资料以2019年11月至2020年9月广州市妇女儿童医疗中心新生儿外科重症监护病房收治且术前进行电子支气管内窥镜检查的15例Ⅲ型CEA患者为研究对象。排除标准:体重<2 kg;合并严重感染(如败血症等);合并严重先天性心脏畸形;合并先天性肺发育不良。该研究经广州市妇女儿童医疗中心伦理委员会批准(编号:穗妇儿科伦批字[2019]第38401号),所有检测均获得患者家属的知情同意,并签署知情同意书。
二、仪器与方法采用OlympusXP 260F电子支气管镜,术前完善血常规、凝血四项、胸片等常规检查;予1%利多卡因雾化,静脉注射咪唑达仑0.2 mg/kg镇静。患者取仰卧位,常规监测生命体征,使用外径2.8 mm Olympus-XP 260F电子支气管镜自鼻孔入镜,自声门起逐步评估TM情况,并寻找气道异常开口。
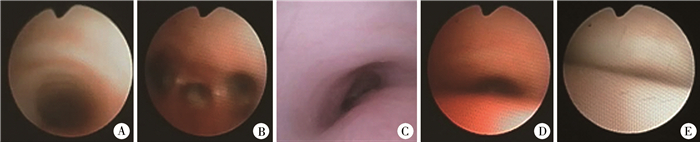
三、TM的评估和资料收集气道评估方法:采用基于动态气道评估的标准化TM评分系统确定术前和术后TM评分,根据上(T1)、中(T2)、下(T3)3个区域的气道开放程度进行评估(图 1)[12]。呼气时气管塌陷程度分为轻度(塌陷50% ~75%)、中度(塌陷75% ~90%)和重度(塌陷>90%),见图 2[8]。气道评估由新生儿外科重症监护病房医师和外科医师各1名共同完成,同时收集患者一般资料、电子支气镜检查结果、临床症状及出现时间。

|
图 1 在对气管解剖区域进行划分的基础上评估气管软化情况 Fig.1 The trachea was assessed according to its anatomic regions |
|
图 2 不同程度气管软化图 注 A:正常气道轮廓;B:气管隆突以及食管气管瘘开口;C:轻度气管软化;D: 中度气管软化;E:重度气管软化 Fig.2 Classification of TM |
采用SPSS 22.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,非正态分布计量资料以中位数(最小值~最大值)[M(min,max)]表示,计数资料以构成比(%)表示。
结果 一、15例Ⅲ型CEA患者一般情况15例中男12例,女3例;Ⅲa型CEA 4例,Ⅲb 11例;出生时胎龄(38.0±1.8)周,出生体重(2.80±0.46)kg,早产儿3例,低出生体重儿3例。5例合并其他畸形中,1例为法洛四联症和肛门闭锁,1例为马蹄肾,1例为上肢畸形,1例为多指,1例为门静脉左支缺如。呼吸机辅助通气时间中位数为24 h(15 h至24 d),住院时间中位数12 d(9~44 d)。患者出院时均无明显症状,无纤维支气管镜检查指征,因此出院时均未行纤维支气管镜复查(见表 1)。
| 表 1 15例先天性食管闭锁患者一般资料 Table 1 Characteristics of patients with CEA |
|
|
15例Ⅲ型CEA患者中,14例(93.33%)存在TM,其中2例为轻度TM,10例为中度TM,2例为重度TM;8例术后1个月因痰鸣、呛咳、发绀、气促、拒奶、窒息住院治疗,并再次进行评估,TM均较术前加重,其中6例为重度,2例为中度。2例术前诊断为重度TM患者术后经纤维支气管镜检查仍为重度。术后随访2个月至1年,7例(46.7%)存在食管狭窄,5例(33.3%)影像学检查提示胃食管反流。随访期间无一例食管气管瘘、吻合口漏以及食管裂孔疝发生。4例(26.67%)术后随访期间无症状;11例(73.33%)出现痰鸣、呛咳、发绀、气促、拒奶、窒息,其中2例(18.2%)出现进食后窒息,均获抢救成功,该2例患者无肺部感染,均存在食管狭窄,考虑为喂食时食管扩张和挤压气管活动导致窒息,后期调整为经胃造口持续泵入食物,以避免窒息再次发生。见表 2。
| 表 2 气管软化评估及临床结局 Table 2 Evaluation and clinical outcome of TM |
|
|
TM是CEA相关气道异常中最常见的一种,发病率为62% ~90%[5-7]。有文献报道在158例不同类型CEA患者中,TM发病率分别为:Ⅰ型约67%;Ⅱ型约67%;Ⅲ型约94.9%;Ⅳ型约75%[13]。本研究发现在Ⅲ型CEA中,TM发病率高达93.3%,以轻中度TM为主,与国外文献报道结果一致。TM通常是指由于气管软骨发育异常和(或)膜部肌肉过长,导致气管缺乏正常的硬度而引起气管软骨环易弯曲和(或)后膜变软导致的气管塌陷。支气管镜检查是诊断TM的金标准,对于CEA合并TM的患者,术前进行支气管镜检查不仅可以评估是否合并TM,还可以排除喉气管畸形,找到气管食管瘘并排除其他瘘口,以及将气管导管正确置入瘘口和隆突之间。目前关于CEA合并TM的发生机制有以下几种假说:①Emery等[14]早期研究发现,约80%的CEA患者气管膜质部分含有食管肌肉和鳞状上皮,仅2%的正常婴儿出现这种现象,因此提出TM的发生可能是原始前肠的错误分化所引起。②Davies等[15]提出食管近端囊扩张使气管在子宫内受压并改变其正常发育的观点。③Wailoo等[16]提出CEA患者可能通过TEF在子宫内失去正常的气管内压力,导致气管更加弛缓;研究发现Ⅲ型CEA患者TM的发病率更高,进一步证实了该假说。本研究纳入病例均为Ⅲ型食管闭锁,其中93.3%的患者出现TM,2例为重度TM。15例患者中8例术后1月再次进行评估,TM均较术前明显加重,究其原因,第一,与原发气管膜部松弛导致TM相关;第二,CEA修补术后可能形成异常的食管气管分隔,以及术中修补的气管瘘处形成异常的气管软骨环、术后有创通气下高气道压力均可加重TM;研究发现有超过91%的TM发生在CEA手术后[17];第三,部分CEA患者合并胃食管反流以及食管狭窄,食管的大小会随着吞咽、胃食管反流以及食管狭窄或阻塞性病变的出现而增大,进而压迫气管。
TM临床症状无特异性,大多数TM患者表现出金属样或犬吠般咳嗽及呼气鸣音,也可出现反复呼吸窘迫、喘息、发绀和自发性颈部过伸等[18]。研究发现,大多数TM患者直到2~3月龄时才出现症状,而咳嗽、哭闹以及喂食期间可能因食道扩张和挤压气管的活动而加重症状[13]。其次,气管过度塌陷导致无效通气和气道分泌物排出受阻后引起反复肺部感染,可影响患者生长发育。有研究对CEA患者随访至8岁,发现27%的患者因此而发展成支气管扩张。另外部分合并严重TM的患者表现为CEA修复术后不能顺利拔除气管插管。研究发现60.7%的CEA患者出现持续呼吸系统症状,11% ~33%的患者出现严重TM症状,如急性危及生命的事件或短暂解决的不明事件、呼吸暂停和哮喘样症状,约4%的患者因抢救不及时而死亡[7, 19]。许多轻中度气道塌陷的患者症状可于1岁或2岁时得到改善[13]。部分重度患者可发生急性危及生命事件,可能与气道异常、胃食管反流、食管狭窄和心血管异常有关。本组病例中有2例出现吃奶后突发窒息,经积极抢救恢复,该2例患者均存在食管狭窄、胃食管反流以及TM,后期调整为经胃造口持续泵奶后未再发生窒息。
对于CEA需仔细区分TM、复发性食管气管瘘和严重胃食管反流。当这三种异常发生在同一例患者身上时,建议先修复复发性食管气管瘘,再纠正TM,抗反流药物治疗可贯彻在整个治疗过程,严重情况下再考虑抗反流手术。本组无一例发生食管气管瘘复发,术后消化道造影未发现重度胃食管反流,结合纤维支气管镜检查结果,考虑TM引起窒息的可能性大。有研究发现在3~28月龄TM患者中,70%的病例存在胃食管反流,胃食管反流可能是引起继发性TM的病因之一,而26%的TM患者表现为胃食管反流症状[8]。本组有5例患者影像学结果提示存在胃食管反流,1例因症状轻微而未行纤维支气管镜评估,4例经评估发现2例TM加重,2例无变化;而另外4例影像学检查未提示胃食管反流并行纤维支气管镜复查的患者中,3例TM无加重,1例加重。鉴于本研究病例数较少,随访时间较短,胃食管反流与TM之间的关系还有待进一步研究。
有研究提出,2% ~36.5%的CEA合并TM患者需要手术矫正TM,常见手术方法为主动脉固定术、气管后壁固定术、气道支架置入术等。行主动脉固定术的平均年龄为7个月,其适应证为:①生长困难,1年有超过3次需住院治疗的严重呼吸道感染;②支气管镜检查显示咳嗽时气管完全塌陷、运动不耐受或发生支气管扩张;③支气管镜检查提示阻塞性TM,需进行硬镜和软镜检查评估气管形态以及TM程度[17]。部分病例需要进行多次主动脉固定术以治疗气管塌陷。
近年来有学者提出对CEA患者进行术前电子支气管镜检查,如果存在气管膜部肌肉过长导致的重度TM,可在首次CEA食管气管瘘修补手术的同时进行胸腔镜下气管后固定术,可有效改善TM的临床症状以及气管塌陷情况[12, 18-21]。但该方法目前尚未在国内开展,电子支气管镜检查评估TM的流程也还需要进一步规范。气道支架置入术目前广泛用于治疗成人TM,但对于婴幼儿,由于气道内径的大小会伴随生长发育而改变,因此临床常见的支架较少用于婴幼儿。最近有研究提出可生物降解的气道支架适用于婴幼儿,但以个案报道为主。胃造瘘术可避免喂食时食物扩张食管而挤压气管,且能减少胃食管反流,因而可缓解TM的症状。
本研究受限于回顾性研究设计,在评估气管塌陷时存在以下缺陷:第一,电子支气管镜检查时堵塞气道,升高气道压力,可能降低发现TM的机率;第二,在评估气管塌陷时可能较为主观,本研究由新生儿外科重症监护病房医生和外科医生各一名共同评估,以尽量减少误差;第三,受电子支气管镜仪器的影响,透镜的曲率和方向造成的图像失真可能影响评估结果;第四,电子支气管镜检查结果中,左右分支支气管以及呼吸频率的影响可能导致气管塌陷使评估结果受到影响。尽管如此,电子支气管镜检查仍然是诊断TM的金标准,对于指导临床治疗具有一定的实用价值,后期需要更准确、更规范的评估标准和测量方法来指导CEA合并TM的治疗。
| [1] |
李樱子, 黄金狮, 杜京斌, 等. 先天性食管闭锁手术后并发症及处理[J]. 临床小儿外科杂志, 2018, 17(7): 519-522. Li YZ, Huang JS, Du JB, et al. Analysis and management of short-term postoperative complications after esophageal atresia repair[J]. J Clin Ped Sur, 2018, 17(7): 519-522. DOI:10.3969/j.issn.1671-6353.2018.07.010 |
| [2] |
Ure B. Esophageal atresia, Europe, and the future: BAPS Journal of Pediatric Surgery Lecture[J]. J Pediatr Surg, 2019, 54(2): 217-222. DOI:10.1016/j.jdedsurg.2018.10.071 |
| [3] |
林阳文, 江怡, 王俊. 食管闭锁重建术后食管功能评估的现状与发展[J]. 临床小儿外科杂志, 2021, 20(4): 388-392. Lin YW, Jiang Y, Wang J. Current status and future development of esophageal function after a reconstruction of esophageal atresia[J]. J Clin Ped Sur, 2021, 20(4): 388-392. DOI:10.12260/lcxewkzz.2021.04.016 |
| [4] |
陈功, 郑珊. 儿童食管狭窄的病因及诊治进展[J]. 临床小儿外科杂志, 2019, 18(6): 437-441. Chen G, Zheng S. Etiology, diagnosis and treatment of pediatric esophageal strictures[J]. J Clin Ped Sur, 2019, 18(6): 437-441. DOI:10.3969/j.issn.1671-6353.2019.06.001 |
| [5] |
Patria MF, Ghislanzoni S, Macchini F, et al. Respiratory morbidity in children with repaired congenital esophageal atresia with or without tracheoesophageal fistula[J]. Int J Environ Res Public Health, 2017, 14(10): 1136. DOI:10.3390/ijerph14101136 |
| [6] |
Kovesi T. Long-term respiratory complications of congenital esophageal atresia with or without tracheoesophageal fistula: an update[J]. Dis Esophagus, 2013, 26(4): 413-416. DOI:10.1111/dote.12061 |
| [7] |
Fraga JC, Jennings RW, Kim PC, et al. Pediatric tracheomalacia[J]. Semin Pediatr Surg, 2016, 25(3): 156-164. DOI:10.1053/j.sempedsurg.2016.02.008 |
| [8] |
Wallis C, Alexopoulou E, Anton-Pacheco JL, et al. ERS statement on tracheomalacia and bronchomalacia in children[J]. Eur Respir J, 2019, 54(3): 1900382. DOI:10.1183/13993003.00382-2019 |
| [9] |
Kim SH, Kim HY, Jung SE, et al. Clinical Study of Congenital Esophageal Stenosis: Comparison according to Association of Esophageal Atresia and Tracheoesophageal Fistula[J]. Pediatr Gastroenterol Hepatol Nutr, 2017, 20(2): 79-86. DOI:10.5223/pghn.2017.20.2.79 |
| [10] |
Hseu A, Recko T, Jennings R, et al. Upper airway anomalies in congenital tracheoesophageal fistula and esophageal atresia patients[J]. Ann Otol Rhinol Laryngol, 2015, 124(10): 808-813. DOI:10.1177/0003489415586844 |
| [11] |
Hysinger EB, Hart CK, Burg G, et al. Differences in Flexible and Rigid Bronchoscopy for Assessment of Tracheomalacia[J]. Laryngoscope, 2021, 131(1): 201-204. DOI:10.1002/lary.28656 |
| [12] |
Shieh HF, Smithers CJ, Hamilton TE, et al. Posterior Tracheopexy for Severe Tracheomalacia Associated with Esophageal Atresia (EA): Primary Treatment at the Time of Initial EA Repair versus Secondary Treatment[J]. Front Surg, 2018, 4: 80. DOI:10.3389/fsurg.2017.00080.eCollection2017 |
| [13] |
Fayoux P, Morisse M, Sfeir R, et al. Laryngotracheal anomalies associated with esophageal atresia: importance of early diagnosis[J]. Eur Arch Otorhinolaryngol, 2018, 275(2): 477-481. DOI:10.1007/s00405-017-4856-5 |
| [14] |
Emery JL, Haddadin AJ. Squamous epithelium in the respiratory tract of children with tracheo-oesophageal fistula, and retention lung[J]. Arch Dis Child, 1971, 46(250): 884. DOI:10.1136/adc.46.250.884-g |
| [15] |
Davies MR, Cywes S. The flaccid trachea and tracheoesophageal congenital anomalies[J]. J Pediatr Surg, 1978, 13(4): 363-367. DOI:10.1016/s0022-3468(78)80455-2 |
| [16] |
Kumar P, Goyal JP. Clinical Characteristics of Tracheomalacia in Infants[J]. Indian Pediatr, 2019, 56(3): 253-254. |
| [17] |
Tytgat S, van Herwaarden-Lindeboom MYA, van Tuyll van Serooskerken ES, et al. Thoracoscopic posterior tracheopexy during primary esophageal atresia repair: a new approach to prevent tracheomalacia complications[J]. J Pediatr Surg, 2018, 53(7): 1420-1423. DOI:10.1016/j.jpedsurg.2018.04.024 |
| [18] |
Snijders D, Barbato A. An Update on Diagnosis of Tracheomalacia in Children[J]. Eur J Pediatr Surg, 2015, 25(4): 333-335. DOI:10.1055/s-0035-1559816 |
| [19] |
Haveliwala Z, Yardley I. Aortopexy for tracheomalacia via a suprasternal incision[J]. J Pediatr Surg, 2019, 54(2): 247-250. DOI:10.1016/j.jpedsurg.2018.10.073 |
| [20] |
Polites SF, Kotagal M, Wilcox LJ, et al. Thoracoscopic posterior tracheopexy for tracheomalacia: A minimally invasive technique[J]. J Pediatr Surg, 2018, 53(11): 2357-2360. DOI:10.1016/j.jpedsurg.2018.08.004 |
| [21] |
Kamran A, Hamilton TE, Zendejas B, et al. Minimally invasive surgical approach for posterior tracheopexy to treat severe tracheomalacia: lessons learned from initial case series[J]. J Laparoendosc Adv Surg Tech A, 2018, 28(12): 1525-1530. DOI:10.1089/lap.2018.0198 |
 2021, Vol. 20
2021, Vol. 20


