先天性肾盂输尿管连接部梗阻(ureteropelvic junction obstruction, UPJO)是常见的小儿先天泌尿系疾病之一。过去十年,学者开展了大量UPJO解剖学、病理学、遗传学以及分子生物学等方面的研究,但其确切病因仍存在争议[1, 2]。近年来国内外研究表明,UPJO病因包括神经支配异常,肾盂输尿管连接部(ureteropelvic junction, UPJ)平滑肌细胞(smooth muscle cells, SMCs)功能紊乱、胶原替代以及UPJ间质细胞表达异常。最新研究表明,血小板源性生长因子受体-α(platelet-derived growth factor receptor α)阳性细胞作为一种新型间质细胞,存在于人类肾盂输尿管连接部。同时该研究发现PDGFRα阳性细胞表达的SK3通道在UPJO患儿中的表达显著减少,考虑这一变化可能在UPJO发病中具有重要作用[3]。然而目前关于PDGFRα阳性细胞在UPJO发病中作用的相关研究较少,且国内尚无文献报道,因此仍需进一步研究证实。本研究通过免疫组织荧光染色方法了解PDGFRα阳性细胞在UPJ处的分布,并分析其与Cajal细胞(interstitial cells of Cajal, ICCs)、平滑肌细胞以及神经纤维的作用关系,探讨它们在先天性肾盂输尿管连接部梗阻发病中的作用和临床意义。
材料与方法 一、标本来源于2018年7月至2019年1月收集首都医科大学附属北京儿童医院泌尿外科因先天性肾积水行肾盂成形术的单侧肾盂输尿管连接部狭窄段组织样本30例为UPJO组,其中男26例,女4例,中位年龄42个月(5~150个月)。30例均在肾盂成形术中证实为肾盂输尿管连接部狭窄。选择在此期间因肾脏肿瘤行肾输尿管切除术患儿的UPJ组织(排除肾盂输尿管连接部狭窄以及其他泌尿系统畸形,病理结果证实肿瘤未侵犯肾盂输尿管交界处)10例作为对照组,其中男3例,女7例,中位年龄27.5个月(2~ 84个月)。每个病例纵行取包含UPJ的组织5~8 mm,置入2%多聚甲醛和2.5%戊二醛的固定液中,4℃冰箱保存并固定24 h以上。每份标本均在肾盂端缝4 - 0丝线做标记。所有入组(包括UPJO组和对照组)患儿监护人均签署知情同意书,本研究经过首都医科大学附属北京儿童医院伦理委员会批准(编号:2016 - 73)。
二、实验方法对30例UPJO组和10例对照组的UPJ组织标本进行免疫荧光染色:①PDGFRα和C-kit采用免疫荧光双染,探讨PDGFRα阳性细胞与Cajal细胞的分布关系;②PDGFRα和鬼笔环肽采用免疫荧光双染,探讨PDGFRα阳性细胞与平滑肌细胞的分布关系,并对平滑肌细胞表型进行对比分析;③PDGFRα和PGP9.5免疫荧光双染,探讨PDGFRα阳性细胞与神经纤维的分布关系;④PDGFRα和SK3免疫荧光双染。标本石蜡包埋,10 μm厚横切后,将切片置入65℃烤箱60 min。脱蜡后用10%牛血清白蛋白(Solarbio,中国北京)阻断30 min,避免非特异性吸收。随后切片在4℃环境下、1%牛血清白蛋白稀释磷酸盐缓冲液中予一抗孵育一夜。切片用磷酸盐缓冲液冲洗,与相应的二抗或鬼笔环肽在室温下孵育1 h(相应一抗、二抗种类、来源和浓度等信息见表 1)。最后所有切片用4′,6-二脒基-2-苯吲哚盐酸抗体(4′6-diamidino-2-phenylindole, DAPI)染色10 min,用荧光封闭剂冲洗、安装、封片。
|
|
表 1 相应抗体及鬼笔环肽信息 Table 1 Antibodies and phalloidin for immunofluorescence |
1.免疫荧光结果判定:双盲法下用共焦显微镜进行独立评估。采用Vectra Polaris全自动定量病理成像系统进行荧光扫描,并选择视野进行光谱扫描,用inform软件对光谱进行拆分,对免疫荧光强度进行半定量分析。20倍显微镜下(放大200倍)每例标本用显微镜计算机图像分析处理系统随机截取5处视野图片测量免疫荧光强度。计算公式:免疫荧光强度=截取区域抗体积分光密度值/共域化面积。
2.平滑肌细胞表型分析:20倍显微镜下(放大200倍)观察鬼笔环肽(红色)染色部分,每例标本用显微镜计算机图像分析处理系统截取5处不同视野。双盲法下用Image Pro Plus 6.0软件计算每200倍高倍镜下截取的每张图片平滑肌细胞所占面积百分比,取每例5处平均值。
四、统计学处理利用SPSS21.0进行统计学分析。应用单样本K-S检验验证是否正态分布,应用Levene检验验证是否具有方差齐性。对服从正态分布的计量资料以均值、标准差表示,若为非正态分布则采用中位数表示。若资料为正态且方差齐采用两独立样本t检验;若资料为正态但方差不齐采用t′检验;若资料非正态采用Wilcoxon秩和检验。P < 0.05认为差异具有统计学意义。
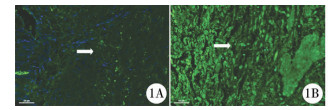
结 果 一、PDGFRα阳性细胞的分布PDGFRα阳性细胞在UPJ中广泛分布,呈纺锤形或星形,且环绕于DAPI标记的细胞核周围(图 1)。光镜下可见PDGFRα阳性细胞形成离散的网络状结构,并分布于尿道上皮细胞、内层环形肌以及外层纵行肌细胞之间。而免疫荧光结果显示PDGFRα阳性细胞在UPJO组与对照组之间分布无明显差异(P=0.30),见表 2。
|
Download:
|
| 图 1 UPJO组(1A)与对照组(1B)PDGFRα阳性细胞免疫荧光染色(×200):图中绿色部分代表PDGFRα表达阳性,蓝色部分为以DAPI标记的细胞核。可见PDGFRα阳性细胞(白色箭头标记)形成离散的网络状结构 Fig. 1 Immunolabeling of PDGFRα in human UPJ (green area) in muscle layers.(A:UPJO group; B:control group).Nuclei were counterstained with DAPI (blue area) | |
|
|
表 2 两组免疫荧光及平滑肌细胞表型分析结果 Table 2 Results of fluorescent intensity and phenotypic ana-lysis of SMCs in UPJO group versus control group |
C-kit抗体广泛适用于标记上尿路Cajal间质细胞,通过免疫荧光双染法检测C-kit抗体是否定位于PDGFRα阳性细胞。结果证实,在UPJO组与对照组中,PDGFRα阳性细胞均分布于Cajal细胞附近(图 2),但却不同于Cajal细胞(C-kit阳性细胞)。

|
Download:
|
| 图 2 UPJO组PDGFRα和C-kit免疫荧光双染(×200):图中绿色部分代表PDGFRα表达阳性,红色部分代表C-kit表达阳性,蓝色部分为以DAPI标记的细胞核 Fig. 2 Double immunolabeling of PDGFRα (green area) and C-kit (red area) in human UPJ in UPJO group.Nuclei were counterstained with DAPI (blue area) | |
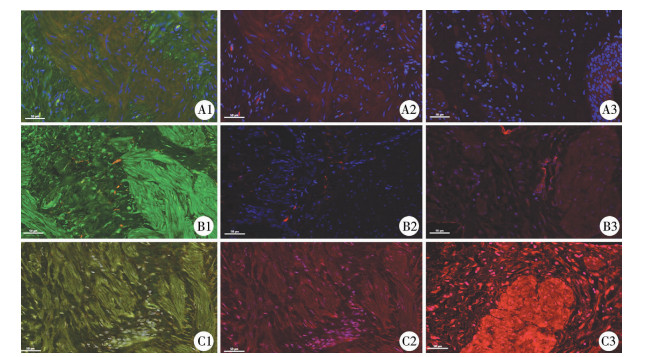
鬼笔环肽广泛适用于标记平滑肌细胞。本研究结果显示,PDGFRα阳性细胞分布于鬼笔环肽阳性平滑肌细胞周围(图 3),二者分布关系密切,平滑肌细胞在UPJO组分布密度较对照组显著增加(P=0.016),见表 2。
|
Download:
|
| 图 3 免疫荧光染色(×200) A1:UPJO组PDGFRα和鬼笔环肽免疫荧光双染(图中绿色部分代表PDGFRα表达阳性,红色部分代表鬼笔环肽表达阳性); A2:红色部分为UPJO组鬼笔环肽免疫荧光染色;A3:红色部分为对照组鬼笔环肽免疫荧光染色;B1:UPJO组PDGFRα和PGP9.5免疫荧光双染(图中绿色部分代表PDGFRα表达阳性,红色部分代表PGP9.5表达阳性); B2:红色部分为UPJO组PGP9.5免疫荧光染色;B3:红色部分为对照组PGP9.5免疫荧光染色;C1:UPJO组PDGFRα和SK3免疫荧光双染(图中绿色部分代表PDGFRα表达阳性,红色部分代表SK3表达阳性); C2:红色部分为UPJO组SK3免疫荧光染色;C3:红色部分为对照组SK3(红色)免疫荧光染色。所有图片蓝色部分为以DAPI标记的细胞核 Fig. 3 Immunofluorescence staining(×200) A1:Double immunolabeling of PDGFRα (green area) and phalloidin (red area) in UPJO; A2:Immunolabeling of phalloidin in UPJO (red area); A3:Immunolabeling of phalloidin in UPJ control (red area); B1:Double immunolabeling of PDGFRα (green area) and PGP9.5 (red area) in UPJO; B2:Immunolabeling of PGP9.5 in UPJO (red area); B3:Immunolabeling of PGP9.5 in UPJ control (red area); C1:Double immunolabeling of PDGFRα (green area) and SK3 (red area) in UPJO; C2:Immunolabeling of SK3 in UPJO (red areas); C3:Immunolabeling of SK3 in UPJ control (red area).Nuclei were counterstained with DAPI (blue area) | |
泛神经元标记蛋白基因产物9.5(pan-neuronal marker protein gene product 9.5, PGP9.5)是神经纤维中的一种特异性泛素羟基水解酶,可用作神经轴突标记物,抗PGP9.5抗体则可以与各种无髓或有髓的神经纤维相结合。本研究结果显示,光镜下可见PDGFRα阳性细胞分布于PGP9.5阳性神经纤维周围(图 3),神经纤维在UPJO组UPJ组织免疫荧光表达强度较对照组显著降低(P < 0.001),见表 2。
五、PDGFRα阳性细胞SK3通道的表达本研究结果显示,PDGFRα阳性细胞的细胞膜上SK3通道表达明显(图 3)。此外,与对照组相比,UPJO组PDGFRα阳性细胞SK3通道免疫荧光表达强度显著降低(P < 0.001),见表 2。
讨 论UPJO通常由内源性因素引起(约占75%),最常见的是肾盂输尿管连接部狭窄(本研究主要针对肾盂输尿管交界处狭窄,提及的所有UPJO均指此类病变)。过去几十年来,对UPJO的病因学研究已经取得一定进展。自1893年Santiago Ramony Cajal首次在胃肠道中发现Cajal间质细胞以来,相关研究数量逐渐增多。Solari等[4]首先报道UPJ处Cajal间质细胞密度的降低可能与UPJO发病有关,进一步的研究则证实UPJ处Cajal间质细胞与内层纵行肌纤维平行排列,并与神经纤维关系密切,提示Cajal间质细胞参与神经信号传导,并调控输尿管蠕动。同时该研究发现,UPJO患儿肾盂输尿管连接部纤维化明显,因此认为Cajal间质细胞数量的减少与输尿管蠕动功能的变化相关[5]。Iino等[6]首次在小鼠胃肠道中发现一种新型的间质细胞,其本质为“成纤维样细胞”(即PDGFRα阳性细胞),随后证实PDGFRα阳性细胞同样存在于小鼠以及人类膀胱中[7]。近年来,Hunziker等[3]研究证实在人类UPJ处同样存在PDGFRα阳性细胞,可能在UPJO发病中起重要作用。本研究表明在UPJ处至少存在两种不同的间质细胞,即C-kit阳性细胞(即Cajal间质细胞)及C-kit阴性细胞(即PDGFRα阳性细胞)。免疫荧光结果显示PDGFRα细胞呈梭形或星形,交错形成网络状结构,并分布于UPJ内层尿道上皮细胞以及平滑肌肌层之间。
UPJO患儿病理可见平滑肌细胞肥大/增生和萎缩/发育不全以及神经纤维耗竭[1]。与既往研究一致,本研究免疫荧光结果表明UPJO患儿平滑肌细胞分布密度较正常儿童显著增加,而神经纤维免疫荧光强度较正常儿童显著减少,提示存在平滑肌细胞肥大/增生以及神经纤维耗竭。Benedetto等[9]认为Cajal间质细胞作为UPJ处起搏细胞,参与神经信号传导,并调控平滑肌细胞收缩。同时有研究表明在小鼠胃肠道,PDGFRα阳性细胞可导致周围平滑肌细胞超极化,从而调控平滑肌细胞松弛[10]。因此越来越多学者认为在胃肠道中,PDGFRα阳性细胞、Cajal样细胞以及平滑肌细胞分布关系密切,形成SIP(SMCs-ICCs-PDGFRα positive cells)功能性合胞体,表达多种离子通道和受体,调节神经信号传导,进而调控平滑肌细胞收缩[10-12]。同样,本研究结果显示儿童UPJ处PDGFRα阳性细胞、Cajal间质细胞以及平滑肌细胞在位置分布上关系密切,提示形成的SIP功能性合胞体可能共同参与神经信号传导,调节UPJ处平滑肌细胞收缩。
既往动物实验证实,在豚鼠胃肠道及小鼠膀胱逼尿肌组织中存在PDGFRα阳性细胞丰富表达的SK3通道[13, 14]。SK3通道属于小电导钙离子激活钾离子通道蛋白中的一种亚型,对细胞膜电位的变化并不敏感,其激活完全依赖胞内钙离子浓度的升高,激活后导致细胞内钾离子外流,通过嘌呤能机制抑制周围神经传递,从而导致平滑肌细胞超极化以及平滑肌松弛[13-15]。与既往研究一致,本研究发现在人类UPJ组织中存在PDGFRα阳性细胞SK3通道表达,且相较于对照组,UPJO组患儿PDGFRα阳性细胞SK3通道表达显著减少。Lee[13]发现,阻断小鼠膀胱逼尿肌处SK3通道可以诱导PDGFRα阳性细胞的细胞膜去极化,并增加周围平滑肌的张力。结合本研究结果,笔者认为PDGFRα阳性细胞与Cajal间质细胞、平滑肌细胞在分布及功能上关系密切。Cajal间质细胞与PDGFRα阳性细胞共同调节神经传递,进而调节平滑肌细胞的收缩。而当UPJ处PDGFRα阳性细胞表达的SK3通道减少,抑制性神经传递也会减少,导致平滑肌过度收缩,远期可能导致神经纤维耗竭以及平滑肌细胞肥大/增生,最终导致肾盂输尿管连接部蠕动功能的异常。
总之,UPJ处平滑肌细胞、Cajal样细胞、神经纤维以及PDGFRα阳性细胞上SK3通道表达和分布的改变与UPJO病因密切相关,但仍需通过更多研究证实这些病理改变与UPJO发病的因果关系。
| 1 |
Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction[J]. Pediatr Nephrol, 2018, 33: 553-571. DOI:10.1007/s00467-017-3629-0. |
| 2 |
张潍平, 杨洋, 汪添益. 关于肾盂输尿管连接部梗阻病因和治疗的认识与争议[J]. 临床小儿外科杂志, 2018, 17(6): 401-404. DOI:10.3969/j.issn.1671-6353.2018.06.001. Zhang WP, Yang Y, Wang TY. Recent advances in the etiology and treatment of ureteropelvic junction obstruction[J]. J Clin Ped Sur, 2018, 17(6): 401-404. DOI:10.3969/j.issn.1671-6353.2018.06.001. |
| 3 |
Hunziker M, O'Donnell AM, Puri P. Platelet-derived gr-owth factor receptor alpha-positive cells:a new cell type in the human ureteropelvic junction[J]. Pediatr Res, 2017, 82(6): 1080-1087. DOI:10.1038/pr.2017.193. |
| 4 |
Solari V, Piotrowska AP, Puri P. Altered Expression of Interstitial Cells of Cajal in Congenital Ureteropelvic Junction Obstruction[J]. J Urol, 2003, 170(6): 2420-2422. DOI:10.1097/01.ju.0000097401.03293.f0. |
| 5 |
Senol C. Changes in Cajal cell density in ureteropelvic junction obstruction in children[J]. J Pediatr Urol, 2016, 12(2): 89.e1-e5. DOI:10.1016/j.jpurol.2015.08.010. |
| 6 |
Iino S, Horiguchi K, Horiguchi S, et al. c-Kit-negative fibroblast-like cells express platelet-derived growth factor receptor alpha in the murine gastrointestinal musculature[J]. Histochem Cell Biol, 2009, 131(6): 691-702. DOI:10.1007/s00418-009-0580-6. |
| 7 |
Monaghan KP, Johnston L, McCloskey KD. Identification of PDGFR alpha positive populations of interstitial cells in human and guinea pig bladders[J]. J Urol, 2012, 188(2): 639-647. DOI:10.1016/j.juro.2012.03.117. |
| 8 |
Zhang PL, Peters CA, Rosen S. Ureteropelvic junction obstruction:morphological and clinical studies[J]. Pediatr Nephrol, 2000, 14(8-9): 820-826. DOI:10.1007/s004679900240. |
| 9 |
Di Benedetto A, Arena S, Nicotina PA, et al. Pacemakers in the upper urinary tract[J]. Neurourol Urodyn, 2013, 32(4): 349-353. DOI:10.1002/nau.22310. |
| 10 |
Lu C, Huang X, Lu HL, et al. Different distributions of interstitial cells of Cajal and platelet-derived growth factor receptor-α positive cells in colonic smooth muscle cell/interstitial cell of Cajal/platelet-derived growth factor receptor-α positive cell syncytium in mice[J]. World J Gastroenterol, 2018, 24(44): 4989-5004. DOI:10.3748/wjg.v24.i44.4989. |
| 11 |
Koh SD, Ward SM, Sanders KM. Ionic conductances regulating the excitability of colonic smooth muscles[J]. Neurogastroenterol Motil, 2012, 24(8): 705-718. DOI:10.1111/j.1365-2982.2012.01956.x. |
| 12 |
Blair PJ, Rhee PL, Sanders KM, et al. The significance of interstitial cells in neurogastroenterology[J]. J Neurogastroenterol Motil, 2014, 20(3): 294-317. DOI:10.5056/jnm14060. |
| 13 |
Lee H, Koh BH, Peri LE, et al. Purinergic inhibitory regulation of murine detrusor muscles mediated by PDGFRα+ interstitial cells[J]. J Physiol, 2014, 592(6): 1283-1293. DOI:10.1113/jphysiol.2013.267989. |
| 14 |
Klemm MF, Lang RJ. Distribution Of Ca2+-Activated K+Channel (SK2 and SK3) Immunoreactivity In Intestinal Smooth Muscles Of The Guinea-Pig[J]. Clin Exp Pharmacol Physiol, 2002, 29(1-2): 18-25. DOI:10.1046/j.1440-1681.2002.03601.x. |
| 15 |
Yeoh JW, Corrias A, Buist ML. A mechanistic model of a PDGFRα+ cell[J]. J Theor Biol, 2016, 408: 127-136. DOI:10.1016/j.jtbi.2016.08.004. |
 2020, Vol. 19
2020, Vol. 19


