2. 苏州大学附属儿童医院儿科研究所(江苏省苏州市, 215000)
2. Institute of Pediatrics, Affiliated Children's Hospital, Soochow University, Suzhou 215003, China
先天性尿道下裂是一种以男性尿道开口位置异常为主要表现的先天性疾病,多数患者伴有阴茎下弯,包皮帽状堆积于背侧等表现,尿道口可分布在正常尿道口至会阴部连线上的任一位置[1]。对于其发病机制目前尚未明确,但大多数观点认为是遗传以及内分泌共同作用下的结果[2]。流行病学调查发现尿道下裂发病率存在种族和地区差异。尿道下裂在北欧的发病率高达464/10 000,在亚洲的发病率却只有5/10 000~50/10 000 [3]。而国内的新生儿健康筛查中,男婴中的发病率约为3‰。国际上尿道下裂手术治疗已有100多年的历史,而我国开展尿道下裂的规范化治疗约有50年,积累了大量临床经验。然而关于尿道下裂发病原因的研究仍然相对不足[4]。
miRNAs(MicroRNAs)是一类新发现的,能对转录后基因的表达水平起重要指导作用的的非编码单链小分子RNA,大小在18~22 nt之间,在调控众多生物过程中扮演着重要的作用。其作用机制中关键的一步在于与mRNA的3’端相互作用,少部分也可与5’端作用,形成沉默复合体后指导降解靶mRNA或者阻止mRNA的翻译,进而对基因的表达以及蛋白质的合成产生调节作用[5-8]。有研究表明miRNA可以介导靶基因DNA的甲基化,进而在转录水平抑制靶基因的表达[9]。目前miRNA对肿瘤的发生、发展的作用,以及其在治疗方面应用的前景已经越来越受到人们的关注[10, 11]。
但对于与尿道下裂相关的miRNA表达尚未见相关报道。本研究以尿道下裂与一般包茎患儿为研究对象,利用芯片技术筛选各组患儿包皮组织差异性表达的miRNAs,旨在探讨其与先天性尿道下裂病因、治疗以及预后的相关性。
材料与方法 一、标本来源及分组在取得患儿及其家属知情同意后,收集就诊于苏州大学附属儿童医院的单纯性尿道下裂及包茎患儿手术中所取包皮组织,立即保存于液氮中,后转至-80℃冰箱中备用。取9例尿道下裂患儿包皮组织设为实验组,其中6例标本(3例前阴茎体型,3例后阴茎体型)归为尿道下裂术前未用药组。另外3例后阴茎体型患儿,术前因阴茎体较短小,行HCG治疗后再行手术治疗,术中所取标本归为术前HCG治疗尿道下裂组。另取3例包茎患儿包皮组织设为对照组。所有患儿年龄范围为1~4岁,染色体检查均为46,XY,母亲孕期均体健、无疾病及药物摄入史,患儿出生时一般状况良好,生后无重大疾病史,未经过特殊药物治疗,无并发其他泌尿或消化系统畸形,并均为初次接受手术治疗的患儿。术前HCG治疗尿道下裂组均由本院采取统一的治疗方案,1 000 U/次,间隔两天1次,10次为1个疗程,且均在治疗结束1个月后行手术治疗。治疗后阴茎大小均达到手术要求。随机选取的对照组患儿一般资料与实验组相匹配。
二、实验主要试剂及仪器主要试剂:Trizol试剂、无RNA酶的水(DEPC水)(美国Invitrogen生命技术有限公司)、氯仿、异丙醇、无水乙醇、0.02 moL乙酸钠、甲醛(上海化学试剂有限公司)、琼脂糖、0.2 moL MOPS pH7.0、0.01 moL EDTA、1 mmoL EDTA、10 mmoL Tris-HCl pH8(华美生物工程公司)、甲醛上样染液(上海拜力生物科技有限公司)、Gold View染料(上海赛百胜基因技术有限公司)、miRCURY LNATM microRNA Array、杂交试剂盒、miRCURYTM芯片洗脱试剂盒(丹麦Exiqon公司)、RNA酶抑制剂、MMLV反转录酶、10×RT缓冲液(Epicentre公司)、2.5 mmoL dNTP混合液(HyTest生物科技有限公司)和2×PCR master mix(Arraystar公司)。
引物设计:通过引物设计软件Primer 5.0 ViiA 7 Real-time PCR System,根据miRNA引物设计原则,设计引物,所有引物由上海百力格生物技术有限公司负责设计以及合成。实时定量PCR使用引物列表见表 1。
|
|
表 1 实时定量PCR使用引物列表 Table 1 List of primers during real-time quantitative PCR |
1.提取总RNA并行质量检测:取各组组织样本,采用TRIZOL一步法提取总RNA,将获得的RNA溶液保存于-80℃冰箱中。采用紫外吸收测定法及变性琼脂糖凝胶电泳对RNA进行质量检测,确保无DNA、蛋白及酚的污染,杂质较少并保证RNA制备过程中并未出现DNA污染。
2.筛选差异性表达的miRNAs:RNA使用丹麦Exiqon公司的miRCURYTM芯片标记试剂盒分别标记相关标本后进行芯片杂交。杂交后将芯片使用Axon GenePix 4000B进行图像扫描后采用GenePix pro V6.0进行原始数据分析。
3.统计学处理:芯片结果包括P值和差异倍数,选择P -value(0.05、fold change)2倍的差异基因,并对差异表达miRNAs进行聚类分析。
4. cDNA合成:制备RT混合反应液20 μL,在PCR扩增仪进行RT反应。反应条件:16℃ 30 min,42℃ 40 min,85℃ 5 min。反应结束后,将其放在-20℃冰箱保存。
5.实时定量PCR:将所有cDNA样本分别配置Realtime PCR反应体系。将溶液混合,5 000 r/min短暂离心。将8 μL混合液加到384-PCR板相对应的孔中,再加入2 μL cDNA。短暂离心使其混合,在设置PCR程序前将准备好的PCR板置于冰上。将上述384-PCR板置于Realtime PCR仪上进行PCR反应。95℃ 10 min;40个循环(95℃,10 s;60℃,60 s(收集荧光))。待扩增反应结束后建立PCR产物的熔解曲线,按(95℃,10 s;60℃,60 s;95℃,15 s);并从60℃开始以0.05℃/s(仪器自动进行Ramp Rate)缓慢加热到99℃。
6.数据分析:本研究通过RT-PCR对样本进行相对定量分析,计算表达的差异。RT-PCR结果采用2-△△CT法进行分析。
结 果 一、miRNAs筛选结果与对照组相比,尿道下裂术前未用药组中表达上调的miRNA 19个、表达下调的miRNA 15个;将尿道下裂术前未用药组和术前HCG治疗尿道下裂组进行对比发现,术前行HCG治疗较未行治疗者表达上调的miRNA 25个、表达下调的miRNA 19个,而尿道下裂术前行HCG治疗组的miRNA表达趋势与包茎组的miRNA表达趋势接近。本研究对有表达差异的miRNA进行RT-PCR验证,结果发现let-7b-3p、miR-145-5p、miR-376a-3p、miR-377-3p在尿道下裂术前未用药组中低表达,而在包茎和术前HCG治疗尿道下裂组中高表达;miR-1-3p在尿道下裂术前HCG治疗组中较未用药组中高表达。
在对照组、尿道下裂术前未用药组和术前HCG治疗尿道下裂组之间,有部分miRNA形成一定的差异表达趋势。而尿道下裂术前HCG治疗组的miRNA表达趋势与正常对照组的miRNA表达趋势接近。
二、RT-PCR扩增曲线和溶解曲线与RT-PCR验证结果列出内参U6及与本研究相关的差异表达的miRNA在所有样本中的扩增曲线及溶解曲线,并对差异表达的miRNA挑选其中5个进行RT-PCR验证,各样本的miRNA和内参(U6)分别进行R-T PCR反应,数据采用2 -△△CT法进行分析。具体结果见图 1-1~图 1-6。
|
Download:
|
| 图 1 内参U6及差异表达的miRNA在所有样本中的扩增曲线及溶解曲线 Fig. 1 Amplification curve and solubility curve of U6 and differentially expressed miRNA in all samples | |
对于RT-PCR的结果,实验以U6为内参,对照组为基准得到结果见表 2。
|
|
表 2 RT-PCR检测miRNA的相对表达量 Table 2 Relative expression of miRNA as detected by RT-PCR |
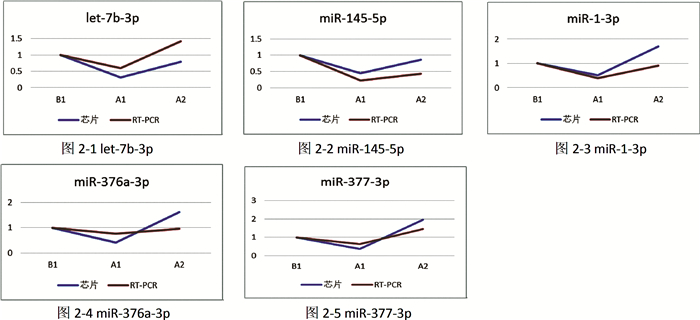
将芯片结果与RT-PCR结果比较,比较三组样本miRNA的差异表达趋势,做折线图(图 2-1~图 2-5),可以看出let-7b-3p、miR-145-5p、miR-376a-3p、miR-377-3p、miR-1-3p的RT-PCR结果与芯片检测结果一致。
|
Download:
|
| 图 2 三组样本间个miRNA的差异表达趋势 Fig. 2 Differential expression trend of miRNA among three sample groups | |
RT-PCR仪所绘制出的扩增曲线及溶解曲线均成单峰,提示产物具有特异性。经过数据转换,可以得到2-ΔΔCT值。与芯片结果对比后能发现,let-7b-3p、miR-145-5p、miR-376a-3p、miR-377-3p和miR-1-3p在尿道下裂术前未用药组中低表达,而在对照组和术前HCG治疗尿道下裂组中高表达,其PCR结果与芯片结果表达趋势相符。依此推测术前应用HCG治疗可改变miRNA的表达,使其更接近正常组织。其中miR-1-3p在术前HCG治疗尿道下裂组中较未用药组中高表达,其PCR结果与芯片结果相符;而其余4个miRNA则两种结果部分相符。
讨 论尿道下裂是因胚胎期外生殖器发育异常所致的小儿泌尿生殖系统中常见的先天性畸形。目前对于尿道下裂的发生普遍认为与胚胎发育期间的环境、基因等原因造成的内分泌缺陷有关。
早在1995年就已经有人提出在尿道下裂术前行相应的激素治疗(包括HCG、DHT、睾酮等)能暂时增加阴茎体的长度和龟头的直径,改善局部的皮肤条件,术中可见包皮血供更加丰富,血管蒂厚度增加[12]。Zhao等[13]应用Meta分析显示与术前未行激素治疗的病例相比,严重程度相似而术前使用睾酮、DHT和HCG等激素治疗的尿道下裂患儿术后并发症发生率无统计学意义。但有研究提示,一定剂量的外源性HCG的应用能提高尿道下裂小鼠阴茎皮肤表皮生长因子的表达[14]。而在兔的尿道下裂模型发现HCG可使包皮组织中血管表皮生长因子的表达增加,进而起到促进伤口愈合的作用[15]。
血管内皮生长因子(VEGF)是正常和异常血管的重要调节因子,在增强血管的渗透性、诱导血管生成以及对内皮细胞生长、促进细胞迁移、抑制细胞凋亡等方面发挥着重要的作用。VEGF在不同组织器官中,对生理和病理性血管的新生有着重要影响。有研究表明,VEGF在胚胎血管发生中起重要作用,在女性生殖系统中,卵泡生长和卵巢黄体的内分泌功能更是与血管的增殖和凋亡有着重要的联系,而这些都与VEGF在子宫中的表达相关[16]。
有研究结果表明miR145等其他miRNAs在抑制肠癌、乳腺癌、肺癌、前列腺癌、肝癌和胶质瘤等癌细胞的生长中起着重要的影响,其作用机制可能与对血管内皮细胞的抑制有关[17-20]。同样,研究表明miR145可通过调节同样与血管内皮细胞的增殖和迁移相关的ADAM17的表达,而抑制人脐静脉血管内皮细胞(HUVECs)的增殖和迁移[21]。近年来,多项研究发现miR-145在血管平滑肌细胞(vascular smooth muscle cell, VSMC)表型调节过程中同样具有重要作用[22, 23]
本研究发现差异性表达的miRNA中,与VEGF具有密切联系的miRNA并不仅有miR145。在对大肠癌的研究中发现miR-376a表达降低,但在VEGF阳性的大肠癌中却相对表达升高,而miR-377在心肌缺血时通过靶向调节VEGF诱导间充质干细胞的血管生成[24, 25]。
3例术前行HCG治疗的尿道下裂患儿正是因为阴茎较短小,手术条件不足予术前进行激素治疗,其目的是为了改善阴茎条件,利于手术顺利进行。术中也发现,术前的HCG治疗确实有利于改善手术条件。
本研究发现miR-145在内的多个miRNA在包茎组以及术前使用HCG治疗的尿道下裂组包皮组织中的表达高于术前未用HCG治疗尿道下裂组,且其作用与VEGF的表达有着密切联系。由此推测术前HCG治疗对重型尿道下裂患儿,尤其是阴茎体发育不良患儿阴茎组织血管的分布,特别是术后新生血管的增殖及迁移有积极作用。但对于术前阴茎体发育良好的患儿以及轻型尿道下裂患儿术前行HCG治疗是否也存在同样的积极作用,尚有待进一步的研究。
| 1 |
Antonio M, Atila R, Valdemar O. Hypospadias[J]. Current Opinion in Urology, 2012, 22(6): 447-452. DOI:10.1097/MOU.0b013e328357bc62. |
| 2 |
van der Zanden LF, van Rooij IA, Feitz WF, et al. Aetiology of hypospadias:a systematic review of genes and environment[J]. Hum Reprod Update, 2012, 18(3): 260-283. DOI:10.1093/humupd/dms002. |
| 3 |
Springer A, Van vom den Heijkant M, Baumann S. Worldwide prevalence of hypospadias[J]. J Pediatr Urol, 2016, 12(3): 152.e1-152.e7. DOI:10.1016/j.jpurol.2015.12.002. |
| 4 |
张潍平. 尿道下裂手术治疗的热点与难点问题[J]. 临床小儿外科杂志, 2016, 15(5): 417-419. DOI:10.3969/j.issn.1671-6353.2016.05.001. Zhang WP. The hot and difficult points of surgical treatment in hypospadias[J]. J Clin Ped Sur, 2016, 15(5): 417-419. DOI:10.3969/j.issn.1671-6353.2016.05.001. |
| 5 |
Wang N, Zhou Z, Liao X, et al. Role of microRNAs in cardiac hypertrophy and heart failure[J]. IUBMB Life, 2009, 61(6): 566-571. DOI:10.1002/iub.204. |
| 6 |
O'Reilly S. MicroRNAs in fibrosis:opportunities and challenges[J]. Arthritis Res Ther, 2016, 18(1): 11. DOI:10.1186/s13075-016-0929-x. |
| 7 |
Hu YB, Li CB, Song N, et al. Diagnostic value of microRNA for Alzheimer's disease:a systematic review and meta-analysis[J]. Front Aging Neuroscie, 2016, 8: 13. DOI:10.3389/fnagi.2016.00013. |
| 8 |
Hawkes JE, Nguyen GH, Fujita M, et al. microRNAs in Psoriasis[J]. J Invest Dermatol, 2016, 136(2): 365-371. DOI:10.1038/JID.2015.409. |
| 9 |
Wu L, Zhou H, Zhang Q, et al. DNA methylation mediated by a microRNA pathway[J]. Mol Cell, 2010, 38(3): 465-475. DOI:10.1016/j.molcel.2010.03.008. |
| 10 |
Hata A, Kashima R. Dysregulation of microRNA biogenesis machinery in cancer[J]. Crit Rev Biochem Mol Biol, 2016, 51(3): 121-134. DOI:10.3109/10409238.2015.1117054. |
| 11 |
Sun T, Yang M, Kantoff PW, et al. Role of microRNA-221/-222 in cancer development and progression[J]. Cell Cycle, 2009, 8(15): 2315-2316. DOI:10.4161/cc.8.15.9221. |
| 12 |
Netto JM, Ferrarez CE, Schindler, et al. Hormone therapy in hypospadias surgery:A systematic review[J]. J Pediatr Urol, 2013, 9(6): 971-979. DOI:10.1016/j.jpurol.2013.03.009. |
| 13 |
Zhao W, Yin J, Yang Z, et al. Meta-analysis of androgen insensitivity in preoperative hormone therapy in hypospadias[J]. Uroly, 2015, 85(5): 1166. DOI:10.1016/j.urology.2015.01.035. |
| 14 |
Han XB, Yang XF, Mi ZG. Human chorionic gonadotrophin regulates epidermal growth factor in the phallus of hypospadias mice[J]. Zhonghua Nan Ke Xue, 2008, 14(10): 884-887. |
| 15 |
李德彪.HCG调控兔先天性尿道下裂阴茎组织VEGF浓度的研究[D].山西: 山西医科大学, 2007. Li DB.Stimulation of VEGF in rabbit phallus with hypospadias: role of HCG[D].Shanxi: Shanxi Medical Unive-rsi-ty, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10114-2007177204.htm |
| 16 |
Kim D, Lee J, Johnson AL. Vascular endothelial growth factor and angiopoietins during Hen ovarian follicle development[J]. Gen Comp Endocrinol, 2016, 232: 25-31. DOI:10.1016/j.ygcen.2015.11.017. |
| 17 |
Lei P, Xie J, Wang L, et al. microRNA-145 inhibits osteosarcoma cell proliferation and invasion by targeting ROCK1[J]. Mol Med Rep, 2014, 10(1): 155-160. DOI:10.3892/mmr.2014.2195. |
| 18 |
Sakr M, Takino T, Sabit H, et al. miR-150-5p and miR-133a suppress glioma cell proliferation and migration through targeting membrane-type-1 matrix metalloproteinase[J]. Gene, 2016, 587(2): 155-162. |
| 19 |
徐丽平, 李佳, 沈雷, 等. 微小RNA-518b在乳腺浸润性导管癌中的表达及其功能[J]. 中华实验外科杂志, 2012, 29(5): 833-836. DOI:10.3760/cma.j.issn.1001-9030.2012.05.019. Xu LP, Li J, Shen L, et al. Expression pattern and function of microRNA-518b in invasive ductal breast cancer[J]. Chin J Exp Surg, 2012, 29(5): 833-836. DOI:10.3760/cma.j.issn.1001-9030.2012.05.019. |
| 20 |
胡超, 沈世强, 崔忠惠. 下调微小RNA-145表达对人肝癌血管内皮细胞生物学行为的影响[J]. 中华实验外科杂志, 2014, 31(10): 2108-2111. DOI:10.3760/cma.j.issn.1001-9030.2014.10.008. Hu C, Shen SQ, Cui ZH. Effects of suppressing the expression of microRNA-1 on biological behaviors in the vascular endothelial cells of human hepatocellular carcinoma[J]. Chin J Exp Surg, 2014, 31(10): 2108-2111. DOI:10.3760/cma.j.issn.1001-9030.2014.10.008. |
| 21 |
范良, 殷铁军, 李岽健, 等. 微小RNA145对人脐静脉血管内皮细胞增殖迁移的影响[J]. 中华实验外科杂志, 2013, 30(2): 262-264. DOI:10.3760/cma.j.issn.1001-9030.2013.02.021. Fan L, Yin TJ, Li DJ, et al. Effects of microRNA145 on proliferation and migration of human umbilical vein endothelial cells[J]. Chin J Exp Surg, 2013, 30(2): 262-264. DOI:10.3760/cma.j.issn.1001-9030.2013.02.021. |
| 22 |
Albinsson S, Suarez Y, Skoum A, et al. MiRNAs are necessary for vascular smooth muscle growth, differentiation and function[J]. Arterioscler Thromb Vasc Biol, 2010, 30(6): 1118-1126. DOI:10.1161/ATVBAHA.109.200873. |
| 23 |
Cordes KR, Sheehy NT, White MP, et al. miR-145 and miR-143 regulate smooth muscle cell fate and plasticity[J]. Nature, 2009, 460(7256): 705-710. DOI:10.1038/nature08195. |
| 24 |
Mo ZH, Wu XD, Li S, et al. Expression and clinical significance of microRNA-376a in colorectal cancer[J]. Asian Pac J Cancer Prev, 2014, 15(21): 9523-9527. DOI:10.7314/APJCP.2014.15.21.9523. |
| 25 |
Wen Z, Huang W, Feng Y, et al. MicroRNA-377 regulates mesenchymal stem cell-induced angiogenesis in ischemic hearts by targeting VEGF[J]. PLoS One, 2014, 9(9): e104666. DOI:10.1371/journal.pone.0104666. |
 2019, Vol. 18
2019, Vol. 18


