先天性巨结肠症(Hirschsprung's disease, HSCR) 又称肠无神经节细胞症,是最常见的先天性肠道运动障碍疾病,发病率约1/5 000,亚裔人群发病率更高[1]。患者以腹胀、胎便排出延迟、呕吐及便秘等功能性肠梗阻症状为主要临床表现。HSCR的病理特征为不同范围肠道黏膜下及肌间神经丛中缺乏肠神经节细胞,国际上根据病变肠管范围将HSCR分为超短段型(ultra-short segment HSCR, US-HSCR)、短段型(short segment HSCR, S-HSCR)以及长段型(long segment HSCR, L-HSCR),其中L-HSCR又进一步被细分为累及部分结肠、全部结肠(total colonic aganglionosis, TCA)以及全部结肠和部分小肠的无神经节细胞症(total colonic with small bowel aganglionosis, TCSA)[2]。TCSA可以表现为累及十二指肠至直肠的全肠无神经节细胞症,临床罕见,预后较其他类型HSCR差[2]。SOX10基因是神经嵴细胞(neural crest cell, NCC)发育过程中的关键转录因子,调控神经嵴来源的黑色素细胞、肠神经系统、施万细胞和嗅觉包鞘细胞,以及神经嵴外组织(如内耳和寡突胶质细胞)[3]。本文报道1例合并SOX10基因突变的全肠无神经节细胞症。本研究通过天津市儿童医院伦理委员会审批(伦审-W-2025-017)
患儿,男,出生后35 h,足月顺产,无特殊孕产史及家族史,出生体重3.25 kg,出生后无自主排便,因出生后间断呕吐35 h入院。入院前X线片提示机械性不全性肠梗阻,超声提示腹腔肠管扩张。查体:腹软稍胀,肠鸣音微弱,肛门指检直肠裹手感明显,退出手指时有大量墨绿色稀便排出。入院后经禁食、胃肠减压、灌肠治疗后排出较多胎粪,腹胀部分缓解,但患儿始终无自主排便,呕吐无缓解,予持续胃肠减压,每日胃肠减压量40~60 mL,为黄绿色液体。呕吐程度与腹胀程度不平行。
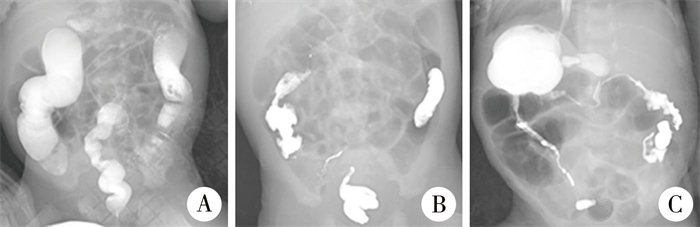
患儿入院后先后完善钡灌肠检查及上消化道造影,结果提示:直肠、乙状结肠远端肠腔略狭窄,管壁僵硬,近端肠管略扩张,24 h后复查见钡剂部分残留,考虑先天性巨结肠症;十二指肠球部后段肠管形态扩张,对比剂下降至十二指肠降段及水平段缓慢,并可见拟蠕动,延迟15 min后观察,见部分对比剂下行进入空肠近端,近端空肠略扩张(图 1)。
|
图 1 先天性巨结肠症患儿消化道造影检查结果 Fig.1 Imaging study of gastrointestinal tract in a HSCR child 注 A:钡灌肠造影显示乙状结肠近端结肠扩张;B:钡灌肠后24 h见钡剂残留;C:上消化道造影仍可见钡灌肠钡剂部分残留,俯卧位见造影剂于十二指肠内下行困难 |
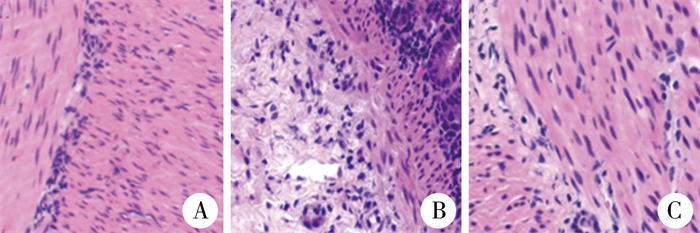
为进一步明确诊断,予全身麻醉下开腹探查加肠活检术。术中见腹腔内小肠、结肠均匀扩张增粗,肠壁肥厚质韧,肠管内大量水样便淤积。于直肠乙状结肠交界处、降结肠、横结肠、升结肠、末端回肠以及距Treitz韧带150 cm、100 cm、70 cm、50 cm、30 cm、10 cm处分批次取全层肠活检,冰冻病理检查结果显示送检标本均无神经节细胞,考虑为全肠无神经节细胞症。为尽可能缓解患儿呕吐及腹胀,同时避免短肠综合征,于距Treitz韧带80 cm处回肠行双腔造口术。术后造口可见稀水样粪便排出,无明显腹胀,呕吐症状部分缓解,停止胃肠减压,但仍无法耐受喂养,予持续静脉营养治疗。术后石蜡切片病理结果回报送检各处肠壁肌间均未见神经节细胞(图 2)。术后1周家属放弃治疗出院,后续电话随访患儿已死亡。
|
图 2 先天性巨结肠症患儿肠活检病理图片(HE染色,×100) Fig.2 Histopathological sections of intestinal biopsy in a HSCR child (HE stain, ×100) 注 A:直肠乙状结肠交界处;B:结肠;C:小肠 |
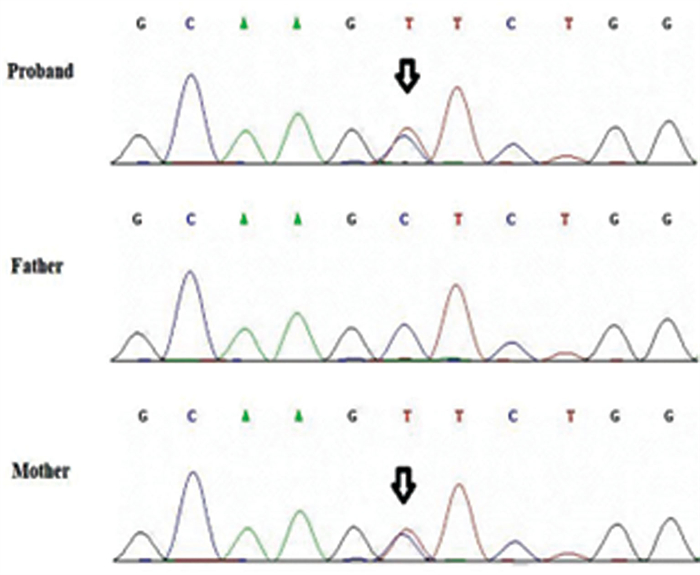
住院期间经患儿父母知情同意,采集患儿和父母外周血行全外显子基因测序,结果显示先证者SOX10基因c.421C>T杂合变异,导致氨基酸发生错义突变Leu141Phe,Sanger测序验证变异来自患儿母亲(图 3)。此外患儿还检测到GATA6(c.730G>A)、POLG(c.2005A>T)及RDH12(c.524C>T)基因变异。
|
图 3 先天性巨结肠症患儿及其父母基因测序峰图 Fig.3 Sequencing chromatograms of proband and their parents |
HSCR是小儿外科常见严重消化系统畸形,以顽固性便秘、腹胀等肠梗阻症状为主要临床表现,多于新生儿期开始出现症状。HSCR的病理基础是由NCC衍生而来的肠神经系统(enteric nervous system, ENS)发育异常。NCC是一类具有高度迁移性和增生性的细胞群,于胚胎发育过程中进入肠道并通过间充质向肠道远端迁移,同时广泛增殖、分化, 在肠道形成肌间和黏膜下神经丛, 并最终形成ENS[4]。NCC在此过程中出现增殖、生存、迁移或分化上的改变都可能使ENS发育缺陷,导致受累肠管持续收缩引起肠梗阻,近端肠管扩张而出现巨结肠。
目前研究认为,HSCR是具有部分外显性和多样性表型的基因疾病[4]。已有十多个基因被确认为与HSCR相关, 其中最重要的是受体酪氨酸激酶RET-胶质细胞源性神经营养因子(rearranged during transfection/glial cell derived neurotrophic factor,RET/GDNF)通路和内皮素3-内皮素受体B(Endothelin 3/Endothelin Receptor Type B,ET3/EDNRB)通路[5]。此外多个与其相关的转录因子(如SOX10、PAX3和PHOX2B等)也被发现与HSCR发病有关[6]。SOX10(性别决定区盒基因,SRY-box 10)在迷走神经NCC丛神经管迁移时表达,是ENS前体细胞的标志物,其突变增加NCC的凋亡率,使NCC在定植于消化道前凋亡而导致肠神经发育异常[7]。已有研究表明,SOX10可与多个ENS相关基因产生相互作用而影响ENS的形成[8]。SOX10基因突变被认为与瓦尔登堡综合征(Waardenburg-Shah syndrome, WS)密切相关。但遗憾的是本例未能通过充足的临床表现及相关检查确诊WS。在目前报道合并SOX10突变的HSCR病例中,几乎都诊断为WS,仅Sánchez-Mejías等[9]报道的1例明确排除了WS,他认为这种现象的出现可能是由于相比其他来源于NCC的组织,单倍剂量不足效应对ENS发育的影响更为显著。而Sangkhathat等[10]报道的2例虽未诊断为WS,但其研究中未对WS相关临床表现及辅助检查进行任何说明。目前研究中发现的合并SOX10突变的TCSA病例仍属罕见,有文献报道的病例与本例有着类似的累及大部分小肠的病变范围[11-14]。本例所发现的SOX10突变位点c.421C>T目前尚未见文献报道,其位于SOX10基因的HMG结构域,意味着这个突变可能影响了SOX10对DNA的结合以及与其他伴侣蛋白之间的相互作用[7]。
TCA作为HSCR的一种特殊和严重类型,有学者认为其与常见型HSCR应区分对待,不仅因为TCA表现出更复杂的临床表现与治疗难度,更因其男女发病比例(1 ∶ 1~0.8 ∶ 1)较普通HSCR(4 ∶ 1)有显著差异,这意味着其在致病基因上可能有着更大的区别[6]。Moore[2]认为,TCA较常见型HSCR有着更明显的遗传倾向,尽管其基因信息尚不完全明确,但在发病机制中可能有着不同的信号通路。而Lake等[15]指出,目前尚未发现任何已知的HSCR相关基因有着完全外显性,这样的基因表型特点以及HSCR病例所表现出的病理程度的异质性意味着基因之间存在相互作用,以及非基因的“胚胎环境”因素可能在其中产生了影响。Sox10Dom小鼠模型是一个非常典型的例子,即使在这种同系繁殖的模型中,个体之间巨结肠病变的长度也存在差异。基于此,有研究人员发现Sox10和EdnrB变异基因间相互作用影响了小鼠无神经节细胞症的严重程度[16]。针对TCA或TCSA病例,在基因水平上的研究有助于帮助我们进一步探索肠NCC迁移分化过程中的异常对于ENS形成障碍的影响。
TCSA作为HSCR及TCA中病理变化最为极端的一种,临床表现并不典型,本例患儿以难以缓解的呕吐为主要临床症状,并没有典型的明显腹胀症状,造影检查提供了重要的临床价值。HSCR的治疗以手术为主,无论采取何种术式,都需要切除无神经节细胞的肠管,而对于TCSA患儿,尤其是累及大部分小肠的病例,这种根治性手术势必造成严重的短肠综合征,尽管有研究者曾提出全肠肌层切开术作为可能的治疗方法,但未能得到进一步临床病例的实践来证明其效果[17]。近年来,间断无神经节细胞肠段延长转位术(Skipped aganglionic lengthening transposition,SALT)在部分病例报道中表现出较好的效果,其利用自体无神经节细胞的小肠短段,间断地插入近端正常小肠以完成肠延长术,但其前提仍需要患儿保有一定长度的具有正常神经节细胞的小肠[18]。无论如何,大多数TCSA病例的治疗仍然是巨大的临床挑战,尤其对于类似本例几乎累及所有小肠的病例,其远期生存仍寄希望于肠移植术[19]。基于目前外科治疗所面临的困难,有研究者着眼于HSCR的干细胞治疗,尽管尚未应用于临床,但其动物实验成果仍为未来的治疗方法提供了希望[20]。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 张骜、杜晓斌负责文献检索,张骜、赵绪稳负责论文设计,杨福江负责病例资料收集,张骜、王金虎负责结果分析与讨论,张骜负责论文撰写;张骜、戴春娟、胡博负责全文知识性内容的审读与修正
| [1] |
Montalva L, Cheng LS, Kapur R, et al. Hirschsprung disease[J]. Nat Rev Dis Primers, 2023, 9(1): 54. DOI:10.1038/s41572-023-00465-y |
| [2] |
Moore SW. Total colonic aganglionosis and Hirschsprung's disease: a review[J]. Pediatr Surg Int, 2015, 31(1): 1-9. DOI:10.1007/s00383-014-3634-3 |
| [3] |
Pingault V, Zerad L, Bertani-Torres W, et al. SOX10:20 years of phenotypic plurality and current understanding of its developmental function[J]. J Med Genet, 2022, 59(2): 105-114. DOI:10.1136/jmedgenet-2021-108105 |
| [4] |
Diposarosa R, Bustam NA, Sahiratmadja E, et al. Literature review: enteric nervous system development, genetic and epigenetic regulation in the etiology of Hirschsprung's disease[J]. Heliyon, 2021, 7(6): e07308. DOI:10.1016/j.heliyon.2021.e07308 |
| [5] |
张彦, 夏慧敏. 先天性巨结肠的遗传发病机制及前瞻性队列研究进展[J]. 临床小儿外科杂志, 2018, 17(2): 90-93. Zhang Y, Xia HM. The genetic pathogenesis of congenital megacolon and progress in prospective cohort studies[J]. J Clin Ped Sur, 2018, 17(2): 90-93. DOI:10.3969/j.issn.1671-6353.2018.02.003 |
| [6] |
Butler Tjaden NE, Trainor PA. The developmental etiology and pathogenesis of Hirschsprung disease[J]. Transl Res, 2013, 162(1): 1-15. DOI:10.1016/j.trsl.2013.03.001 |
| [7] |
Bhattarai C, Poudel PP, Ghosh A, et al. Comparative role of SOX10 gene in the gliogenesis of central, peripheral, and enteric nervous systems[J]. Differentiation, 2022, 128: 13-25. DOI:10.1016/j.diff.2022.09.001 |
| [8] |
Qi JC, Ma L, Guo WW. Recent advances in the regulation mechanism of SOX10[J]. J Otol, 2022, 17(4): 247-252. DOI:10.1016/j.joto.2022.08.003 |
| [9] |
Sánchez-Mejías A, Watanabe YM, Fernández R, et al. Involvement of SOX10 in the pathogenesis of Hirschsprung disease: report of a truncating mutation in an isolated patient[J]. J Mol Med, 2010, 88(5): 507-514. DOI:10.1007/s00109-010-0592-7 |
| [10] |
Sangkhathat S, Kusafuka T, Chengkriwate P, et al. Mutations and polymorphisms of Hirschsprung disease candidate genes in Thai patients[J]. J Hum Genet, 2006, 51(12): 1126-1132. DOI:10.1007/s10038-006-0064-7 |
| [11] |
Touraine RL, Attié-Bitach T, Manceau E, et al. Neurological phenotype in Waardenburg syndrome type 4 correlates with novel SOX10 truncating mutations and expression in developing brain[J]. Am J Hum Genet, 2000, 66(5): 1496-1503. DOI:10.1086/302895 |
| [12] |
Viñuela A, Morín M, Villamar M, et al. Genetic and phenotypic heterogeneity in two novel cases of Waardenburg syndrome type Ⅳ[J]. Am J Med Genet A, 2009, 149A(10): 2296-2302. DOI:10.1002/ajmg.a.33026 |
| [13] |
Inoue K, Shilo K, Boerkoel CF, et al. Congenital hypomyelinating neuropathy, central dysmyelination, and Waardenburg-Hirschsprung disease: phenotypes linked by SOX10 mutation[J]. Ann Neurol, 2002, 52(6): 836-842. DOI:10.1002/ana.10404 |
| [14] |
Unzicker A, Pingault V, Meyer T, et al. A novel SOX10 mutation in a patient with PCWH who developed hypoxic-ischemic encephalopathy after E.coli sepsis[J]. Eur J Pediatr, 2011, 170(11): 1475-1480. DOI:10.1007/s00431-011-1539-x |
| [15] |
Lake JI, Heuckeroth RO. Enteric nervous system development: migration, differentiation, and disease[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305(1): G1-G24. DOI:10.1152/ajpgi.00452.2012 |
| [16] |
Cantrell VA, Owens SE, Chandler RL, et al. Interactions between Sox10 and EdnrB modulate penetrance and severity of aganglionosis in the Sox10Dom mouse model of Hirschsprung disease[J]. Hum Mol Genet, 2004, 13(19): 2289-2301. DOI:10.1093/hmg/ddh243 |
| [17] |
Ziegler MM, Royal RE, Brandt J, et al. Extended myectomy-myotomy.A therapeutic alternative for total intestinal aganglionosis[J]. Ann Surg, 1993, 218(4): 504-511. DOI:10.1097/00000658-199310000-00010 |
| [18] |
Alhellani H, Mottadelli G, Erculiani M, et al. Skipped aganglionic lengthening transposition (SALT) is highly effective to achieve enteral autonomy in selected patients with intestinal failure secondary to total intestinal aganglionosis[J]. Pediatr Surg Int, 2024, 40(1): 79. DOI:10.1007/s00383-024-05661-9 |
| [19] |
Kaufman SS, Avitzur Y, Beath SV, et al. New insights into the indications for intestinal transplantation: consensus in the year 2019[J]. Transplantation, 2020, 104(5): 937-946. DOI:10.1097/TP.0000000000003065 |
| [20] |
Alhawaj AF. Stem cell-based therapy for Hirschsprung disease, do we have the guts to treat?[J]. Gene Ther, 2022, 29(10/11): 578-587. DOI:10.1038/s41434-021-00268-4 |
 2025, Vol. 24
2025, Vol. 24


