Ⅰ型神经纤维瘤病(neurofibromatosis type 1, NF1)是一种罕见的常染色体显性遗传性疾病,发病率约1/3 000[1]。脊柱侧凸是NF1最常见的骨骼系统受累表现,10%~64%的NF1患者合并脊柱侧凸[2]。NF1脊柱侧凸约占所有脊柱侧凸患者的3%,可分为营养不良性脊柱侧凸和非营养不良性脊柱侧凸[3]。非营养不良性脊柱侧凸与特发性脊柱侧凸相似,营养不良性脊柱侧凸可出现椎体贝壳样改变、椎弓根变细、椎弓根间距增宽、肋骨铅笔样变等典型改变[4]。如未及时干预,侧凸畸形将迅速进展,多数发展成严重僵硬性脊柱侧凸,大大增加了治疗难度。由于患者受到营养不良性脊柱侧凸特征的影响,手术难度更大,更容易出现各类并发症,包括硬膜渗漏、融合失败、假关节形成、内固定置入失败、术后螺钉脱出或断棒,甚至在最终完成融合手术后发生侧凸畸形继续进展[5]。
NF1脊柱侧凸一般发病年龄小,患儿正处于生长发育的关键时期。大多数学者推荐应用生长棒技术治疗此类患儿,因其可以在矫正畸形的同时避免早期融合手术导致的脊柱和胸廓生长受限[6-7]。然而,当NF1脊柱侧凸的畸形表现为短而尖锐的侧凸、长节段僵硬性侧凸或者巨大后凸畸形时,行传统生长棒(traditional growing rods, TGRs)非融合手术可能导致较高的内固定相关并发症(instrumentation-related complications, IRCs)[8-9]。本研究旨在评估TGRs非融合手术治疗NF1脊柱侧凸的临床效果以及相关并发症发生情况。
资料与方法 一、临床资料本研究为回顾性研究,经首都医科大学附属北京儿童医院伦理委员会审核批准([2025]-E-068-R),患儿家属均知情同意。根据以下纳入及排除标准,选取2016年3月至2021年7月首都医科大学附属北京儿童医院骨科收治的31例NF1脊柱侧凸患儿作为研究对象。患儿均常规行X线、计算机断层扫描(computed tomography, CT)和核磁共振成像(magnetic resonance imaging, MRI)检查,均在神经电生理监测下行后路脊柱生长棒置入术,定期进行撑开手术及随访。
纳入标准: ①符合NF1临床诊断标准;②合并营养不良性脊柱侧后凸畸形;③接受TGRs手术治疗;④随访时间至少2年。排除标准: ①脊柱畸形仅累及颈椎;②随访期间撑开手术次数少于2次;③临床资料不完整。
二、研究方法 (一) TGRs手术麻醉成功后,留置神经监测针,手术过程中通过体感诱发电位和运动诱发电位监测脊髓功能,防止出现神经系统并发症。C型臂确认手术切口,沿脊柱中线切开皮肤及皮下组织,剥离竖脊肌,充分暴露近端及远端的脊柱解剖结构,包括椎板、关节突、横突、上下关节等,按照扩孔、攻丝和置入椎弓根螺钉的步骤,依次在近端和远端置入2~3组椎弓根螺钉,使用多米诺连接两根生长棒,通过肌层下方分别固定于椎弓根螺钉尾部,适当撑开后锁死螺钉及多米诺连接,缝合伤口,结束手术。间隔9~12个月进行一次撑开手术,直至畸形控制满意、不再继续进展或最终行融合手术。
(二) 收集资料收集患儿一般临床资料,术前、术后及末次随访时脊柱冠状位及矢状位影像学参数,记录术中及随访期间发生的并发症以及并发症类型和解决方案。
三、影像学评估及测量方法由两名经验丰富的骨科医师使用图片存档和通信系统对影像学参数进行测量和评估,取两次测量平均值,数值精确到0.1。
(三) 脊柱冠状面参数及定义1. Cobb角:是指过上端椎上终板和下端椎下终板的两条直线的夹角或其垂直线的夹角。
2. 第1~12胸椎高度(thoracic vertebra 1~12 height, TTH):第1胸椎椎体上终板中点与第12胸椎椎体下终板的垂直距离。
3. 第1胸椎至第1骶椎高度(thoracic vertebra 1~sacral vertebra 1 height, TSH):第1胸椎椎体上终板中点与第1骶椎椎体上终板的垂直距离。
4. 冠状面躯干偏移(trunk shift, TS):即第7颈椎铅垂线(cervical vertebra 7 plumb line, C7PL)与骶骨中垂线(center sacral vertical line, CSVL)的垂直距离。C7PL为经第7颈椎椎体中点垂直向下的直线;CSVL为经过第1骶椎上缘中点垂直于水平地面方向向上的直线。C7PL与CSVL的距离大于20 mm即为冠状面躯干偏移。
(三) 脊柱矢状面参数及定义1. 局部后凸角(local kyphosis, LK):过局部最大后凸上端椎上终板和下端椎下终板的两条直线的夹角或其垂直线的夹角。
2. 矢状面躯干偏移(sagittal vertebral axis, SVA):C7PL与第1骶椎后上角的垂直距离。SVA大于40 mm即为矢状面躯干偏移。
四、统计学处理应用SPSS 29.0 (IBM, Armonk, New York)和GraphPad Prism10.0(SEM, California)进行统计学分析及图像制作。计量资料使用Shapiro-Wilk法进行正态性检验,Levene法进行方差齐性检验,服从正态分布的计量资料采用x±s表示,术前与术后、术后与术后末次随访的组内比较均采用配对t检验。P < 0.05为差异具有统计学意义。
结果 一、基本情况本研究共纳入31例NF1营养不良性脊柱侧凸患儿,其中男性17例、女性14例。患儿均接受后路TGRs手术,首次手术年龄(6.8±2.4)岁,术中神经电生理监测均未发现异常信号。在(4.3±1.5)年(范围2~7年)的随访期间,经历了(4.2±1.5)次(范围2~7次)生长棒撑开手术,其中10例最终行脊柱融合内固定手术。31例患儿共行手术162次,6例出现IRCs 8例次,其中螺钉脱出4例、生长棒断裂3例、远端附加现象1例,经及时行内固定调整,均未影响后续研究结果。典型病例照片见图 1、图 2。
|
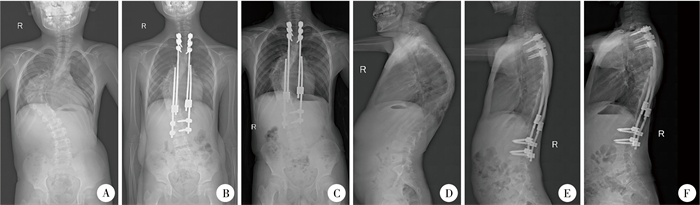
图 1 1例9岁Ⅰ型神经纤维瘤病脊柱侧凸患儿术前、术后及末次随访时影像学参数 Fig.1 Imaging parameters of a 9-year-old child with NF1 scoliosis before and after operation and at the last follow-up 注 患儿随访时间4年,共行撑开手术4次,末次随访时年龄14岁。A:术前Cobb角87.0°,TTH 17.5 cm,TSH 31.0 cm;B:术后Cobb角37.0°,TTH 21.3 cm,TSH 34.4 cm;C:末次随访时Cobb角38.0°,TTH 23.8 cm,TSH 37.7 cm;D:术前LK 76.0°;E:术后LK 31.0°;F:末次随访时LK 31.0° |
|
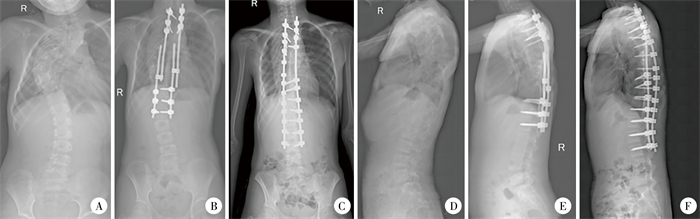
图 2 1例10岁Ⅰ型神经纤维瘤病脊柱侧凸患儿手术前后及末次随访时影像学参数 Fig.2 Imaging parameters of a 10-year-old child with NF1 scoliosis before and after operation and at the last follow-up 注 患儿随访3年,行撑开手术4次,末次随访时年龄15岁,最终行融合手术。A:术前Cobb角88.0°,第1至第12胸椎高度15.8 cm,第1胸椎至第1骶椎高度27.8 cm;B:术后Cobb角49.0°,第1至第12胸椎高度20.8 cm,第1胸椎至第1骶椎高度33.0 cm;C:末次随访时Cobb角14.0°,第1至第12胸椎高度23.4 cm,第1胸椎至第1骶椎高度38.8 cm;D:术前LK 51.0°;E:术后局部后凸角25.0°;F:末次随访时局部后凸角25.0° |
所有患儿经过生长棒撑开手术以及初步矫正,主弯Cobb角、TTH、TSH、TS、LK以及SVA较手术前均有明显改善,差异有统计学意义(P < 0.05),详见表 1。
| 表 1 31例Ⅰ型神经纤维瘤病脊柱侧凸患儿生长棒技术治疗效果(x±s) Table 1 Surgical efficacy of growing rods for 31 children with NF1 scoliosis(x±s) |
|
|
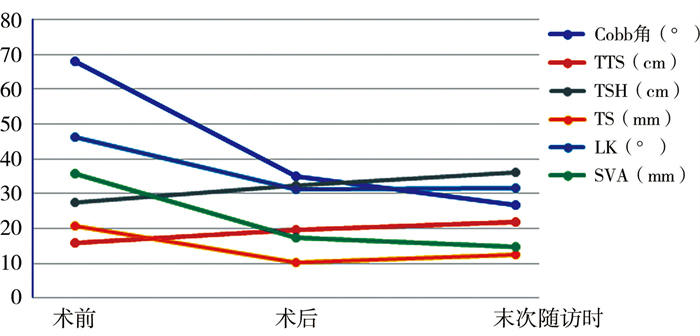
患儿均经过后续多次生长棒撑开手术,至末次随访时,主弯Cobb角较第一次手术后矫正约8.4°(P < 0.05),TTH增长约2.4 cm(P < 0.05),TSH增长约3.8 cm(P < 0.05)。LK维持与术后基本一致,未继续增长(P>0.05),躯干平衡保持在术后水平,末次随访时TS及SVA较术后无明显差异(P>0.05),详见表 2及图 3。
| 表 2 31例Ⅰ型神经纤维瘤病脊柱侧凸患儿术后及术后末次随访结果(x±s) Table 2 Final follow-up results of 31 children with NF1 scoliosis(x±s) |
|
|
|
图 3 31例Ⅰ型神经纤维瘤病脊柱侧凸患儿影像学变化趋势折线图 Fig.3 Changes of imaging results in 31 children with NF1 scoliosis 注 TTH:第1~12胸椎高度;TSH:第1胸椎至第1骶椎高度;TS:冠状面躯干偏移;LK:局部后凸角;SVA:矢状面躯干偏移 |
NF1营养不良性脊柱侧凸患者的特征性表现是椎体呈扇形、椎间孔扩大、椎弓根缺陷、肋骨铅笔征、顶椎旋转、椎旁肿块和硬膜扩张[10-11],这种类型的脊柱畸形不仅严重,而且发生早、进展快,保守治疗很难控制畸形的快速进展,治疗上具有一定的挑战性。短而僵硬的侧凸畸形和发育不良的骨骼系统增加了手术的难度和风险,导致IRCs频发[12]。生长棒和脊柱融合技术常用于治疗这种类型的脊柱畸形[7-8],对于小年龄儿童,长节段的脊柱融合手术会限制脊柱的生长,影响胸部和肺部的发育[13]。在处理儿童脊柱问题时,应优先保证脊柱和胸廓以及心肺功能的正常发育,这对于患儿的正常呼吸功能、整体健康成长以及减少潜在并发症都至关重要[14]。
TGRs技术是一种有效矫正脊柱畸形的治疗方式,通过定期撑开来矫正脊柱畸形,通过椎弓根螺钉和双侧生长棒系统维持脊柱平衡,使用脊柱非融合的治疗方式保持脊柱和胸廓生长潜力[15]。Jain等[8]对一个多中心早发性脊柱侧凸患者数据库的数据进行了分析,结果表明14例NF1脊柱侧凸患者进行了双侧生长棒置入手术,术前和术后末次随访时主弯Cobb角分别为74°和36°,矫正率为51%;脊柱平均生长39 mm(平均每年生长11.2 mm),内植入物相关并发症发生率约57%。在Vittoria等[16]的研究中,40例早发性脊柱侧凸患者进行了双侧生长棒置入手术,主弯Cobb角由78°矫正为45°,术前T1~T12高度为25 cm,末次随访时达37 cm,27例(67%)发生了不良事件。在Helenius等[17]的研究中,40例重度脊柱侧凸患者(术前Cobb角≥90°)接受了TGRs治疗,主弯Cobb角由102°矫正为56°,矫正率为44 %,T1~S1高度平均增加110 mm,35例(88%)至少出现一类并发症。在接受TGRs治疗的患者中,并发症如感染、神经功能障碍、交界处后凸、螺钉拔出和生长棒断裂较常见,其中生长棒断裂是最常见的并发症(28.9%),主要发生在胸腰椎交界附近的凸侧生长棒中[18]。也有研究表明,近端附加现象也是与生长棒技术相关的常见IRCs之一[5]。
笔者针对31例NF1脊柱侧凸患儿的研究得到了与上述研究相似的结果,术前及末次随访时主弯Cobb角分别为68°和26°,矫正率为62%,TTH由16 cm增长为22 cm(平均每年增长1.4 cm),TSH由27 cm增长为36 cm(平均每年增长2.0 cm),发生IRCs 8例(8/31,26%)。对比之前的研究,TGRs技术治疗NF1脊柱侧凸,主弯Cobb角可以得到很好的矫正,同时躯干偏移控制效果满意。本研究同时发现,随着TGRs技术的不断优化和医师治疗经验的增长,选择合适的生长棒置入节段以及撑开时间和长度,可以提高畸形矫正率。除了畸形得到了满意的矫正,患儿的生长发育能力也得到了最大的保留。儿童胸椎在青春期每年生长1.1 cm左右,胸廓生长在出生至8岁期间最为显著,这也是肺部发育的关键时期,在此期间,脊柱、胸腔和肺部相互作用,协同工作[19]。本研究结果也表明非融合TGRs技术可以使胸椎和脊柱正常生长,不会受到过度限制,除了保证患儿脊柱的正常生长,胸廓和肺部的正常发育也可以得到保证,患儿心肺功能可以满足后续多次手术的生理需要。
由于生长棒技术存在较高的并发症发生率,是否为NF1营养不良性脊柱侧凸的最佳治疗方式目前尚存在争议。相较于既往研究报道的极高并发症发生率,本研究并发症发生率仅26%,这提示非融合TGRs技术治疗此类患儿是一个不错的选择[8, 16-17]。笔者总结了一些减少并发症的经验,本研究发生螺钉拔出4例、生长棒断裂3例、远端附加现象1例。生长棒断裂为患儿意外摔倒后出现疼痛而就诊发现,及时手术更换生长棒,根据距离上次手术的时间以及患儿骨骼情况,决定是否更换系统或进行撑开,目的是尽可能减少额外的手术次数;螺钉拔出和远端附加现象均在患儿定期复查时发现,螺钉拔出的患儿在下一次撑开手术时进行螺钉的调整或更换即可,无需行计划外手术;远端附加现象需根据远端弯度的大小和对脊柱脊髓发育的影响以及患儿生长发育情况选择处理方式,如为轻度侧弯、患儿处于生长高峰期,可以考虑保守治疗、支具控制等,如维持效果好,可直至最终融合手术时一并处理;如畸形重、患儿已接近骨骼成熟、撑开手术已无空间,则可以于发现时直接行最终融合手术;本研究中的病例选择保守观察。总之,此类并发症需要根据患儿具体情况选择处理方式。附加现象发生的机制尚不明确,有研究表明当畸形存在3个以上的铅笔征肋骨或存在3个以上营养不良特征性表现时,临床进展是必然的[20]。根据本研究经验,建议对存在NF1相关畸形的患者在术前进行MRI检查,以评估硬膜扩张和丛状神经纤维瘤的范围,选择上下固定水平时应考虑硬膜扩张范围和营养不良的椎体结构。椎弓根螺钉的拔出和生长棒断裂是很难避免的并发症,尤其是畸形迅速进展为严重且僵硬的弯度时,螺钉和生长棒承受了更大的结构畸形之间的切割压力,增加了拔出和断裂的风险。更有甚者,畸形的严重程度已经导致术中生长棒置入困难甚至失败,使一期完成非融合生长棒置入手术成为一项艰巨的任务[21]。有假说认为,在手术过程中以及术后随访期间,降低内固定与脊柱之间的相互作用力可以有效避免IRCs的发生,术前牵引是一种有效的方式[22]。根据本研究经验,对于主弯Cobb角超过100°、存在70°以上的局部后凸畸形或极度营养不良、手术困难的NF1脊柱侧凸患儿,在术前可以尝试通过一定时间的牵引来改善部分畸形,缓慢牵拉以降低脊柱周围软组织的压力,缓解椎旁肿瘤对脊髓的压迫,改善营养状况,尽可能降低或减少僵硬结构对内固定系统的切割压力,以减少IRCs。此外,术后长期随访、选择合适的手术间隔时间和撑开范围,及时应对并发症也是整个长周期治疗的关键。根据本研究长期随访经验,建议生长棒置入手术后7~9个月进行第一次撑开手术,随后每间隔10~12个月进行再撑开手术;随访期间如出现IRCs,需及时更换内固定或作出适当调整;随着患儿年龄的增长,骨骼也随之发育,需更换更粗、更牢固的内固定系统,以避免内固定承受不了压力而发生断裂;治疗期间,对于同一患者反复出现IRCs 3次以上,建议行最终融合固定手术,以避免发生更多、更严重的并发症。
本研究存在一定的局限性。首先这是一项回顾性研究,因此存在潜在的选择和混杂偏倚。其次,单中心研究无法选择一个年龄匹配的队列来比较TRGs手术与早期融合手术治疗NF1营养不良性脊柱侧凸的结果。此外,TGRs技术的IRCs发生率可能被低估,因为并非所有患者都随访到最终融合。最后,本研究样本量较小,随访时间较短,这限制了结论的外推性。
总而言之,TGRs技术治疗小年龄NF1型营养不良性脊柱侧凸安全、有效,并发症发生率可控,可以在保留患儿脊柱及胸廓生长能力的同时,有效控制患儿脊柱畸形的进展。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 梁明倩负责文献检索;梁明倩、张学军、姚子明、曹隽负责调查设计;梁明倩、李海艟、郭东、白云松、祁新禹负责数据收集与分析;梁明倩、姚子明、曹隽负责论文结果撰写、讨论与分析
| [1] |
Farschtschi S, Mautner VF, McLean ACL, et al. The neurofibromatoses[J]. Dtsch Arztebl Int, 2020, 117(20): 354-360. DOI:10.3238/arztebl.2020.0354 |
| [2] |
Akbarnia BA, Gabriel KR, Beckman E, et al. Prevalence of scoliosis in neurofibromatosis[J]. Spine (Phila Pa 1976), 1992, 17(8 Suppl): S244-S248. DOI:10.1097/00007632-199208001-00005 |
| [3] |
Rezaian SM. The incidence of scoliosis due to neurofibromatosis[J]. Acta Orthop Scand, 1976, 47(5): 534-539. DOI:10.3109/17453677608988733 |
| [4] |
Pushpa BT, Rajasekaran S, Anand KSSV, et al. Anatomical changes in vertebra in dystrophic scoliosis due to neurofibromatosis and its implications on surgical safety[J]. Spine Deform, 2022, 10(1): 159-167. DOI:10.1007/s43390-021-00392-6 |
| [5] |
Yao ZM, Guo D, Li H, et al. Surgical treatment of dystrophic scoliosis in neurofibromatosis type 1:outcomes and complications[J]. Clin Spine Surg, 2019, 32(1): E50-E55. DOI:10.1097/bsd.0000000000000716 |
| [6] |
Bouthors C, Dukan R, Glorion C, et al. Outcomes of growing rods in a series of early-onset scoliosis patients with neurofibromatosis type 1[J]. J Neurosurg Spine, 2020, 33(3): 373-380. DOI:10.3171/2020.2.Spine191308 |
| [7] |
Tauchi R, Kawakami N, Castro MA, et al. Long-term surgical outcomes after early definitive spinal fusion for early-onset scoliosis with neurofibromatosis type 1 at mean follow-up of 14 years[J]. J Pediatr Orthop, 2020, 40(1): 42-47. DOI:10.1097/bpo.0000000000001090 |
| [8] |
Jain VV, Berry CA, Crawford AH, et al. Growing rods are an effective fusionless method of controlling early-onset scoliosis associated with neurofibromatosis type 1 (NF1): a multicenter retrospective case series[J]. J Pediatr Orthop, 2017, 37(8): e612-e618. DOI:10.1097/bpo.0000000000000963 |
| [9] |
Wilde PH, Upadhyay SS, Leong JC. Deterioration of operative co-rrection in dystrophic spinal neurofibromatosis[J]. Spine (Phila Pa 1976), 1994, 19(11): 1264-1270. DOI:10.1097/00007632-199405310-00013 |
| [10] |
Casselman ES, Mandell GA. Vertebral scalloping in neurofibromatosis[J]. Radiology, 1979, 131(1): 89-94. DOI:10.1148/131.1.89 |
| [11] |
DiSimone RE, Berman AT, Schwentker EP. The orthopedic manifestation of neurofibromatosis.A clinical experience and review of the literature[J]. Clin Orthop Relat Res, 1988, 230: 277-283. |
| [12] |
Neifert SN, Khan HA, Kurland DB, et al. Management and surgical outcomes of dystrophic scoliosis in neurofibromatosis type 1:a systematic review[J]. Neurosurg Focus, 2022, 52(5): E7. DOI:10.3171/2022.2.Focus21790 |
| [13] |
Ruiz G, Torres-Lugo NJ, Marrero-Ortiz P, et al. Early-onset scoliosis: a narrative review[J]. EFORT Open Rev, 2022, 7(8): 599-610. DOI:10.1530/eor-22-0040 |
| [14] |
Ahmad AA. Early onset scoliosis and current treatment methods[J]. J Clin Orthop Trauma, 2020, 11(2): 184-190. DOI:10.1016/j.jcot.2019.12.011 |
| [15] |
Harrington PR. Treatment of scoliosis.Correction and internal fixation by spine instrumentation[J]. J Bone Joint Surg Am, 1962, 44-A: 591-610. |
| [16] |
Vittoria F, Ceconi V, Fantina L, et al. Effectiveness and safety of a one-yearly elongation approach of growing rods in the treatment of early-onset scoliosis: a case series of 40 patients with definitive fusion[J]. Front Pediatr, 2022, 10: 895065. DOI:10.3389/fped.2022.895065 |
| [17] |
Helenius IJ, Sponseller PD, McClung A, et al. Surgical and hea-lth-related quality-of-life outcomes of growing rod "graduates" with severe versus moderate early-onset scoliosis[J]. Spine (Phila Pa 1976), 2019, 44(10): 698-706. DOI:10.1097/brs.0000000000002922 |
| [18] |
Yamaguchi KT, Jr, Skaggs DL, Mansour S, et al. Are rib versus spine anchors protective against breakage of growing rods?[J]. Spine Deform, 2014, 2(6): 489-492. DOI:10.1016/j.jspd.2014.08.007 |
| [19] |
Dimeglio A, Canavese F. The growing spine: how spinal deformities influence normal spine and thoracic cage growth[J]. Eur Spine J, 2012, 21(1): 64-70. DOI:10.1007/s00586-011-1983-3 |
| [20] |
Durrani AA, Crawford AH, Chouhdry SN, et al. Modulation of spinal deformities in patients with neurofibromatosis type 1[J]. Spine (Phila Pa 1976), 2000, 25(1): 69-75. DOI:10.1097/00007632-200001010-00013 |
| [21] |
Hasler CC. Early-onset scoliosis: contemporary decision-making and treatment options[J]. J Pediatr Orthop, 2018, 38(Suppl 1): S13-S20. DOI:10.1097/bpo.0000000000001184 |
| [22] |
Welborn MC, Krajbich JI, D'Amato C. Use of magnetic spinal growth rods (MCGR) with and without preoperative halo-gravity traction (HGT) for the treatment of severe early-onset scoliosis (EOS)[J]. J Pediatr Orthop, 2019, 39(4): e293-e297. DOI:10.1097/bpo.0000000000001282 |
 2025, Vol. 24
2025, Vol. 24


