2. 国家儿童医学中心 首都医科大学附属北京儿童医院 北京市儿科研究所出生缺陷遗传学研究室,北京 100045
2. Beijing Key Laboratory for Genetics of Birth Defects, Beijing Pediatric Research Institute, Beijing Children's Hospital, Capital Medical University, National Center for Children's Health, Beijing, Beijing 100045, China
Ⅰ型神经纤维瘤病(neurofibromatosis type 1, NF1)是一种常染色体显性遗传性疾病,发病率约1/3 000。其致病基因NF1位于17 q11.2,全长约350 kb,包含60个外显子[1-2]。NF1突变导致神经纤维瘤蛋白功能障碍,患者可出现皮肤牛奶咖啡斑、丛状神经纤维瘤、视路胶质瘤、骨骼系统受累等表现,其中骨骼系统以脊柱受累最常见,发生率达30%~60%[3-4]。
NF1脊柱侧凸多呈进行性发展,保守治疗效果较差[5]。对于小年龄患者,考虑到脊柱存在生长潜力,通常采用后路生长棒技术[6];对于年龄较大患者,通常选择后路脊柱矫正融合术来控制畸形进展[7]。由于NF1患者的脊柱畸形通常较为严重,手术治疗难度较大,术后内固定移位、断裂、松动,以及交界性后凸、远端附加现象等并发症的发生率可达50%以上[8-9]。
目前文献报道多集中在NF1患者的基因型分析,对于合并脊柱侧凸NF1患者的基因型特点关注不足。NF1作为一种典型的单基因遗传病,其基因突变类型与脊柱畸形严重程度之间是否存在相关性,同样缺乏深入研究[10-12]。此外,既往文献报道多关注NF1脊柱侧凸手术治疗效果及内固定相关并发症情况,对NF1脊柱侧凸的遗传学特点以及临床干预效果的综合性研究罕见报道[13-15]。
本研究通过分析首都医科大学附属北京儿童医院收治的临床诊断为营养不良性NF1脊柱侧凸患儿临床资料,采取外显子组测序(whole exome sequencing, WES)联合多重连接探针扩增技术(multiplex ligation-dependent probe amplification analysis, MLPA)以及全基因组测序技术(whole genome sequencing, WGS)对患儿进行基因检测,分析NF1脊柱侧凸患儿的遗传学特点,探究患儿基因型和脊柱畸形严重程度之间的潜在联系,同时总结早期手术控制脊柱畸形进展的临床干预效果。
资料与方法 一、研究对象本研究为回顾性研究,对2006年9月至2022年6月期间本院临床确诊为营养不良性NF1脊柱侧凸患儿临床资料进行分析。病例纳入标准:①临床及影像学资料完整;②符合NF1临床诊断标准[16];③监护人同意对患儿进行WES、MLPA以及WGS检测,并签署知情同意书。排除标准:①血样质量差,脱氧核糖核酸(deoxyribonucleic acid, DNA)降解严重,对WES、MLPA以及WGS测序结果产生影响;②合并先天性、神经肌肉性等其他类型脊柱畸形;③存在多系统疾病或一般情况较差,无法耐受手术,无法评估治疗效果;④临床及影像学资料不完整。本研究经首都医科大学附属北京儿童医院伦理委员会批准后实行(2022-E-083-R)。
NF1脊柱畸形的临床诊断标准:①存在6个或6个以上牛奶咖啡斑,青春期前最大直径在5 mm以上,青春期后最大直径在15 mm以上;②存在腋窝或腹股沟褐色雀斑;③存在2个或2个以上任一类型神经纤维瘤或1个丛状神经纤维瘤;④视路胶质瘤;⑤存在2个或2个以上虹膜Lisch结节,2个或2个以上脉络膜异常结节;⑥特征性骨病变,如蝶骨发育不良、胫骨前外侧弯曲或长骨假性关节病;⑦具有杂合致病性NF1突变,在白细胞等明显正常的组织中变异等位基因占50%以上。父母无NF1的患儿,符合上述标准2条或2条以上者可诊断为NF1;父母诊断为NF1的患儿,符合上述标准1条或1条以上者可诊断为NF1。当患儿满足NF1的临床诊断标准且合并脊柱畸形时,定义为NF1伴脊柱畸形。
二、研究方法 (一) 临床信息的采集通过本院病历及门诊系统,查阅并记录患儿的临床信息,包括姓名、性别、首次手术年龄、既往史以及NF1家族史情况。
体格检查时,除一般常规检查外,重点检查NF1相关体征,包括皮肤牛奶咖啡斑、皮肤及皮下神经纤维瘤、腋窝及腹股沟褐色雀斑、特征性骨病变、胸壁畸形、肺功能受限及中枢神经系统压迫症状。并检查患儿脊柱和四肢外观、肌力及活动度,有无肌肉萎缩或关节畸形。
(二) 影像学资料的采集及测量术前常规进行全脊柱站立位X线片、全脊柱电子计算机断层扫描(computed tomography, CT)及三维重建、全脊柱核磁共振检查。测量并记录患儿脊柱侧弯顶椎位置、脊柱畸形类型、冠状面主弯Cobb角、肩高度差、冠状面偏移、顶椎偏距以及矢状面偏移情况[17]。根据全脊柱CT图像,判断并记录营养不良性椎体改变数目以及有无肋骨头脱位、椎体旋转性半脱位。根据核磁共振检查结果判断有无椎管内畸形及椎旁丛状神经纤维瘤,记录肿瘤位置、形态以及肿瘤是否进入椎管。
(三) 基因检测方法首先通过WES对临床诊断为NF1脊柱畸形的患儿进行基因检测,分析单核苷酸变异(single nucleotide variants, SNVs)和插入/删失突变(insertion-deletions mutation, indels)情况。对于WES提示NF1基因外显子缺失和(或)重复的患儿,进一步通过MLPA进行鉴定,分析缺失/重复突变。对WES未提示NF1基因存在SNVs、indels、缺失/重复突变的患儿进行WGS检测。
1. WES:采集患儿外周血1~2 mL,使用Gentra Puregene blood Kit (QIAGEN, Hilden, Germany)从外周血中分离DNA(deoxyribonucleic acid)。使用SureSelect Human All Exon Kit(Agilent Technologies, Santa Clara, America)进行外显子捕获。根据美国医学遗传学与基因组学会和分子病理学协会(American College of Medical Genetics and Genomics and the Association for Molecular Pathology, ACMG/AMP)的解释标准和指南对基因突变进行分类。
2. MLPA:对于WES提示NF1基因外显子缺失和(或)重复的患儿,进一步通过MLPA进行鉴定。使用SALSA MLPA Probemix P081 NF1 mix 1与SALSA MLPA Probemix P082 NF1 mix 2(MHC Holland)进行NF1外显子捕获及扩增,ABI 3500基因分析仪(Thermo Scientific, USA)进行扩增产物电泳,电泳结果使用Coffalyser.Net(MHC Holland, Netherlands)分析。
3. WGS:对WES未提示NF1基因存在SNVs、indels、缺失/重复突变的患儿进行WGS检测。使用QIAamp Blood Mini Kit(Qiagen, Hilden, Germany)从外周血中提取全基因组DNA。在Illumina NovaSeq 6000平台上进行高通量测序,测序模式为PE 150 bp。本检测使用全基因组高通量测序检测技术,利用Verita Trekker变异位点检测系统和Enliven变异位点注释解读系统对数据进行分析。根据ACMG指南对潜在的有害变异进行解释和分类。
(四) 手术方法NF1脊柱侧弯的严重程度具有明显异质性。本研究根据患儿年龄、脊柱侧弯主弯范围及局部营养不良改变特征等因素,采取针对性手术治疗。对于年龄较小且侧凸范围较长的患儿采取后路生长棒技术治疗(为生长棒组);对于年龄较大或侧凸范围较短的患儿采用后路脊柱矫正融合术治疗(为后路脊柱融合组)。术中常规进行唤醒试验或神经电生理监测(全程监测躯体感觉诱发电位和经颅运动诱发电位)。记录患儿手术过程、手术方式、术中出血量、手术持续时间以及内固定相关并发症情况。对于局部侧凸较重、畸形僵硬的患儿,于脊柱手术前采取Halo头环牵引治疗,后行手术治疗。
(五) 统计学处理应用SPSS 26.0(SPSS Inc, Chicago, IL)对数据进行统计学分析。采用Shapiro-Wilk方法检验计量资料的正态性。计量资料服从正态分布时,以x±s表示,组间比较采用两独立样本t检验,组内比较采用配对t检验。对于不服从正态分布的计量资料则采用M(Q1, Q3)表示,组间比较采用秩和检验。计数资料采用频数、构成比表示,采用χ2检验或Fisher精确概率法进行组间比较。P<0.05为差异有统计学意义。
结果 一、NF1脊柱侧凸畸形患儿的临床特征本研究共纳入临床诊断为营养不良性NF1脊柱侧凸畸形患儿47例,其中男性23例、女性24例。初次手术年龄7.8(4.6, 9.9)岁,生长棒组初次手术年龄6.2(4.2, 8.6)岁,后路脊柱融合组初次手术年龄10.4(8.8, 12.7)岁。患儿的共同症状包括:皮肤牛奶咖啡斑、椎旁丛状神经纤维瘤以及不同程度脊柱侧凸,其中皮肤牛奶咖啡斑在出生时即已存在,而脊柱侧凸的出现年龄存在较大差异,发病年龄为5.2(3.0, 9.1)岁。患儿其他症状包括:丛状神经纤维瘤32例,肺功能受限5例,胸壁畸形2例,胸椎脊膜膨出、双下肢不等长、下肢瘫痪、纵隔肿物、脑室扩张合并脊髓空洞、胫骨畸形合并右肾发育不良、肾动脉狭窄继发肾性高血压各1例。有18例患儿存在NF1家族病史,其中11例基因突变来自父亲,7例基因突变来自母亲。
二、NF1脊柱侧凸患儿的遗传学特征47例均首先进行WES检测,共明确NF1基因外显子区域SNVs及indels突变36例,WES诊断率76.6%。对WES提示NF1基因存在缺失/重复突变的3例患儿进行MLPA检测,明确NF1基因外显子片段缺失2例(exon 15-16 del; exon 1-58 del),外显子重复突变1例(exon 13-16 dup)。
对于未发现NF1基因SNVs、indels及缺失/重复突变的7例进行WGS检测,发现NF1基因外显子区域突变3例(c.1660C>T/p.Gln554*;c.5749+332A>G; c.1738del/p.Tyr580Thrfs*6),内含子区域突变1例(c.5749+332A>G),未发现NF1基因突变3例。另有1例仅进行了WES检测(因外周血样本不足而未进行WGS检测),未发现NF1基因外显子区域突变。共明确NF1基因突变43例,整体基因诊断率为91.5%。
NF1脊柱畸形患儿的基因突变无明显突变热点,突变位点散在分布于NF1基因之中。NF1脊柱畸形患儿的突变类型包括NF1基因无义突变16例、移码突变13例、剪接位点突变9例、缺失/重复突变3例、错义突变2例。受累结构域包括CSRD结构域受累9例、GRD结构域受累7例、SEC14/PH结构域受累6例、CTD结构域受累3例和SBD结构域受累1例。
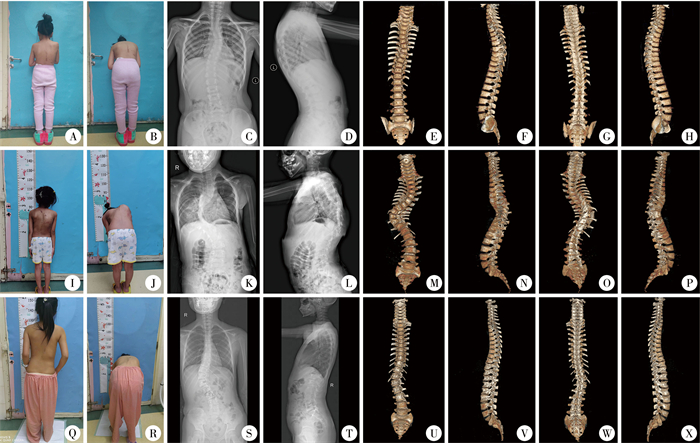
NF1脊柱畸形的表型异质性强,即NF1基因突变位点相同而临床表型存在差异。本组3例均为c.1017_1018delCT/p.Ser340fs*12移码突变,其临床表型存在差异,其中第1例为7岁女童,表现为脊柱中胸段侧凸畸形,主弯Cobb角为40°;第2例为6岁女童,表现为中胸椎僵硬性角状侧凸畸形,椎体及附件营养不良改变严重,主弯Cobb角为90°;第3例为10岁女童,表现为胸腰交界处侧凸畸形,主弯Cobb角为58°,局部存在椎体及附件营养不良改变(图 1)。2例为c.1318C>T/p.Arg440*无义突变,其临床表型存在差异。2例为c.4084C>T/p.Arg1362*无义突变,其临床表型同样存在较大的个体差异。此外,同一NF1家系内,家族成员之间的临床表型也存在明显差异。NF1脊柱畸形的表型异质性强,未发现基因型与脊柱畸形严重程度之间存在明显的相关性。
|
图 1 相同基因突变位点的神经纤维瘤病脊柱侧凸患儿临床表型存在明显个体差异 Fig.1 Marked inter-individual variability in scoliosis phenotypes occurs among children with identical NF1 mutations at the same locus 注 A~H: 7岁1个月女童,皮肤散在牛奶咖啡斑,生长发育可,5岁时发现双肩不等高及背部不平,表现为脊柱中胸段侧凸畸形,顶椎位于第6胸椎,主弯Cobb角为40°;I~P: 6岁2个月女童,皮肤大片牛奶咖啡斑,身材瘦弱,体力活动严重受限,2岁8个月时发现脊柱畸形,中胸椎僵硬性角状侧凸畸形,椎体及附件营养不良改变严重,顶椎位于第9胸椎,主弯Cobb角为90°;Q~X: 9岁11个月女童,皮肤散在牛奶咖啡斑,生长发育可,近8岁时发现脊柱畸形,胸腰交界处侧凸畸形,顶椎位于第1腰椎,主弯Cobb角为58°,局部存在椎体及附件营养不良改变。以上3例均为NF1基因移码突变(c.1017_1018delCT/p.Ser340fs*12),具有明显的临床表型异质性 |
首次手术方式包括生长棒技术30例,后路脊柱融合手术17例;初次手术年龄7.8(4.6, 9.9)岁。术前影像学检查中,患儿均为椎体及附件的营养不良性改变,畸形椎体数目4(3, 7)个。顶椎位置分布:37例位于胸椎,10例位于腰椎。手术时间200(90,700)min、术中出血量425(140,2 300)mL。
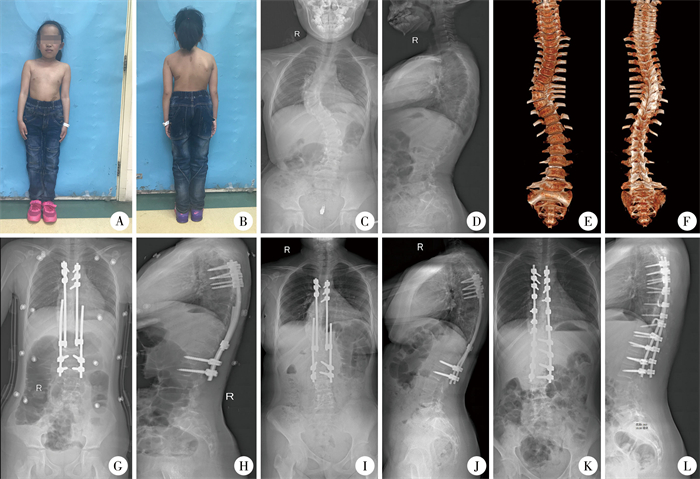
术后随访时间3.6(2.0, 6.3)年,术前及术后末次随访时,患儿主弯Cobb角分别为56.0(43.0, 65.0)°、17.0(8.0, 25.0)°, Z=-7.577, P<0.001;平均主弯矫正率为(68.6±17.5)%;肩高差分别为10.0(5.0, 16.0)mm、2.0(0.0, 5.0)mm,Z=-4.776,P<0.001;顶椎偏距分别为28.0 (21.0, 41.3)mm、12.5(9.0, 20.0)mm,Z=-5.377,P<0.001;冠状面偏移分别为16.7(9.8, 25.3)mm、10.0 (3.5, 17.3)mm,Z=-3.449,P<0.001;矢状面偏移分别为23.0(14.0, 41.3)mm、13.4(6.0, 20.0)mm,Z=-4.162,P<0.001;以上差异均有统计学意义(P<0.005)。手术治疗资料见图 2。
|
图 2 1例8岁7个月女性神经纤维瘤病脊柱侧凸患儿手术前后影像学资料 Fig.2 Pre-and post-operative images of a 103-month-old girl with NF1 scoliosis deformity 注 A~B:术前外观照,患儿皮肤散在牛奶咖啡斑,右肩略高于左肩,脊柱胸段向右侧凸出;C~F:术前影像学资料,站立位X线片显示患儿存在脊柱侧凸畸形,主弯顶椎为第8胸椎,主弯Cobb角为72°,无明显后凸畸形,脊柱高度为27.5 cm,胸椎高度为16.8 cm。CT重建显示第7~9胸椎椎体萎缩呈贝壳样变形,多发凹陷变形,椎体表面褶皱不光整;G~H:生长棒技术后即刻复查,脊柱侧凸程度矫正,主弯Cobb角为34.0°,术后即刻矫正率为52.8%,脊柱高度为32.0 cm,胸椎高度为20.0 cm,脊柱内固定器械未见变形或移位;I~J:生长棒技术后撑开3次再复查,脊柱侧凸主弯Cobb角为29.0°,脊柱高度为35.2 cm,胸椎高度为22.4 cm,脊柱内固定器械未见异常;K~L:终末脊柱融合术后复查,脊柱侧凸主弯Cobb角为8.0°,脊柱高度为36.8 cm,胸椎高度为23.8 cm,主弯矫正率为88.9%,无内固定器械相关并发症发生 |
9例(9/47,19.1%)出现内固定并发症,共计发生11次,包括生长棒断裂3次、近端附加现象2次、远端附加现象2次、螺栓移位2次、上方和下方固定椎螺钉移位拔出各1次。经后路脊柱翻修手术后,脊柱畸形控制效果良好。死亡1例,该患儿4岁时行生长棒技术治疗,术后定期撑开,12岁行后路脊柱矫正融合术,脊柱融合固定术后1年发现右侧腹膜后横纹肌肉瘤,未行手术治疗,1年后死亡。
讨论本研究主要结果包括:①NF1脊柱畸形患儿基因突变类型复杂多样,缺乏明确的基因突变热点,利用现有的基因检测技术无法明确全部基因突变位点;②NF1脊柱畸形存在明显的临床表型异质性,即使相同NF1基因突变位点的患儿,其脊柱畸形的临床表型也可存在明显的个体差异;③生长棒技术和后路脊柱融合手术安全有效,对于控制儿童期NF1脊柱侧凸畸形的病情进展具有良好效果,并发症可控。现基于以上研究结果,结合国内外近期发表的研究进行讨论。
一、NF1脊柱侧凸畸形患儿基因突变谱的特征NF1是一种单基因病(OMIM:162200),人类基因突变数据库记录的NF1基因突变位点已逾3 000种[18]。NF1基因包含60个外显子,新发突变率较高,且突变形式多样[19]。本研究发现NF1脊柱侧凸的基因突变几乎呈随机分布,突变位点可散在分布于整个基因之中,缺乏明确的基因突变热点。NF1基因突变类型复杂多样,可发生错义突变、无义突变、剪切位点突变、插入/缺失导致的移码突变及基因大片段缺失等异常[20]。NF1基因检测通常具有一定难度,利用现有基因检测技术,约10%的患者无法明确分子诊断[12]。
对于临床诊断NF1脊柱畸形的患儿,本研究的基因检测策略是:①完善外周血WES检测,可明确约76.6%(36/47)的突变位点;②对于考虑CNVs的患儿进行MLPA检测。WES和MLPA联合检测NF1基因的SNVs、indels和外显子缺失/重复,可覆盖NF1基因的大部分突变(39/47,83.0%);③对不能明确分子诊断的患儿采用WGS检测其NF1基因中的潜在突变位点,基因诊断率提高至91.5%(43/47)。
本研究中3例患儿WES未发现NF1基因外显子区域突变,后经WGS明确基因突变位点位于NF1外显子区域(c.1660C>T/p.Gln554*; c.5749+332A>G; c.1738del/p.Tyr580Thrfs*6),其WES漏检原因是SureSelect Human All Exon Kit (Agilent Technologies, Santa Clara, America)探针不覆盖上述位点。对于WES联合WGS未发现NF1基因突变的4例患儿,其致病NF1基因突变可能发生于体细胞,因此可以解释通过对外周血行WES联合WGS基因检测未能明确诊断的原因[21]。
二、NF1脊柱侧凸畸形的表型异质性明显,基因型及表型缺乏广泛联系Sabbagh等[22]对275个家庭的750例NF1患者进行研究,结果显示随着亲缘关系的减少,患者间的临床表型相似性相应降低。另一项关于8对NF1同卵双胞胎的研究揭示了即使在基因完全相同的个体之间,NF1基因启动子的差异也可能导致患者出现不同的临床表型[23]。本研究同样发现NF1脊柱畸形患儿的基因型及临床表型缺乏明显的相关性,存在明显的临床表型异质性;同一家系之间,不同家系携带相同突变的患者之间,以及突变完全相同的双胞胎之间,均可表现出明显的临床表型差异。
NF1基因型及临床表型缺乏广泛联系,造成表型差异较大的原因可能与种族背景、修饰基因(包括蛋白质编码序列、microRNA和长片段非编码RNA基因等)、环境因素、表观遗传变化(DNA甲基化或组蛋白修饰)等多种因素有关。此外,由于NF1的疾病外显率随年龄增长而逐渐出现,因此年龄也是基因型-表型相关性研究中需要考虑的混杂因素。此外,二次打击理论在NF1患者的表型决定方面存在着重要影响,即在NF1的发病中,胚系突变为第一次打击,体细胞中发生突变为第二次打击。二次打击理论可解释部分具有相同胚系基因突变的个体其临床表型出现显著差异的原因[24]。
三、NF1脊柱侧凸畸形的手术难点及治疗效果NF1脊柱侧凸的畸形进展速度较快,脊柱矫形支具及脊柱石膏等保守治疗效果欠佳,多需进行早期手术干预。NF1脊柱侧凸手术治疗难度较大,主要包括以下原因:首先,NF1突变造成的脊柱畸形通常较为严重,且需要在小年龄进行手术治疗[25]。而该年龄阶段小儿脊柱成熟度通常较低,解剖变异复杂,椎弓根细小变形,导致精准置钉的难度大幅上升。患儿可能存在椎管内或椎管周围的神经纤维瘤,加上严重的血管变异、椎间孔增宽及硬膜囊扩张等,术中出血量往往较多,且术中容易造成脑脊液漏,甚至脊髓损伤[26-27]。其次,NF1突变导致神经纤维瘤蛋白缺乏、骨骼矿化障碍及骨骼强度降低,造成局部内固定器械的把持力不足。同时,NF1突变导致成骨细胞功能降低,患者常伴有骨质疏松和骨量减少,因而导致植骨融合的效果大幅下降,以致内固定相关并发症的发生率升高[28]。此外,NF1突变可导致全身多个器官受累,患者营养状态通常较差,且可能存在颅内肿瘤、颅内血管畸形、肾性高血压、心肺功能障碍、神经管畸形、椎管内占位、椎间孔内肿瘤、癫痫等影响手术安全的合并症,因而增加了手术难度及风险程度[29-30]。
NF1脊柱畸形手术后内固定相关并发症的发生率较高,主要包括内固定移位、断裂、松动,以及交界性后凸、远端附加现象、术后矫正角度丢失等,严重时需要进行翻修手术。Yao等[28]报道NF1脊柱畸形手术后内固定相关并发症的发生率为28.8%,患儿年龄 < 9岁、后凸≥50°、采用生长棒技术治疗时,内固定相关并发症发生率升高;后凸≥50°(OR=8.23, P=0.025)和采用生长棒技术治疗(OR=8.75, P=0.032)是发生内固定相关并发症的独立危险因素。当脊柱畸形存在明显后凸时,脊柱融合手术效果明显下降,内固定并发症的发生风险明显升高。其可能原因是后凸顶点的椎体通常存在严重营养不良性改变,局部压力负荷较大。后凸顶点在术后仍然承受着巨大的压力,可导致内固定断裂。NF1后凸畸形的前路支撑不足也增加了后凸区域的内固定压力负荷,导致内固定并发症发生率升高。年龄<9岁的NF1脊柱畸形患儿发生内固定相关并发症的风险较高,可能与较多撑开次数以及植入生长棒系统直径较小有关。目前近端/远端附加现象的发生机制仍不完全清楚,可能与患儿脊柱快速生长及椎旁神经纤维瘤侵袭有关[26]。对于内固定并发症危险因素的早期识别,有助于术前对NF1脊柱畸形患儿进行风险分层,预判手术治疗效果。
生长棒技术及后路脊柱融合手术对于NF1脊柱侧凸有一定的矫形作用,应综合考虑患儿年龄、脊柱发育情况及畸形严重程度,选择合适的手术方式。NF1突变导致神经纤维瘤蛋白丧失、脊柱强度降低,患儿脊柱畸形通常进展较快,因此可以适当放宽脊柱融合手术指征,对于生长棒技术后反复出现内固定并发症的患儿也可考虑提早进行融合手术[6, 31]。在NF1脊柱侧凸矫形手术中,合理的融合范围、足够的内固定密度以及植骨材料,对脊柱获得稳定具有重要作用。术中可适当延长脊柱融合范围,并采用较高的内固定密度,以期获得更好的矫形效果[32]。由于NF1患儿常伴骨质疏松和骨量减少,因此自体植骨材料往往不足,异种骨或人工骨也可适当用于术中植骨,以进一步提高脊柱融合率。此外,人工骨材料、神经监测技术和导航技术的飞速发展,将有助于进一步降低NF1脊柱畸形患儿内固定相关并发症的发生率。
四、研究不足及展望本研究仍存在一定的局限性。第一,本研究有4例未能明确基因诊断,后续将进行RNA seq及蛋白水平的检测,以期发现非编码区变异或挖掘新的候选致病基因;第二,NF1脊柱畸形存在明显临床表型异质性的原因尚不清楚,推测与就诊年龄、基因型、环境、表观遗传等因素的共同作用有关,其潜在分子机制有待进一步挖掘。最后,本研究为单中心回顾性研究,手术例数较少,且部分患儿随访时间较短,以上不足将在未来的研究中进一步完善。
综上所述,NF1脊柱畸形患儿的基因突变类型复杂多样,缺乏基因突变热点,且存在明显的表型异质性。生长棒技术和后路脊柱融合手术可有效控制NF1脊柱侧凸畸形,防止病情持续进展。对于NF1脊柱畸形遗传学及手术治疗的深入研究,有望进一步提高该病的基因诊断率,为临床判断预后、开展遗传咨询、选择合理手术方式提供更多依据。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 郝婵娟、郭若兰和张文妍负责基因测序及结果解读,姚子明负责论文设计,刘昊楠和高荣轩负责数据收集,李海艟负责论文撰写、研究结果分析与讨论,张学军、郭东和曹隽负责全文知识性内容的审读与修正
| [1] |
Cimino PJ, Gutmann DH. Neurofibromatosis type 1[J]. Handb Clin Neurol, 2018, 148: 799-811. DOI:10.1016/B978-0-444-64076-5.00051-X |
| [2] |
Bianchessi D, Ibba MC, Saletti V, et al. Simultaneous detection of NF1, SPRED1, LZTR1, and NF2 gene mutations by targeted NGS in an Italian cohort of suspected NF1 patients[J]. Genes (Basel), 2020, 11(6): 671. DOI:10.3390/genes11060671 |
| [3] |
Akbarnia BA, Gabriel KR, Beckman E, et al. Prevalence of scoliosis in neurofibromatosis[J]. Spine (Phila Pa 1976), 1992, 17(8 Suppl): S244-S248. DOI:10.1097/00007632-199208001-00005 |
| [4] |
Gutmann DH, Ferner RE, Listernick RH, et al. Neurofibromatosis type 1[J]. Nat Rev Dis Primers, 2017, 3: 17004. DOI:10.1038/nrdp.2017.4 |
| [5] |
Calvert PT, Edgar MA, Webb PJ. Scoliosis in neurofibromatosis.The natural history with and without operation[J]. J Bone Joint Surg Br, 1989, 71(2): 246-251. DOI:10.1302/0301-620X.71B2.2494186 |
| [6] |
Yao ZM, Guo D, Li H, et al. Surgical treatment of dystrophic scoliosis in neurofibromatosis type 1:outcomes and complications[J]. Clin Spine Surg, 2019, 32(1): E50-E55. DOI:10.1097/BSD.0000000000000716 |
| [7] |
Wang ZY, Fu CF, Leng JL, et al. Treatment of dystrophic scoliosis in neurofibromatosis type 1 with one-stage posterior pedicle screw technique[J]. Spine J, 2015, 15(4): 587-595. DOI:10.1016/j.spinee.2014.10.014 |
| [8] |
Bouthors C, Dukan R, Glorion C, et al. Outcomes of growing rods in a series of early-onset scoliosis patients with neurofibromatosis type 1[J]. J Neurosurg Spine, 2020, 33(3): 373-380. DOI:10.3171/2020.2.SPINE191308 |
| [9] |
Carbone M, Vittoria F, Del Sal A. Treatment of early-onset scoliosis with growing rods in patients with neurofibromatosis-1[J]. J Pediatr Orthop B, 2019, 28(3): 278-287. DOI:10.1097/BPB.0000000000000627 |
| [10] |
Wu-Chou YH, Hung TC, Lin YT, et al. Genetic diagnosis of neurofibromatosis type 1:targeted next-generation sequencing with Multiple Ligation-Dependent Probe Amplification analysis[J]. J Biomed Sci, 2018, 25(1): 72. DOI:10.1186/s12929-018-0474-9 |
| [11] |
Jett K, Friedman JM. Clinical and genetic aspects of neurofibromatosis 1[J]. Genet Med, 2010, 12(1): 1-11. DOI:10.1097/GIM.0b013e3181bf15e3 |
| [12] |
Kehrer-Sawatzki H, Cooper DN. Challenges in the diagnosis of neurofibromatosis type 1 (NF1) in young children facilitated by means of revised diagnostic criteria including genetic testing for pathogenic NF1 gene variants[J]. Hum Genet, 2022, 141(2): 177-191. DOI:10.1007/s00439-021-02410-z |
| [13] |
Deng A, Zhang HQ, Tang MX, et al. Posterior-only surgical correction of dystrophic scoliosis in 31 patients with neurofibromatosis type 1 using the multiple anchor point method[J]. J Neurosurg Pediatr, 2017, 19(1): 96-101. DOI:10.3171/2016.7.PEDS16125 |
| [14] |
Jain VV, Berry CA, Crawford AH, et al. Growing rods are an effective fusionless method of controlling early-onset scoliosis associated with neurofibromatosis type 1 (NF1): a multicenter retrospective case series[J]. J Pediatr Orthop, 2017, 37(8): e612-e618. DOI:10.1097/BPO.0000000000000963 |
| [15] |
Tauchi R, Kawakami N, Castro MA, et al. Long-term surgical outcomes after early definitive spinal fusion for early-onset scoliosis with neurofibromatosis type 1 at mean follow-up of 14 years[J]. J Pediatr Orthop, 2020, 40(1): 42-47. DOI:10.1097/BPO.0000000000001090 |
| [16] |
Legius E, Messiaen L, Wolkenstein P, et al. Revised diagnostic criteria for neurofibromatosis type 1 and Legius syndrome: an international consensus recommendation[J]. Genet Med, 2021, 23(8): 1506-1513. DOI:10.1038/s41436-021-01170-5 |
| [17] |
Langensiepen S, Semler O, Sobottke R, et al. Measuring procedures to determine the Cobb angle in idiopathic scoliosis: a systematic review[J]. Eur Spine J, 2013, 22(11): 2360-2371. DOI:10.1007/s00586-013-2693-9 |
| [18] |
Bettegowda C, Upadhayaya M, Evans DG, et al. Genotype-phenotype correlations in neurofibromatosis and their potential clinical use[J]. Neurology, 2021, 97. DOI:10.1212/WNL.0000000000012436 |
| [19] |
Pan Y, Hysinger JD, Barron T, et al. NF1 mutation drives neuronal activity-dependent initiation of optic glioma[J]. Nature, 2021, 594(7862): 277-282. DOI:10.1038/s41586-021-03580-6 |
| [20] |
van Minkelen R, van Bever Y, Kromosoeto JNR, et al. A clinical and genetic overview of 18 years neurofibromatosis type 1 molecular diagnostics in the Netherlands[J]. Clin Genet, 2014, 85(4): 318-327. DOI:10.1111/cge.12187 |
| [21] |
Ejerskov C, Raundahl M, Gregersen PA, et al. Clinical features and disease severity in patients with mosaic neurofibromatosis type 1:a single-center study and literature review[J]. Orphanet J Rare Dis, 2021, 16(1): 180. DOI:10.1186/s13023-021-01796-3 |
| [22] |
Sabbagh A, Pasmant E, Laurendeau I, et al. Unravelling the genetic basis of variable clinical expression in neurofibromatosis 1[J]. Hum Mol Genet, 2009, 18(15): 2768-2778. DOI:10.1093/hmg/ddp212 |
| [23] |
Harder A, Titze S, Herbst L, et al. Monozygotic twins with neurofibromatosis type 1 (NF1) display differences in methylation of NF1 gene promoter elements, 5' untranslated region, exon and intron 1[J]. Twin Res Hum Genet, 2010, 13(6): 582-594. DOI:10.1375/twin.13.6.582 |
| [24] |
Zhu LD, Zhang YF, Tong HX, et al. Clinical and molecular characterization of NF1 patients: single-center experience of 32 patients from China[J]. Medicine (Baltimore), 2016, 95(10): e3043. DOI:10.1097/MD.0000000000003043 |
| [25] |
郭东, 姚子明, 高荣轩, 等. 生长棒与早期融合手术治疗早发性Ⅰ型神经纤维瘤病脊柱侧凸的对照研究[J]. 中华骨与关节外科杂志, 2020, 13(8): 624-629. Guo D, Yao ZM, Gao RX, et al. et al comparative research between growing rod and early spinal fusion surgery for early-onset scoliosis in patients with type 1 neurofibromatosis[J]. Chin JBone Joint Surg, 2020, 13(8): 624-629. DOI:10.3969/j.issn.2095-9958.2020.08.02 |
| [26] |
Sial M, George KJ. A review of spinal lesions in neurofibromatosis type 1 in a large neurofibromatosis type 1 center[J]. World Neurosurg, 2023, 169: e157-e163. DOI:10.1016/j.wneu.2022.10.100 |
| [27] |
Toll BJ, Samdani AF, Janjua MB, et al. Perioperative complications and risk factors in neuromuscular scoliosis surgery[J]. J Neurosurg Pediatr, 2018, 22(2): 207-213. DOI:10.3171/2018.2.PEDS17724 |
| [28] |
Yao ZM, Li H, Zhang XJ, et al. Incidence and risk factors for instrumentation-related complications after scoliosis surgery in pediatric patients with NF-1[J]. Spine (Phila Pa 1976), 2018, 43(24): 1719-1724. DOI:10.1097/BRS.0000000000002720 |
| [29] |
Tritz R, Hudson FZ, Harris V, et al. MEK inhibition exerts temporal and myeloid cell-specific effects in the pathogenesis of neurofibromatosis type 1 arteriopathy[J]. Sci Rep, 2021, 11(1): 24345. DOI:10.1038/s41598-021-03750-6 |
| [30] |
Well L, Careddu A, Stark M, et al. Phenotyping spinal abnormalities in patients with Neurofibromatosis type 1 using whole-body MRI[J]. Sci Rep, 2021, 11(1): 16889. DOI:10.1038/s41598-021-96310-x |
| [31] |
Mladenov KV, Spiro AS, Krajewski KL, et al. Management of spinal deformities and tibial pseudarthrosis in children with neurofibromatosis type 1 (NF-1)[J]. Childs Nerv Syst, 2020, 36(10): 2409-2425. DOI:10.1007/s00381-020-04775-4 |
| [32] |
Li Y, Yuan XX, Sha SF, et al. Effect of higher implant density on curve correction in dystrophic thoracic scoliosis secondary to neurofibromatosis type 1[J]. J Neurosurg Pediatr, 2017, 20(4): 371-377. DOI:10.3171/2017.4.PEDS171 |
 2025, Vol. 24
2025, Vol. 24


