门静脉血栓(portal vein thrombosis, PVT)涉及肝内门静脉、门静脉主干、肠系膜静脉和脾静脉,以门静脉主干血栓形成为主,常与肠系膜静脉血栓同时发生[1]。根据病程时间(以60 d为标准),PVT可分为急性和慢性[2];亦可根据影像学上是否出现侧支循环和门静脉高压征象(即脾肿大和食管静脉曲张)判断急慢性PVT。急性PVT往往因肠系膜静脉血液瘀滞而导致肠道血运障碍,引发以腹痛为主的临床症状,如不及时诊治将危及生命,病死率达20% ~50%[3]。慢性PVT常导致门静脉海绵样变,后者是肝外门静脉梗阻(extra-hepatic portal venous obstruction, EHPVO)的重要表现[4]。从门静脉血栓形成到门静脉海绵样变是一个缓慢过程,门静脉血栓形成到超声检测到门静脉海绵样变需6~21 d[5]。急性PVT常首选药物治疗,包括抗凝治疗和溶栓治疗。但当前针对儿童PVT的药物选择、治疗持续时间和药效监测仍然存在争议[1]。本文报道2例采用肝素联合尿激酶溶栓治疗的儿童急性PVT病例,为临床治疗该病提供借鉴。
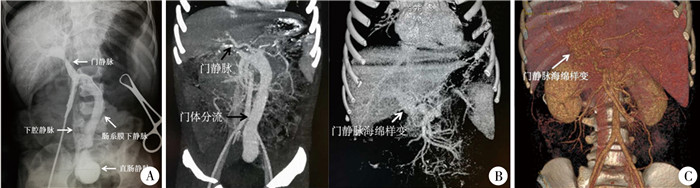
病例1,男,2岁,体重15 kg。因Abernethy畸形行门体异常分流部分结扎术后3个月入院。入院后患儿接受门体异常分流血管完全结扎术治疗。术中门静脉造影显示门静脉血液经肠系膜下静脉汇入髂静脉,最终流入下腔静脉(图 1A)。手术将肠系膜下静脉近盆腔侧完全结扎,结扎后门静脉压力由术前12 cmH2O(1 cmH2O=0.098kPa)升高至18 cm H2O,符合完全结扎门体异常分流的手术指征[6]。术后常规采用肝素预防性抗凝治疗,剂量为10 U·kg-1·h-1。术后3 d常规行门静脉系统超声和腹部增强CT检查,结果显示门静脉主干至肠系膜上静脉根部及肠系膜下静脉血栓形成。患儿无腹痛、便血和呕吐等症状。凝血功能检查提示:凝血酶原时间(prothrombin time, PT) 为13.0 s,活化部分凝血活酶时间(activated partial thromboplastin, APTT) 30.4 s,D-二聚体2 586 ug/L,纤原降解产物12.30 ug/mL。诊断为急性PVT。治疗上,为了达到治疗性抗凝水平(APTT值60~85 s),首先调整肝素剂量至20 U·kg-1·h-1,然后根据APTT值,调整肝素剂量使其达到治疗性抗凝水平,并保持治疗性抗凝水平18 d[7]。予尿激酶每小时5万U静脉滴注,每日滴注2 h,连续3 d。3 d后超声检查显示门静脉血栓无明显减小,将尿激酶增加至每小时5万U静脉滴注,每日滴注4 h,连续4 d。复查超声显示门静脉血栓较前缩小。继续按上述方案治疗11 d后(术后第13天),CT显示门静脉主干血栓较前明显减小,可见入肝血流,门静脉海绵样变形成(图 1B)。患儿术后第21天出院,出院后继续口服阿司匹林和双嘧达莫抗凝治疗6个月。随访4年,无呕血、黑便等上消化道出血表现,超声和CT显示门静脉部分再通,门静脉海绵样变和脾肿大(图 1C)。
|
图 1 急性门静脉血栓病例1术中及术后影像学资料 Fig.1 Intra/post-operative imaging data of case No.1 注 A:术中门静脉造影显示肠系膜下静脉和直肠静脉明显扩张,造影剂汇入下腔静脉; B:腹部增强CT照片,左侧为术前,显示门静脉通畅;右侧为术后13 d,显示门静脉海绵样变; C:术后4年腹部增强CT显示门静脉部分再通,门静脉海绵样变 |
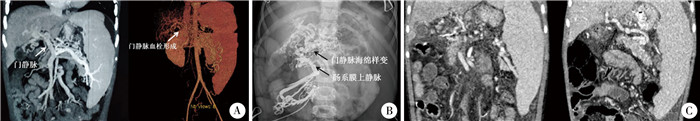
病例2,男,7岁,体重21 kg。因门静脉高压Rex术后1年出现间断呕血、黑便2次入院。患儿1年前因门静脉海绵样变接受Rex手术,即肠系膜下静脉- 门静脉左支分流术。入院后血常规显示:红细胞3.03×1012/L,血小板59×109/L,血红蛋白74 g/L。CT显示桥静脉不清晰(图 2A左)。诊断为Rex术后分流血管闭塞、上消化道出血。予止血、输血等保守治疗3 d后,腹部超声显示:桥静脉闭塞,肠系膜上静脉近端部分血栓形成。此时患儿上消化道出血症状仍然存在,继续予止血治疗。保守治疗7 d后,出血明显改善,但突发腹部疼痛,且逐渐加重,腹胀明显,腹腔穿刺抽出血性液体,无便血。复查超声显示,桥静脉内充满低回声影,无血流通过;肠系膜静脉管腔内见中低回声影, 管腔边缘见纤细血流通过,肠系膜静脉内血栓形成、管腔不完全梗阻;脾静脉与肠系膜上静脉汇合处管腔内透声差,不排除血栓形成。凝血功能:PT 14.1 s,APTT 27.9 s,D二聚体17 700 ug/L,纤维蛋白原降解产物54.36 ug/mL。诊断为急性PVT。经权衡利弊,在上消化道出血基本稳定的情况下,给予抗凝和溶栓治疗。首先停用止血药物,给予肝素抗凝治疗(20 U·kg-1·h-1),但1 d后,患儿腹痛无明显缓解,超声显示肠系膜上静脉血栓无改善,腹腔积液明显。遂行介入下门静脉造影,结果显示肠系膜上静脉回流欠佳,管腔细,但取栓困难,经导管推注3万U尿激酶后,肠系膜上静脉及其分支静脉较前显影改善。介入术后继续予肝素抗凝治疗,调整肝素剂量使APTT达60~85 s的治疗性抗凝水平,连续21 d,直至第二次Rex手术。介入术后患儿腹痛症状较前改善,但术后2 d仍偶诉腹痛,遂应用尿激酶溶栓治疗,首次使用2万U/h,每天静脉输注4 h;最后增加至6万U/h,每天静脉滴注4 h,患儿未再诉腹痛;尿激酶溶栓治疗持续7 d。介入术后10 d复查超声和CT,显示肠系膜上静脉血流较前改善,门静脉周围形成侧支循环(图 2A右)。因Rex手术的桥静脉闭塞,介入术后21 d患儿接受再次分流手术,术中门静脉造影显示门静脉海绵样变、肠系膜上静脉血栓消失(图 2B),探查原分流血管,见其已闭塞,遂行第二次Rex手术。术后随访2个月,未再出现呕血、黑便等上消化道出血现象,CT和超声显示Rex分流血管通畅,肝内门静脉显影较前改善(图 2C)。
|
图 2 急性门静脉血栓病例2术前、术中及术后影像学资料 Fig.2 Perioperative imaging data of case No.2 注 A:左侧为入院前CT,显示门静脉正常,但桥静脉未显示;右侧为介入治疗后10 d,门静脉血栓形成后门静脉周围形成侧支循环; B:术中门静脉造影显示门静脉海绵样变,肠系膜上静脉通畅; C左侧为二次Rex术前,显示门静脉海绵样变,肝内门静脉显影不良;右侧为二次Rex术后,显示分流血管通畅,肝内门静脉显影明显 |
肠坏死是急性PVT的最大风险,是造成死亡的重要原因[8]。既往急性PVT的死亡率达20% ~50%,但文献报道早期诊断和早期应用抗凝治疗者5年生存率升至85%[9-10]。B超和CT是发现门静脉系统血栓形成的重要手段。研究发现,彩色多普勒超声诊断门静脉系统血栓的灵敏度为89%、特异度为92%[11]。进一步诊断可通过MR血管成像检查获得,在不具备MR血管成像条件下可以选择增强CT,其对于门静脉血栓的检测具有较高的灵敏度和特异度[12]。如以上检查仍不能满足诊断要求,可以行门静脉系统血管造影。本组两例患儿均首次采用腹部超声明确诊断,进一步采用腹部增强CT明确血栓部位和程度。对于怀疑急性PVT者应首选超声检查明确诊断,该方法简便、无创,是急诊检查的首选方法。
急性PVT的治疗目的是防治并发症(如肠坏死)和血栓进一步发展。治疗方法包括药物治疗和外科干预,以药物治疗为首选治疗方法[1]。药物治疗可分为抗凝治疗和溶栓治疗。当前对于急性PVT的治疗大多根据临床医师经验决定,缺乏随机对照研究证据支持。文献报道约83.3%的急性PVT患者因未行抗凝治疗而导致血管不能再通,约16.7%的血管再通发生在自限性疾病患者中[13]。因此,早期抗凝治疗被推荐作为治疗急性PVT的重要方法之一。静脉用肝素和低分子肝素是两个主要的抗凝药物。至今关于抗凝药物治疗的持续时间尚无定论,但采用肝素抗凝治疗2~3周被推荐[1]。
本组2例患儿肝素抗凝治疗时间分别为18 d和21 d,与上述推荐相符。通过早期抗凝治疗,约35%的门静脉血栓可以再通[10]。溶栓治疗亦可以显著改善门静脉血栓,包括血管介入下直接溶栓和外周输入溶栓药物的间接溶栓方法。重组纤溶酶原激活剂、尿激酶和链激酶是当前主要的溶栓药物。有文献报道46例门静脉系统血栓患者采用介入下直接溶栓治疗,34例血栓完全或部分消失[14]。但出血是溶栓治疗的严重并发症。因此,溶栓治疗被推荐应用于存在严重疾病的患者,包括抗凝治疗失败的患者[1]。本组两例患儿均存在门静脉系统血栓,若不及时治疗将危及生命,因此采用尿激酶溶栓,特别是病例2存在肠系膜栓塞引发肠管坏死的风险,虽采用了介入下溶栓治疗,但并未完全缓解,因此继续采用尿激酶治疗7 d。
对于药物治疗无效的患者,应予手术取出血栓,其中介入手术是当前常用的方法。尽管介入手术存在血管损伤和促进血栓复发的风险,但对于新形成的血栓(30 d以内)具有快速去除血栓的优势[15]。另外,介入下采用尿激酶局部溶栓、球囊扩张和放置支架也有助于降低血栓复发的风险[16]。血栓切除术在儿童中应用极为罕见[7]。急性PVT通过以上治疗,通常能度过引发肠坏死的危险期,部分门静脉不能再通者发展为门静脉海绵样变,若出现上消化道出血等门静脉高压症状需手术治疗,Rex手术是最有效的手术方法[17]。本组病例1最终形成门静脉海绵样变,但随访至今未发生上消化道出血症状,因此未采用Rex手术治疗;病例2因存在门静脉海绵样变且第一次Rex手术失败,因而给予再次Rex手术治疗。肝移植是治疗PVT的可选择方法,对于经以上治疗仍然无效者可选择肝移植治疗。
当前对于儿童血栓栓塞性疾病(包括PVT)的治疗存在以下问题[7]:①抗凝治疗强度,包括抗凝药物的安全性和有效性不清楚,很多标准参照成人,多为临床经验用药;②药物治疗持续时间尚无定论,多为成人标准,缺乏多中心研究证据支持。本组2例儿童急性PVT采取肝素联合尿激酶溶栓治疗后,PVT较前减少,且症状得到改善,达到了急性PVT的治疗目的,但病例数少,其治疗安全性和有效性还需更多临床证据支持。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 张金山负责文献检索、论文设计、数据收集、研究结果分析与讨论和论文撰写;李龙负责全文知识性内容的审读与修正
| [1] |
Chawla YK, Bodh V. Portal vein thrombosis[J]. J Clin Exp Hepatol, 2015, 5(1): 22-40. DOI:10.1016/j.jceh.2014.12.008 |
| [2] |
Malkowski P, Pawlak J, Michalowicz B, et al. Thrombolytic treatment of portal thrombosis[J]. Hepatogastroenterology, 2003, 50(54): 2098-2100. |
| [3] |
Machado NO, Chopra PJ, Sankhla D. Portal vein thrombosis postlaparoscopic splenectomy presenting with infarction of gut: review of risk factors, investigations, postoperative surveillance, and management[J]. Surg Laparosc Endosc Percutan Tech, 2010, 20(4): 273-277. DOI:10.1097/SLE.0b013e3181e364b9 |
| [4] |
Zhang JS, Li L. Imaging features and clinical relevance of portal venous systems shown by extrahepatic portal angiography in children with extrahepatic portal venous obstruction[J]. J Vasc Surg Venous Lymphat Disord, 2020, 8(5): 756-761. DOI:10.1016/j.jvsv.2019.11.016 |
| [5] |
Gueyikian S, Ferral H. Portal vein thrombosis: introduction to imaging and etiology[J]. Semin Intervent Radiol, 2023, 40(1): 33-37. DOI:10.1055/s-0043-1764431 |
| [6] |
Zhang JS, Li L. Surgical ligation of a portosystemic shunt for the treatment of type II Abernethy malformation in 12 children[J]. J Vasc Surg Venous Lymphat Disord, 2021, 9(2): 444-451. DOI:10.1016/j.jvsv.2020.08.001 |
| [7] |
Monagle P, Chan AKC, Goldenberg NA, et al. Antithrombotic therapy in neonates and children: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e737S-e801S. DOI:10.1378/chest.11-2308 |
| [8] |
Condat B, Pessione F, Hillaire S, et al. Current outcome of portal vein thrombosis in adults: risk and benefit of anticoagulant therapy[J]. Gastroenterology, 2001, 120(2): 490-497. DOI:10.1053/gast.2001.21209 |
| [9] |
Baril N, Wren S, Radin R, et al. The role of anticoagulation in pylephlebitis[J]. Am J Surg, 1996, 172(5): 449-453. DOI:10.1016/S0002-9610(96)00220-6 |
| [10] |
Condat B, Pessione F, Helene Denninger M, et al. Recent portal or mesenteric venous thrombosis: increased recognition and frequent recanalization on anticoagulant therapy[J]. Hepatology, 2000, 32(3): 466-470. DOI:10.1053/jhep.2000.16597 |
| [11] |
Tessler FN, Gehring BJ, Gomes AS, et al. Diagnosis of portal vein thrombosis: value of color Doppler imaging[J]. AJR Am J Roentgenol, 1991, 157(2): 293-296. DOI:10.2214/ajr.157.2.1853809 |
| [12] |
Kuszyk BS, Osterman FAJr, Venbrux AC, et al. Portal venous system thrombosis: helical CT angiography before transjugular intrahepatic portosystemic shunt creation[J]. Radiology, 1998, 206(1): 179-186. DOI:10.1148/radiology.206.1.9423670 |
| [13] |
Hall TC, Garcea G, Metcalfe M, et al. Management of acute non-cirrhotic and non-malignant portal vein thrombosis: a systematic review[J]. World J Surg, 2011, 35(11): 2510-2520. DOI:10.1007/s00268-011-1198-0 |
| [14] |
Liu FY, Wang MQ, Fan QS, et al. Interventional treatment for symptomatic acute-subacute portal and superior mesenteric vein thrombosis[J]. World J Gastroenterol, 2009, 15(40): 5028-5034. DOI:10.3748/wjg.15.5028 |
| [15] |
Saito H, Sugihara F, Ueda T, et al. Efficacy of endovascular treatment for completely occlusive acute-subacute portal and mesenteric vein thrombosis with severe complications in patients without cirrhosis[J]. Jpn J Radiol, 2023, 41(5): 541-550. DOI:10.1007/s11604-022-01377-9 |
| [16] |
Ju C, Li X, Gadani S, et al. Portal vein thrombosis: diagnosis and endovascular management[J]. Rofo, 2022, 194(2): 169-180. DOI:10.1055/a-1642-0990 |
| [17] |
Zhang JS, Li L. Rex shunt for extra-hepatic portal venous obstruction in children[J]. Children (Basel), 2022, 9(2): 297. DOI:10.3390/children9020297 |
 2025, Vol. 24
2025, Vol. 24
