胆道闭锁(biliary atresia, BA)是新生儿期胆汁淤积最常见的原因,其典型表现为肝内外胆管发生持续性炎症并快速进展为肝纤维化[1]。自1959年Morie Kasai首次应用肝门-空肠吻合手术(Kasai手术) 治疗BA以来,该术式成为治疗胆道闭锁的标准术式。但目前对于Kasai手术治疗BA的时机、效果、预后及后续肝移植相关问题的研究仍然存在一定争议[2-4]。本研究旨在总结胆道闭锁Kasai手术治疗效果,探讨影响Kasai手术后黄疸清除的相关因素。
资料与方法 一、临床资料回顾性分析四川大学华西医院小儿外科自2015年9月至2022年8月期间收治的358例BA患儿临床资料,排除18例失访或临床资料严重缺失以及113例因月龄大、肝弹性值高、肝硬化明显,家属放弃行Kasai手术的患儿,最终纳入227例接受Kasai手术的患儿,其中开放手术124例,腹腔镜手术103例。纳入标准:①术中胆道造影证实为BA并行Kasai手术;②随访数据完整。排除标准:①术中仅行胆道造影,未行Kasai手术;②临床资料缺失或失访。本研究经四川大学华西医院伦理委员会审核批准(202411),患儿家属均知情并签署知情同意书。
收集患儿临床资料,包括手术日龄、性别、手术方式、Gross-Kasai分型、Davenport分型、肝门部纤维包块厚度值、肝门部纤维包块横切面单位面积小胆管直径≥150 μm数目、肝弹性值、术后6个月内胆管炎发作频次、肝内胆管扩张情况以及手术前后实验室检查指标等。
肝弹性值的测量方法:使用线性阵列AixPlorer扫描仪(Supersonic Imagine, Aix-en-Province, France),选择Ⅴ段或Ⅵ段肝脏进行测量。在肝实质的等回声区域上放置一个矩形相关区域(rectangular region of interest, ROI),避开血管、结节或其他结构。分析框设置为肝包膜下5~10 mm。当大部分ROI框被均匀填充颜色并维持至少1个呼吸周期时,即为测量成功。记录ROI的平均值。重复测量至少3次。
二、分组及定义术后对BA患儿进行持续随访,按照Kasai手术后3个月、6个月、6个月后的时间点观察患儿黄疸消退情况,以总胆红素降至正常上限(≤17.10 μmol/L,重氮法)为黄疸消退良好。将患儿按照黄疸消退情况分为黄疸消退良好组和黄疸消退不佳组。
三、Kasai手术后药物治疗单中心方案本中心对胆道闭锁Kasai手术后患儿常规予标准化药物治疗,包括静脉注射甲泼尼松龙7 d,剂量从每日4 mg/kg开始,逐渐减少至每日1~2 mg/kg维持剂量;后改为口服。根据血培养结果选择抗生素,包括静脉注射第三代头孢菌素2周,之后口服3~6个月。其他药物包括熊去氧胆酸、复方甘草酸苷、中链脂肪酸以及脂溶性维生素A、D、E和K。
四、统计学处理应用SPSS 26.0进行统计学分析。服从正态分布的定量资料采用x±s描述,组间比较采用两独立样本t检验;定性资料采用频数描述,组间比较采用Pearson卡方检验,对不满足Pearson卡方检验的数据采用连续性校正卡方检验。将P<0.05的资料进行多因素Logistic回归分析,对亚组的分析采用Bonferroni法校正检验。P<0.05为差异具有统计学意义。
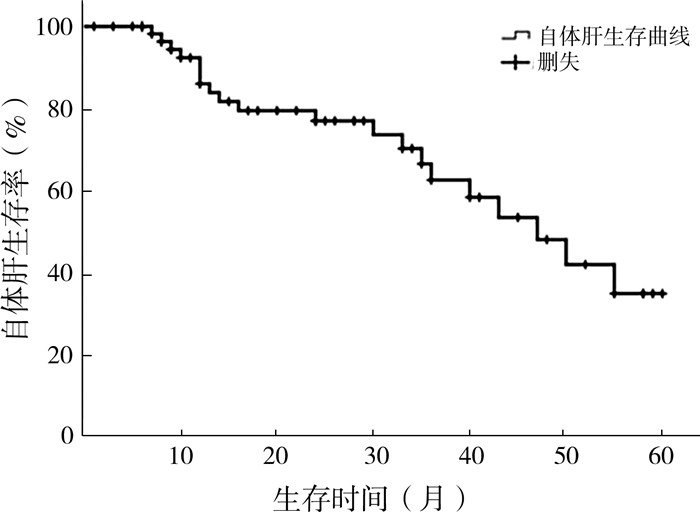
结果本研究中227例接受了Kasai手术且进行了为期5年的随访或随访至终点的患儿中,术后3个月黄疸消退率为59.47%(135/227),术后6个月黄疸消退率为64.32%(146/227),6个月后达到黄疸消退良好标准的患儿仅2例,最终黄疸总体消退率为65.20%(148/227)。黄疸消退良好148例,术后5年自体肝累计存活率为35.20%(图 1),其中30例因反复发作胆管炎或肝纤维化加重,接受了肝移植手术。黄疸消退不佳79例,其中71例于术后1年内接受了肝移植手术。
|
图 1 148例胆道闭锁Kasai手术后黄疸消退良好患儿自体肝累计生存率 Fig.1 Cumulative survival rate of native liver in 148 BA children with a decent clearance of jaundice after Kasai |
进一步统计分析发现,年龄(P=0.032)、门静脉前方纤维包块厚度(P<0.001)、肝门部纤维包块横截面单位面积小胆管直径≥150 μm数目(P<0.001)、肝弹性值[5](P<0.001)、术后6个月内胆管炎发作频次(P=0.011)、术后肝内胆管扩张数(P=0.013)、γ-谷氨酰转移酶(γ-GT)(P=0.012)、天冬氨酸转氨酶/血小板比值指数(aspartate aminotransferase-to-platelet ratio index, APRI)(P=0.021) 对BA患儿Kasai手术后黄疸消退率具有明显影响,而性别(P=0.813)、体重(P=0.252)、手术方式(P=0.377)等对术后黄疸消退无明显影响,见表 1。
| 表 1 黄疸消退良好组与黄疸消退不佳组胆道闭锁Kasai手术后患儿临床资料对比 Table 1 Analysis of risk factors affecting the clearance of jaundice after Kasai |
|
|
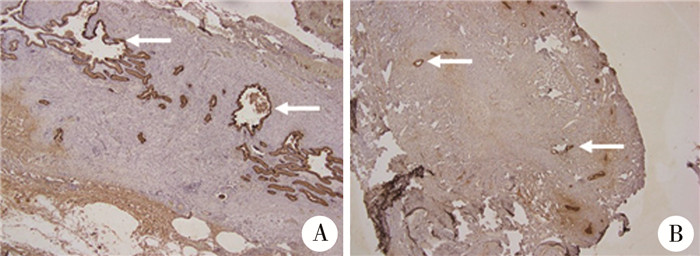
Logistic回归分析发现,年龄(P=0.025,OR=0.357,95%CI: 0.236~0.533)、彩超下肝门部纤维包块厚度(P=0.016,OR=0.589,95%CI: 0.332~0.697)、肝门部纤维包块横截面单位面积小胆管直径≥150 μm数目(P=0.012,OR=3.953,95%CI: 1.225~5.432)、术后6个月内胆管炎发作频次(P=0.035,OR=0.886,95%CI: 0.436~0.985)为胆道闭锁Kasai手术后黄疸消退的独立相关因素(表 2)。对患儿年龄、彩超下门静脉前方纤维包块厚度、肝门部纤维包块横截面单位面积小胆管直径≥150 μm数目、术后胆管炎发作频次进行分层分析显示,年龄40~80 d组患儿黄疸消退率高于年龄<40 d组以及年龄≥80 d组(P=0.030);彩超测量门静脉前方纤维包块厚度3.5~5.5 mm组患儿术后退黄效果优于≤3.5 mm组以及≥5.5 mm组(P=0.008);病理检查发现肝门部纤维包块切面高倍镜下小胆管直径≥150 μm数≥5条/mm2(图 2)患儿术后黄疸消退率及消退速率最佳(P<0.001);胆管炎发作频次6个月内超过3次的患儿黄疸消退率明显低于≤3次的患儿(P<0.001),见表 3。
| 表 2 胆道闭锁Kasai手术后影响黄疸消退危险因素的Logistic回归分析结果 Table 2 Multifactorial Logistic regression analysis of risk factors affecting the clearance of jaundice after Kasai |
|
|
|
图 2 胆道闭锁Kasai手术后患儿病理检查结果 Fig.2 Pathological results after Kasai procedure for biliary atresia 注 A:黄疸消退良好组患儿肝门部纤维包块切面可见较多较粗的胆管(箭头所示)(CK-19染色,×40);B:黄疸消退不佳组患儿肝门部纤维包块切面可见少量较细的胆管(箭头所示)(CK-19染色,×40) |
| 表 3 胆道闭锁Kasai手术后影响黄疸消退的危险因素亚组分析 Table 3 Subgroup analysis of risk factors affecting the clearance of jaundice after Kasai |
|
|
Kasai手术是胆道闭锁的重要治疗方法,手术年龄对Kasai手术效果具有明显的影响,是影响患儿预后的重要因素,文献报道日龄小于60 d患儿黄疸消退率最高,日龄大于60 d患儿黄疸消退率降低[6]。也有文献报道日龄60~80 d患儿Kasai手术后黄疸消退率较好[7]。本研究结果显示,日龄40~80 d患儿黄疸消退率最好,原因可能与胆管尤其是肝门部胆管闭锁及增生程度有关。手术日龄越大,肝纤维化程度越重,60日龄以内肝门部纤维包块与肝脏固有包膜易于分离,可仅完整保留肝脏固有包膜,胆汁易于排出。而日龄超过80 d的患儿肝门部纤维化严重,纤维包块与肝脏固有包膜分界不清楚,Kasai手术后胆汁排出欠通畅,仅早期有胆汁排出,后期易丧失胆汁引流,且退黄慢或不足,自体肝生存期较短,往往需要早期进行肝移植。而日龄低于40 d患儿Kasai手术后效果不佳可能与肝胆管尤其肝门部小胆管因胆汁分泌再通及小胆管增生重塑不足有关。研究还发现,Kasai手术后黄疸消退主要与较大胆管的直径和数目相关,与较小胆管数目及数量关系不大,且肝门部纤维包块面积及厚度与术后胆汁排泌有一定的关系[8-10]。
本研究结果显示,胆道闭锁手术方式与手术效果之间并没有明显的关系,开放Kasai手术和腹腔镜Kasai手术的退黄率差异无统计学意义(P<0.05),这也提示胆道闭锁Kasai手术的效果主要与肝门部小胆管开放或闭锁程度有关,但也不排除本研究样本量不够的因素。本组病例随访发现,开放Kasai手术后退黄速率较腹腔镜手术略快,这可能与开放手术中肝门部显露充分,手术配合方便,纤维包块剥离更彻底,肝门部纤维组织保留更薄有关。与既往文献报道有所不同,本研究中部分病例肝门部纤维包块剥离范围扩大到胆囊板及脐静脉板和Arantian板(EPE术式),与常规术式的手术效果无明显差异,这也说明Kasai手术后胆汁排泌主要断面位于肝门部原左右肝管及附近,而其他部位断面基本不参与术后胆汁排泄[11-13]。
肝门部纤维包块的切除深度明显影响胆道闭锁Kasai手术后效果[14]。本组病例术中纤维包块手术切除的方法一致,均从门静脉右侧,沿肝门板与肝脏固有包膜之间的间隙横切剥离。本研究发现彩超下肝门部纤维包块厚度是Kasai手术后黄疸消退的独立危险因素,且在亚组分析中发现,厚度在3.5~5.5 mm的纤维包块切除后黄疸消退效果更好,这可能与纤维包块厚度<3.5 mm时,纤维包块与肝包膜致密粘连;以及厚度>5.5 mm时,纤维化较重,肝门部毛细胆管条件差,术后胆汁引流建立差有关。肝门部纤维包块切除必须保持肝固有包膜完整,否则可能诱发肝门部纤维组织增生扩展导致肝门部瘢痕化而失去排胆汁作用。肝门部纤维包块本身来源于肝门部胆管及周围组织,肝门处的胆管和血管周围的Glisson鞘结缔组织相互融合增厚形成肝门板系统,纤维包块剥离的最佳间隙位于肝门板与肝脏固有包膜(Laennec囊)之间。Hayashi等[15]研究发现,Glisson鞘和肝固有包膜由不同的纤维组织构成,在肝内和肝外Glisson鞘和Laennec囊都是可以分离的。这为胆道闭锁肝门部纤维包块的切除深度提供了解剖学依据[16-18]。
本研究还发现,胆管炎发作频次6个月内超过3次的患儿黄疸消退率明显低于≤3次的患儿。部分胆道闭锁患儿病肝胆管并非完全闭塞,尤其是Kasai手术后反复发作胆管炎患儿,可以看到肝内胆管节段性扩张,其中可充填大量泥沙样结石[19-20]。这也证实了反复胆管炎发作的原因是胆管存在狭窄,导致肝内胆管不同程度扩张,胆汁排出不通畅,部分形成胆汁湖[21]。淤积胆汁容易继发感染导致反复肝内及全身感染,血或胆汁可培养出感染细菌,通常源于肠道菌群易位,也可来源于血源性感染[18, 22]。反复胆管炎可进一步加重肝纤维化,此类型患儿通常需行肝内胆管穿刺引流或再次手术,病情不缓解则需提前实施肝移植手术。也有部分患儿因胆汁分泌压力致狭窄胆管逐渐扩大,胆汁引流通畅后胆管炎减少或消失。
综上所述,胆道闭锁Kasai手术可以有效延长患儿自体肝生存率。近年来我国胆道闭锁Kasai手术效果明显提升,近三分之一的患儿可以获得中长期自体肝生存[23]。本研究中Kasai手术后5年自体肝生存率为35.20%。此外,也有少部分患儿在接受Kasai手术后可以自体肝长期存活,甚至不需要肝移植[24-25]。肝移植是治疗胆道闭锁的最终手段。目前,关于胆道闭锁患儿一期接受肝移植手术,还是先行Kasai手术再行肝移植治疗尚存在争议[26-29]。虽然目前儿童肝移植技术已非常成熟,受体长期生存率已达85%以上[30-31]。但年龄小、体重低的婴儿肝移植仍然是肝移植手术的难点[32]。Kasai手术可以将儿童肝移植推迟到一个更加合适的年龄,为肝移植创造更好的条件,此外还可以有效缓解供肝不足的现状[33]。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 谢镇宇、蒲思宇、张一茂负责论文调查设计、论文撰写;王琦、宋九林、陈阳进行数据整理、统计学分析、文献检索、论文讨论分析;向波、靳曙光负责研究指导、论文修改
| [1] |
Wang J, Xu YH, Chen ZH, et al. Liver immune profiling reveals pathogenesis and therapeutics for biliary atresia[J]. Cell, 2020, 183(7): 1867-1883.e26. DOI:10.1016/j.cell.2020.10.048 |
| [2] |
Chan KWE, Lee KH, Wong HYV, et al. Impact of age of patient and experience of surgeon on the outcome after Kasai portoenterostomy: Can we delay the surgery?[J]. Eur J Pediatr Surg, 2021, 31(4): 335-340. DOI:10.1055/s-0040-1713934 |
| [3] |
Yang CZ, Ke M, Zhou Y, et al. Impact of early Kasai portoenterostomy on short-term outcomes of biliary atresia: a systematic review and meta-analysis[J]. Front Surg, 2022, 9: 924506. DOI:10.3389/fsurg.2022.924506 |
| [4] |
Okubo R, Nio M, Sasaki H, et al. Impacts of early kasai portoenterostomy on short-term and long-term outcomes of biliary atresia[J]. Hepatol Commun, 2021, 5(2): 234-243. DOI:10.1002/hep4.1615 |
| [5] |
丁彩琳, 陈亚军. 二维剪切波弹性成像在胆道闭锁中的研究进展[J]. 临床小儿外科杂志, 2022, 21(6): 571-575. Ding CL, Chen YJ. Overview of two-dimensional shear wave elastography in biliary atresia[J]. J Clin Ped Sur, 2022, 21(6): 571-575. DOI:10.3760/cma.j.cn101785-202011032-014 |
| [6] |
Kong YY, Zhao JQ, Wang J, et al. Modified stool color card with digital images was efficient and feasible for early detection of biliary atresia-a pilot study in Beijing, China[J]. World J Pediatr, 2016, 12(4): 415-420. DOI:10.1007/s12519-016-0061-7 |
| [7] |
Jiao CL, Yu KC, Li DD, et al. A retrospective study of the ideal operation time for preterm biliary atresia patients[J]. Pediatr Surg Int, 2019, 35(6): 679-684. DOI:10.1007/s00383-019-04464-7 |
| [8] |
Shpoliansky M, Tobar A, Mozer-Glassberg Y, et al. Portal plate bile duct diameter in biliary atresia is associated with long-term outcome[J]. Pediatr Surg Int, 2022, 38(6): 825-831. DOI:10.1007/s00383-022-05113-2 |
| [9] |
刘丹丹, 詹江华, 高伟, 等. 胆道闭锁Kasai术后胆管病理改变的研究[J]. 中华小儿外科杂志, 2014, 35(4): 248-253. Liu DD, Zhan JH, Gao W, et al. Changes of bile duct pathology in children with biliary atresia after Kasai portoenterstomy[J]. Chin J Pediatr Surg, 2014, 35(4): 248-253. DOI:10.3760/cma.j.issn.0253-3006.2014.04.004 |
| [10] |
魏楠楠, 杨继鑫, 易斌, 等. 纤维板块内小胆管分布与葛西手术预后关系的研究[J]. 中华小儿外科杂志, 2018, 39(2): 116-120. Wei NN, Yang JX, Yi B, et al. Correlation of fibrous remnant of porta hepatis and postoperative prognosis of patients with biliary atresia[J]. Chin J Pediatr Surg, 2018, 39(2): 116-120. DOI:10.3760/cma.j.issn.0253-3006.2018.02.009 |
| [11] |
董淳强, 董昆, 杨体泉. 胆道闭锁肝门肠吻合术手术改进的初步探讨[J]. 中华小儿外科杂志, 2016, 37(1): 53-58. Dong CQ, Dong K, Yang TQ. Clinical efficacy of modified portoenterostomy for biliary atresia[J]. Chin J Pediatr Surg, 2016, 37(1): 53-58. DOI:10.3760/cma.j.issn.0253-3006.2016.01.012 |
| [12] |
Abe E, Koga H, Nakamura H, et al. Mid-term outcome of postoperative biliary atresia patients according to level of transection of the biliary remnant and depth of suturing[J]. Pediatr Surg Int, 2022, 38(5): 701-706. DOI:10.1007/s00383-022-05097-z |
| [13] |
Tambucci R, de Magnée C, Szabo M, et al. Sequential treatment of biliary atresia with Kasai hepatoportoenterostomy and liver transplantation: benefits, risks, and outcome in 393 children[J]. Front Pediatr, 2021, 9: 697581. DOI:10.3389/fped.2021.697581 |
| [14] |
詹江华, 冯杰雄. 胆道闭锁何时完成Kasai手术[J]. 中华小儿外科杂志, 2016, 37(5): 321-326. Zhan JH, Feng JX. When will Kasai surgery be completed for biliary atresia[J]. Chin J Pediatr Surg, 2016, 37(5): 321-326. DOI:10.3760/cma.j.issn.0253-3006.2016.05.001 |
| [15] |
Hayashi S, Murakami G, Ohtsuka A, et al. Connective tissue configuration in the human liver hilar region with special reference to the liver capsule and vascular sheath[J]. J Hepatobiliary Pancreat Surg, 2008, 15(6): 640-647. DOI:10.1007/s00534-008-1336-8 |
| [16] |
Hu Y, Shi J, Wang SH, et al. Laennec's approach for laparoscopic anatomic hepatectomy based on Laennec's capsule[J]. BMC Gastroenterol, 2019, 19(1): 194. DOI:10.1186/s12876-019-1107-9 |
| [17] |
戴朝六, 贾昌俊. 肝门板解剖的临床意义和应用[J]. 中国实用外科杂志, 2019, 39(2): 122-126. Dai CL, Jia CJ. Anatomy and clinical significance of hilar plate[J]. Chin J Pract Surg, 2019, 39(2): 122-126. DOI:10.19538/j.cjps.issn1005-2208.2019.02.05 |
| [18] |
詹江华, 李梦迪. 胆道闭锁Kasai术后胆管炎的发病机制探讨[J]. 天津医药, 2022, 50(1): 1-4. Zhan JH, Li MD. Pathogenetic mechanism of cholangitis after Kasai procedure in children with biliary atresia[J]. Tianjin Med J, 2022, 50(1): 1-4. DOI:10.11958/20211092 |
| [19] |
刘丹丹, 詹江华, 高伟, 等. 胆道闭锁患者肝门的病理解剖学研究[J]. 临床小儿外科杂志, 2015, 14(1): 20-24. Liu DD, Zhan JH, Gao W, et al. Pathological study of porta hepatis in biliary atresia (BA)[J]. J Clin Ped Sur, 2015, 14(1): 20-24. DOI:10.3969/j.issn.1671-6353.2015.01.006 |
| [20] |
赵新颜, 罗文萍, 刘立伟, 等. 先天性胆道闭锁行与未行葛西术患儿临床病理特点-附58例对比研究[J]. 肝脏, 2019, 24(2): 126-129, 142. Zhao XY, Luo WP, Liu LW, et al. Difference in clinicopathological features of congenital biliary atresia children with and without Kasai procedure: a comparative study in 58 cases[J]. Chin Hepatol, 2019, 24(2): 126-129, 142. DOI:10.14000/j.cnki.issn.1008-1704.2019.02.007 |
| [21] |
Ginström DA, Hukkinen M, Kivisaari R, et al. Biliary atresia-associated cholangitis: the central role and effective management of bile lakes[J]. J Pediatr Gastroenterol Nutr, 2019, 68(4): 488-494. DOI:10.1097/MPG.0000000000002243 |
| [22] |
庞文博, 陈亚军, 张廷冲, 等. 胆道闭锁Kasai术后胆管炎的诊治及预后研究[J]. 临床小儿外科杂志, 2022, 21(1): 41-45. Pang WB, Chen YJ, Zhang TC, et al. Diagnosis, management and prognosis of post-Kasai cholangitis[J]. J Clin Ped Sur, 2022, 21(1): 41-45. DOI:10.3760/cma.j.cn.101785-202006073-008 |
| [23] |
夏强, 赵东. 儿童肝移植[J]. 中华器官移植杂志, 2019, 40(1): 3. Xia Q, Zhao D. Pediatric liver transplantation[J]. Chin J Organ Transplant, 2019, 40(1): 3. DOI:10.3760/cma.j.issn.0254-1785.2019.01.002 |
| [24] |
Wong KKY, Wong CWY. A review of long-term outcome and quality of life of patients after Kasai operation surviving with native livers[J]. Pediatr Surg Int, 2017, 33(12): 1283-1287. DOI:10.1007/s00383-017-4158-4 |
| [25] |
刘更新, 赵一霖, 杨芳, 等. Kasai手术对肝移植治疗胆道闭锁疗效影响的Meta分析[J]. 中华小儿外科杂志, 2022, 43(8): 714-721. Liu GX, Zhao YL, Yang F, et al. Impact of Kasai procedure on liver transplantation for biliary atresia: a Meta-analysis[J]. Chin J Pediatr Surg, 2022, 43(8): 714-721. DOI:10.3760/cma.j.cn421158-20210909-00438 |
| [26] |
Neto JS, Feier FH, Bierrenbach AL, et al. Impact of Kasai portoenterostomy on liver transplantation outcomes: a retrospective cohort study of 347 children with biliary atresia[J]. Liver Transpl, 2015, 21(7): 922-927. DOI:10.1002/lt.24132 |
| [27] |
Liu LW, Wei L, Qu W, et al. Impact of the Kasai procedure and the length of native liver survival time on outcomes of liver transplantation for biliary atresia[J]. Liver Transpl, 2022, 28(2): 224-235. DOI:10.1002/lt.26287 |
| [28] |
詹江华, 孙溶涓, 王智茹, 等. 日本《胆道闭锁临床实践指南》解读[J]. 临床小儿外科杂志, 2023, 22(3): 205-210. Zhan JH, Sun RJ, Wang ZR, et al. Interpretations of clinical practice guidelines for biliary atresia in Japan[J]. J Clin Ped Sur, 2023, 22(3): 205-210. DOI:10.3760/cma.j.cn101785-202212025-002 |
| [29] |
赵方园, 詹江华. 胆道闭锁患儿Kasai手术年龄选择与预后关系的研究进展[J]. 中华肝胆外科杂志, 2022, 28(10): 793-796. Zhao FY, Zhan JH. Research advances on the relationship between age at Kasai portoenterostomy and prognosis for biliary atresia[J]. Chin J Hepatobiliary Surg, 2022, 28(10): 793-796. DOI:10.3760/cma.j.cn113884-20220426-00191 |
| [30] |
Salonen R, Jahnukainen T, Nikkilä A, et al. Long-term mortality in pediatric solid organ recipients-A nationwide study[J]. Pediatr Transplant, 2023, 27(2): e14463. DOI:10.1111/petr.14463 |
| [31] |
Baumann U, Karam V, Adam R, et al. Prognosis of children undergoing liver transplantation: a 30-year European study[J]. Pediatrics, 2022, 150(4): e2022057424. DOI:10.1542/peds.2022-057424 |
| [32] |
中国研究型医院学会加速康复外科专业委员会. 儿童肝移植围手术期管理专家共识[J]. 中华外科杂志, 2021, 59(3): 179-191. Enhanced Recovery After Surgery Committee of Chinese Research Hospital Association. Expert consensus of perioperative management in pediatric liver transplantation[J]. Chin J Surg, 2021, 59(3): 179-191. DOI:10.3760/cma.j.cn112139-20201203-00838 |
| [33] |
张聪, 赵升桥, 詹江华. 胆道闭锁Kasai术与肝移植的研究进展[J]. 中华器官移植杂志, 2020, 41(11): 701-704. Zhang C, Zhao SQ, Zhan JH. Research advances on Kasai surgery for biliary atresia and liver transplantation[J]. Chin J Organ Transplant, 2020, 41(11): 701-704. DOI:10.3760/cma.j.cn421203-20200523-00161 |
 2025, Vol. 24
2025, Vol. 24


