脑血管病长期以来被认为是导致成人致残率和死亡率增加的健康问题,也是引发年轻患者脑损伤的重要原因[1]。儿童脑血管病是指影响出生后28天至18岁儿童大脑和脊髓血管的一组疾病,虽然较成人少见,却是一类危及生命并可能导致长期严重致残的神经系统危重症,幸存者通常面临终身神经功能缺陷,包括偏瘫、神经认知缺陷及癫痫[2-3]。儿童脑血管病的最大危害是脑血管破裂出血或脑血管缺血导致脑卒中, 常见类型包括出血性卒中(hemorrhagic stroke, HS)和缺血性卒中(ischemic stroke, IS), 如脑血管畸形破裂出血、脑动脉瘤破裂出血、动脉性缺血性脑卒中(artery ischemic stroke, AIS)和烟雾病(Moyamoya disease)等[4]。
儿童脑血管病病因不同,治疗策略各异,临床应以彻底消除病灶、预防再出血和癫痫发作,以及减轻神经功能损伤为目的。儿童脑血管病的治疗方法主要包括显微神经外科手术、血管内介入治疗(endovascular therapy, EVT), 部分脑血管畸形还可联合立体定向放射治疗(stereotactic radiosurgery, SRS)。EVT是神经外科飞速发展的重要领域,具有创伤小、手术时间相对较短等优点。儿童神经介入治疗的发展相对滞后,但EVT已逐渐成为脑血管畸形、脑动脉瘤、AIS等儿童脑血管病的主要救治手段。
尽管借鉴了EVT在成人脑血管病治疗中的经验,儿童脑血管病仍然面临在风险因素、病因机制、临床表现和治疗策略等方面的年龄相关特殊性。本文结合新近文献、全球疾病负担(global burden of disease, GBD)数据库资料以及作者经验, 阐述EVT治疗儿童脑血管病的最新进展,并提出一些思考。
一、儿童脑卒中的疾病负担研究数据显示,2013年全球儿童缺血性卒中的现患病例数为97 792例,儿童出血性卒中的现患病例数为67 621例,与1990年相比,儿童脑卒中的绝对患病数量增加了约35%[5]。尽管近年来对儿童脑卒中的认识有所提高,但针对0~18岁各年龄段儿童脑卒中的国家和区域疾病负担数据仍然较为缺乏[6]。这一数据空白限制了针对儿童脑卒中的精准干预策略和预防措施的制定。笔者通过GBD数据库统计发现,自1990年起,全球儿童脑卒中发病率逐年下降,但2015年后又显逐渐升高趋势。2021年学龄前儿童脑卒中的发病率为59/100 000, 学龄期儿童脑卒中的发病率为81/100 000(图 1A);2021年学龄前儿童脑卒中的患病率为74.8/100 000, 学龄期儿童脑卒中的患病率为232/100 000(图 1B)。从世界范围来看,儿童脑卒中伤残负担较大的国家主要在亚洲及非洲地区,2021年我国儿童脑卒中调整伤残生命年(disability-adjusted life years, DALYs)为176 200(图 1C),是儿童脑卒中后遗症负担最重的国家之一。

|
图 1 儿童脑卒中疾病负担统计图 Fig.1 Source of disease burden, Data on childhood stroke: http://ghdx.healthdata.org/gbd-results-tool 注 (数据来源: http://ghdx.healthdata.org/gbd-results-tool) |
儿童脑血管病的血管内治疗在过去几十年中取得了显著发展。在1980年代末和1990年代,主要用于成人的血管内技术开始展现出在儿童人群中应用的潜力。Lasjaunisa等[7]回顾性总结了1982—1988年间经EVT治疗的36例Galen动脉瘤样血管畸形(vein of Galen aneurysmal malformations, VGAM)的成功经验, 提出EVT是儿童VGAM最好的治疗方式,总体死亡率约13%,技术并发症发生率为0,较传统外科手术具有明显的优势,传统手术在新生儿中的死亡率达91%,该项研究展示出EVT治疗儿童脑血管病的巨大潜力。1990年代末和2000年代初,随着技术的进步,先进影像技术、漂浮微导管和液体栓塞剂(如Onyx)出现,EVT逐渐成为治疗儿童动静脉畸形(arteriovenous malformations, AVMs)和动静脉瘘(arteriovenous fistula, AFV)的重要手段[8]。2010年代及以后,EVT扩展到了更多儿童脑血管病的救治领域,如可解脱弹簧圈甚至支架辅助技术在儿童脑动脉瘤中的应用[9-10]、机械取栓(mechanical thrombectomy, MT)救治儿童AIS等[11-12]。
(一) 血管内介入技术在儿童脑血管畸形救治中的应用脑血管畸形是指因先天性局部脑血管的发生学变异所致的颅内局部血管结构异常或病理性沟通[13]。脑血管畸形包括AVMs、动静脉瘘(arteriovenous fistula,AVF)、VGAM、脑毛细血管扩张症(brain cerebral telangiectasia, BCT)、发育性静脉畸形(developmental venous anomalies, DVAs)、海绵状血管畸形(cavernous vascular malformation, CCM)等[14-15]。脑血管畸形是累及儿童的主要脑血管病,常以自发性颅内出血为首诊原因,其他临床症状包括头痛、癫痫发作和局灶性神经功能障碍[16-17]。因CCM和DVAs并无真性动脉通路与畸形团连接,EVT不作为主要治疗手段。BCT因发生机制更多与基因相关,通常采取保守管理,EVT不是这种类型畸形的标准治疗方案[18]。
研究表明,大约每5 000名儿童中有1例出现AVM,无性别差异,约占普通人群AVM病例的六分之一[19]。近年来,随着神经介入技术和介入材料的发展,EVT治疗AVMs取得了显著进步。动静脉联合入路[20]、“高压锅技术”[21-22]等先进理念得以推广, 液体栓塞剂(如Onyx和NBCA)的使用得以精准封闭异常血管,减少了血管破裂和出血的风险,逐渐形成Spetzler-Martin (SM)分级Ⅰ~Ⅱ级AVMs的治愈性栓塞[23-24]。Rodriguez-Calienes等[25]回顾性分析了单纯血管内介入治疗35例SM分级Ⅲ级AVM儿童患者的数据,患儿平均年龄12.2岁(5~18岁), 其中16例(47%)实现了血管造影随访的治愈性栓塞。作者团队新近报道了首例成功使用EVT治愈性栓塞Percheron动脉供血的中脑AVM[26]。EVT可能是部分深部、累及功能区AVM的更优选择。对于复杂的AVMs,EVT通常与手术或立体定向放射治疗联合使用[27]。在复合手术室逐渐普及的今天,针对高级别或出血性AVMs的处理,EVT可作为术前干预,以降低出血风险,并同期手术切除畸形团[28]。因此,个性化多模式联合治疗是提高儿童AVMs影像学治愈率并改善治疗效果的主要策略。
(二) 血管内介入技术在儿童脑动脉瘤救治中的应用相比于成人动脉瘤,儿童颅内动脉瘤(pediatric intracerebral aneurysm, PIA)更加复杂,临床表现通常与占位效应相关,但也可能出现蛛网膜下腔出血(subarachnoid hemorrhage, SAH)、脑内血肿、癫痫或多种症状的组合[29]。PIA通常与潜在的系统性疾病或局部缺陷有关,如结缔组织疾病、外伤、感染、异常血流、动脉粥样硬化、家族或发育综合征,或在发育过程中存在未被识别的血管脆弱因素[30]。与成人相比,儿童动脉瘤在位置、形态特征、临床表现和预后等方面更加复杂,差异显著。研究显示,PIA患儿后循环和颈内动脉末端动脉瘤的发生率高于成人。此外,夹层动脉瘤和巨大动脉瘤在儿童更常见[31-32]。de Aguiar等[33]在一项单中心回顾性研究中分析了12例PIA的临床数据, 发现约24%的动脉瘤位于后循环,约18%位于颈内动脉末端。此外,约35%的动脉瘤为直径超过25 mm的巨大动脉瘤。
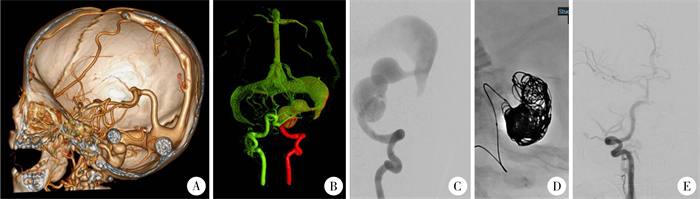
|
图 2 血管内介入治疗6月龄男童软脑膜动静脉瘘病例分享 Fig.2 Therapy of pial arteriovenous fistula with intravascular intervention in a 6-month-old boy 注 A:矢状位头颅CT;B:全脑血管造影双融积成像;C:右侧椎动脉侧位造影;D:血管内介入治疗过程;E:术后即刻造影(图片来源: J Neurosurg Case Lessons.2024, 8(9): CASE24182.doi:10.3171/CASE24182) |
PIA性蛛网膜下腔出血由德国病理学家Eppinger于1871年首次报道,19世纪末和20世纪初,研究者们开始探讨儿童脑动脉瘤的发生率、病因和发病机制[34-35]。早期的显微外科治疗尝试普遍报告高死亡率,直至20世纪中叶至后期,随着EVT治疗策略的逐渐引入,这一局面才开始扭转[36]。近年来,针对动脉瘤的多种EVT技术迅速发展,包括弹簧圈栓塞技术、支架辅助栓塞技术以及血流导向装置等方法[37-39]。这些EVT技术对于破裂和未破裂动脉瘤的治疗效果与传统开放显微手术相当,且具有微创、出血量小、住院时间短等优势,这一观点已在众多的荟萃分析和病例系列研究中得到证实[40-41]。既往研究发现,与显微外科夹闭技术相比,EVT治疗PIA的手术相关住院死亡率和并发症发生率更低[42]。Alawi等[42]研究显示,接受EVT治疗的PIA患儿死亡率为1.65%,明显低于接受显微手术的6.09%。此外,接受手术的儿童更容易出现脑积水和肺部并发症。随着国际蛛网膜下腔动脉瘤试验(International Subarachnoid Aneurysm Trial, ISAT)的发布,EVT逐渐成为PIA的一线治疗策略,这一变化与成人动脉瘤的治疗趋势相似[43]。笔者认为,PIA患儿的体重,血管因素,包括脑血管直径、脑血管弹性和脆性等特点,都是神经外科医师和儿童卒中团队制定手术策略的重要依据。依赖儿童专科麻醉护理,借助超声引导穿刺技术,选择合适的血管内导管系统,制定术中栓塞策略,以及轻柔的术中操作,都是决定PIA安全顺利完成的重要因素。
(三) 血管内介入技术在儿童AIS救治中的应用AIS是世界范围内致残的主要原因,在成人及老年人群中具有高发病率[44]。然而,新近研究发现,每年每10万名儿童中就有1至7.9名经历AIS,且儿童AIS的DALYs远高于成年患者,提示AIS仍然是一个被低估的儿童神经系统危重症[45-47]。AIS是儿童最常见的脑卒中类型,其定义为生后28天至18岁之间由动脉供应区脑梗死引起的急性神经系统功能缺陷。Krishnamurthi等[47]研究显示,儿童脑卒中的发病率自1990年至2013年增加了约35%。虽然近年来儿童脑卒中的死亡率和致残率有所下降,但在发展中国家,这些指标的改善并不显著。这一发现进一步强调了对儿童脑卒中进行研究的紧迫性。不可逆性神经功能缺失是儿童AIS的常见并发症,可能包括智力障碍、行为问题、癫痫、语言障碍以及感觉和运动障碍[46-47]。
目前,EVT是成人AIS的标准治疗方法,包括机械取栓(mechanical thrombectomy, MT)、动脉溶栓、支架植入血管成形等[48]。尽管对EVT治疗儿童AIS的关注增加,但相关研究仍然很少。2015年的美国心脏学会和美国卒中学会(American Heart Association/American Stroke Association, AHA/ASA)指南曾提到:对于一些年龄小于18岁的AIS患者,若显示大血管闭塞,则EVT治疗可以在症状出现后6 h内开始,使用支架取栓可能是合理的[49]。“Save ChildS”作为目前最大的EVT治疗儿童AIS的多中心回顾性研究,也仅纳入了73例儿童大血管闭塞AIS,患儿中位年龄11.3(0.7~18.0)岁,自症状出现至就诊的中位时间为3(1.5~5.0) h;该研究发现,儿童AIS的最常见原因是心源性栓塞(44%),约37%的AIS患儿发病原因尚未明确[50]。值得鼓舞的是该研究中血管再通率达87%[51]。成人AIS的治疗选择正大幅扩展,而儿童AIS的救治仍然主要基于对成人数据的推测。病例系列研究和回顾性分析表明,血管内介入治疗在某些儿童AIS患者中可能是可行且安全的[52-54]。然而,目前尚无针对儿童群体的明确指南,包括患者选择、MT时间窗、血管内介入技术/设备和术后护理。
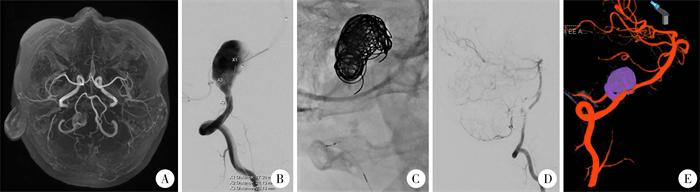
|
图 3 血管内介入治疗12岁男童椎动脉夹层动脉瘤病例分享 Fig.3 Endovascular intervention in a 12-year-old boy with vertebral artery dissection aneurysm disease 注 A:头颅MRA;B:病侧椎动脉造影及术前测量;C:支架辅助弹簧圈栓塞过程;D:术后即刻椎动脉造影:E:术后6个月随访见动脉瘤致密栓塞 |
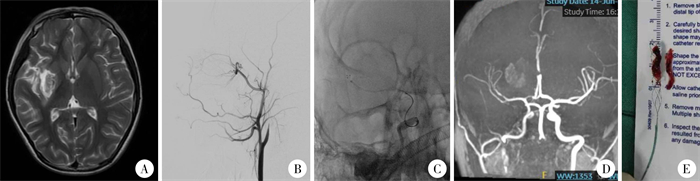
|
图 4 血管内介入治疗9岁女童右侧颈内动脉缺血性脑卒中的病例分享 Fig.4 Endovascular intervention for right internal carotid artery ischemic stroke in a 9-year-old girl 注 A:急诊头颅MRI T2轴位片;B:急诊右侧颈内动脉造影提示颈内动脉闭塞;C:急诊机械取栓血管内介入操作过程;D:术后头颅MRA提示右侧颈内动脉再通;E:术中取出血栓 |
无论是破裂还是未破裂的儿童AVMs,都具有复杂的脑血管构筑和病理特点,目前针对儿童AVMs的治疗时机尚未达成共识[55]。普遍认为,综合治疗儿童AVMs可以获得最佳治疗效果,但关于这些多模式治疗,包括EVT、显微手术以及立体定向放射治疗的时机,文献报道较少[27, 56]。在既往关于显微手术治疗AVMs的时机报道中,Deng等[57]报道了接受早期(1周内)手术的患者,其改良Rankin评分(modified Rankin Scale, mRS)优于接受延迟手术的患者。笔者认为,儿童AVMs的位置、出血情况、血管构筑及患儿基础情况等因素决定了大多数情况下的干预时机。对于无症状的病变,由于大多数病变的出血风险相对较小(未破裂AVM每年的出血风险为1% ~3%),许多中心可以接受在评估过程中等待几周甚至几个月[19]。然而,如果AVMs表现出令人担忧的影像学特点,如引流静脉狭窄、静脉球或血流相关的动脉瘤,早期治疗更可能使患者获益[19]。对于出血性AVMs,特别是血肿占位效应明显或出现脑积水等情况,可能需要立即手术。术前全面了解AVMs的血管构筑至关重要。在某些情况下,由于数字减影血管造影(digital subtraction angiography, DSA)和磁共振成像(magnetic resonance imaging, MRI)所需时间较长或不具备条件,计算机断层血管造影(computed tomography angiography, CTA)可以作为一种快速且有效的信息成像选择[58]。如果术前对AVMs的血管构筑不清楚,急诊手术的目标可能仅集中在清除部分血肿、控制颅内压(intracranial pressure, ICP),并将AVMs的最终治疗推迟,为后期的综合治疗策略提供时间。儿童脑卒中团队的判断和患儿临床状况对于个性化治疗时机的选择至关重要。
(二) 支架系统在儿童脑动脉瘤救治中的关注点 (1) 支架系统在儿童脑动脉瘤救治中的年龄选择支架系统在颅内动脉瘤中的使用较弹簧圈系统对支撑导管更加依赖,因此对患者血管条件包括股动脉和脑动脉管腔直径、脑血管顺应性等的要求高。既往研究证实,身高是股动脉直径的最佳预测因素,患者身高每增加10 cm,股动脉直径增加约0.5 mm[59]。根据文献推断,身高超过110 cm且年龄5岁以上的儿童在使用8F股动脉鞘时,发生股动脉穿刺并发症的风险较低,类似于成人。此外,有研究表明,颅脑动脉直径在5岁时已达到成人的94%[46]。因此,大多数成人的血管内治疗装置,包括支架系统和血流导向系统,通常与5岁以上儿童的脑动脉直径兼容。然而,儿童脑血管更容易发生血管痉挛,因此在操作中可能需要使用更小的引导导管,以降低血管痉挛的风险。目前文献报道使用血流导向装置治疗PIA的最小年龄为9个月[60]。
(2) 支架系统在PIAs使用中的抗血小板治疗策略抗血小板治疗对于减少支架植入围手术期和术后血栓栓塞事件至关重要。一项针对儿童氯吡格雷抗血小板治疗的临床试验发现,对于0至24月龄的儿童,氯吡格雷的剂量低至0.2 mg·kg-1·d-1即可达到49%的平均血小板抑制水平,这相当于成人每日服用75 mg的效果[61]。Colby等[60]在使用血流导向装置治疗PIAs时总结了抗血小板治疗的经验,即术前每日给予5 mg/kg的阿司匹林和每日1 mg/kg的氯吡格雷;术后根据血栓弹力图和血小板抑制率动态调整阿司匹林和氯吡格雷的剂量;3个月以后,氯吡格雷的服用频率调整为每3天1次,同时阿司匹林维持至6个月,以确保抗栓治疗的稳定性和安全性。在儿童颅内动脉瘤的治疗中,支架及血流导向技术仍处于早期阶段。目前尚不清楚支架在患儿血管内的远期稳定性、长期潜在的血栓形成风险以及血管狭窄风险[60]。期待针对远期预后的大规模队列研究能够进一步阐明支架系统在儿童患者中的作用。
(三) 机械取栓治疗儿童AIS的时间窗关于成人AIS的临床试验表明,发病后再通治疗的最佳时间窗口为:静脉溶栓(tPA)应在4.5 h内开始,血管内机械取栓(MT)应在6 h内进行,但对于某些患者亚组,取栓治疗的时间窗可延长至24 h[62]。儿童MT的治疗时间窗可能超出成人已确立的时间范围,但尚缺乏高质量数据支持。侧支循环灌注在成人MT治疗决策中起重要作用,而对于儿童急性卒中,灌注成像也是可行的,但儿童的最佳半暗带阈值可能与成人有所不同[63]。尽管儿童相关数据较少,仍有大量报道显示,儿童在延长的时间窗口内成功实施取栓,甚至在延迟2~3 d后仍有成功的再通病例,尤其是后循环闭塞患儿,可能与其基底动脉闭塞期间的耐受性较好有关[64-65]。MT在儿童AIS中的应用日益增多,且越来越多的证据表明其安全性和有效性。“Save ChildS”的次轮研究表明,在症状出现后24 h的时间窗内进行儿童AIS取栓治疗似乎是安全的[65]。儿童脑卒中团队在选择患者和确定治疗时间窗时,必须考虑到儿童患者体型、解剖结构、侧支血管、影像学参数以及预期治疗结果。此外,儿童AIS的不同病因和合并症也需要纳入考虑,这些因素可能影响MT的安全性和有效性。
四、展望随着儿童脑血管病发病率的逐渐上升,依托区域儿童医学中心建立儿童脑血管病专业团队显得尤为重要。这一团队不仅能够为患儿提供更为专业和及时的诊疗服务,还能在预防、早期识别和治疗方面发挥关键作用。未来,儿童脑血管病团队应包括多学科专家,如神经外科医师、神经介入医师、神经内科医师、康复医师、营养师和心理医师,以确保综合性和个性化的治疗方案。此外,建立区域儿童脑血管病专业团队也有助于推动科研与临床实践的结合,通过数据收集与分析,优化治疗策略,提升治疗效果。同时,团队可通过举办培训和交流活动,提升医疗人员的专业素养和技术水平,增强公众对儿童脑血管病的认知与重视程度。最终,区域儿童脑血管病专业团队的建立将为改善患儿预后、提升生活质量做出重要贡献。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Ferriero DM, Fullerton HJ, Bernard TJ, et al. Management of stroke in neonates and children:a scientific statement from the American Heart Association/American Stroke Association[J]. Stroke, 2019, 50(3): e51-e96. DOI:10.1161/STR.0000000000000183 |
| [2] |
Fuentes A, Deotto A, Desrocher M, et al. Determinants of cognitive outcomes of perinatal and childhood stroke: a review[J]. Child Neuropsychol, 2016, 22(1): 1-38. DOI:10.1080/09297049.2014.969694 |
| [3] |
Fraser S, Levy SM, Moreno A, et al. Risk factors for pediatric ischemic stroke and intracranial hemorrhage: a national electronic health record based study[J]. Heliyon, 2024, 10(10): e31124. DOI:10.1016/j.heliyon.2024.e31124 |
| [4] |
Jeong G, Lim BC, Chae JH. Pediatric stroke[J]. J Korean Neurosurg Soc, 2015, 57(6): 396-400. DOI:10.3340/jkns.2015.57.6.396 |
| [5] |
GBD 2016 Headache Collaborators. Global, regional, and national burden of migraine and tension-type headache, 1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2018, 17(11): 954-976. DOI:10.1016/S1474-4422(18)30322-3 |
| [6] |
GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol, 2021, 20(10): 795-820. DOI:10.1016/S1474-4422(21)00252-0 |
| [7] |
Lasjaunias P, Rodesch G, Terbrugge K, et al. Vein of Galen aneurysmal malformations.report of 36 cases managed between 1982 and 1988[J]. Acta Neurochir (Wien), 1989, 99(1/2): 26-37. DOI:10.1007/BF01407773 |
| [8] |
Rodesch G, Malherbe V, Alvarez H, et al. Nongalenic cerebral arteriovenous malformations in neonates and infants.Review of 26 consecutive cases[J]. Childs Nerv Syst, 1995, 11(4): 231-241. DOI:10.1007/BF00277659 |
| [9] |
Saleh E, Dawson RC3rd. Endovascular management of pediatric aneurysms[J]. Neuroradiol J, 2011, 24(5): 693-698. DOI:10.1177/197140091102400505 |
| [10] |
Gralla J, Brekenfeld C, Schmidli J, et al. Internal carotid artery aneurysm with life-threatening hemorrhages in a pediatric patient: endovascular treatment options[J]. J Endovasc Ther, 2004, 11(6): 734-738. DOI:10.1583/1308R.1 |
| [11] |
Irazuzta J, Sullivan KJ. Hyperacute therapies for childhood stroke: a case report and review of the literature[J]. Neurol Res Int, 2010, 2010: 497326. DOI:10.1155/2010/497326 |
| [12] |
Sun LR, Harrar D, Drocton G, et al. Mechanical thrombectomy for acute ischemic stroke: considerations in children[J]. Stroke, 2020, 51(10): 3174-3181. DOI:10.1161/STROKEAHA.120.029698 |
| [13] |
Winkler EA, Kim CN, Ross JM, et al. A single-cell Atlas of the normal and malformed human brain vasculature[J]. Science, 2022, 375(6584): eabi7377. DOI:10.1126/science.abi7377 |
| [14] |
Lv XL, Jiang CH, Wang J. Pediatric intracranial arteriovenous shunts: advances in diagnosis and treatment[J]. Eur J Paediatr Neurol, 2020, 25: 29-39. DOI:10.1016/j.ejpn.2019.12.025 |
| [15] |
Suh DC, Alvarez H, Bhattacharya JJ, et al. Intracranial haemorrhage within the first two years of life[J]. Acta Neurochir (Wien), 2001, 143(10): 997-1004. DOI:10.1007/s007010170004 |
| [16] |
Engel ER, Wusik K, Bright P, et al. Prevalence and predictors of hereditary hemorrhagic telangiectasia and capillary-malformation arteriovenous malformation syndrome among children with neurovascular malformations[J]. J Pediatr, 2024, 264: 113761. DOI:10.1016/j.jpeds.2023.113761 |
| [17] |
向永军, 王杭州, 杨天权, 等. 儿童幕上脑动静脉畸形破裂出血急性期分阶段手术的疗效分析[J]. 临床小儿外科杂志, 2023, 22(9): 881-884. Xiang YJ, Wang HZ, Yang TQ, et al. Staged surgery for supratentorial arteriovenous malformation rupture in children during acute phase[J]. J Clir Ped Sur, 2023, 22(9): 881-884. DOI:10.3760/cma.j.cn101785-202207045-016 |
| [18] |
White AJ, Marmor I, Peacock KM, et al. Brain abscess and stroke in children and adults with hereditary hemorrhagic telangiectasia: analysis of a large national claims database[J]. Neurology, 2023, 100(23): e2324-e2330. DOI:10.1212/WNL.0000000000207269 |
| [19] |
See AP, Smith ER. Management of pediatric intracranial arteriovenous malformations[J]. J Korean Neurosurg Soc, 2024, 67(3): 289-298. DOI:10.3340/jkns.2024.0027 |
| [20] |
Umansky D, Corn BW, Strauss I, et al. Combined treatment approach to cerebral arteriovenous malformation in pediatric patients: stereotactic radiosurgery to partially Onyx-embolized AVM[J]. Childs Nerv Syst, 2018, 34(11): 2269-2274. DOI:10.1007/s00381-018-3854-2 |
| [21] |
Stracke CP, Schwindt W, Meyer L, et al. Endovascular treatment of spinal AVM: report of two cases with transvenous approach in combination with retrograde pressure cooker technique[J]. Neuroradiology, 2023, 65(5): 961-968. DOI:10.1007/s00234-023-03132-x |
| [22] |
Zhang G, Zhu SY, Wu P, et al. The transvenous pressure cooker technique: a treatment for brain arteriovenous malformations[J]. Interv Neuroradiol, 2017, 23(2): 194-199. DOI:10.1177/1591019916682357 |
| [23] |
de Castro-Afonso LH, Nakiri GS, Oliveira RS, et al. Curative embolization of pediatric intracranial arteriovenous malformations using Onyx: the role of new embolization techniques on patient outcomes[J]. Neuroradiology, 2016, 58(6): 585-594. DOI:10.1007/s00234-016-1666-1 |
| [24] |
Wang A, Mandigo GK, Feldstein NA, et al. Curative treatment for low-grade arteriovenous malformations[J]. J Neurointerv Surg, 2020, 12(1): 48-54. DOI:10.1136/neurintsurg-2019-015115 |
| [25] |
Rodriguez-Calienes A, Saal-Zapata G, Borjas-Calderón NF, et al. Curative embolization for pediatric Spetzler-Martin grade III cerebral arteriovenous malformations[J]. World Neurosurg, 2022, 160: e494-e500. DOI:10.1016/j.wneu.2022.01.051 |
| [26] |
Tang J, Li LS, Zhou YD, et al. Embolization of midbrain arteriovenous malformation fed by the artery of Percheron in a child, the first case report and literature review[J]. Childs Nerv Syst, 2023, 39(9): 2527-2532. DOI:10.1007/s00381-023-05978-1 |
| [27] |
Meling TR, Patet G. What is the best therapeutic approach to a pediatric patient with a deep-seated brain AVM?[J]. Neurosurg Rev, 2019, 42(2): 409-416. DOI:10.1007/s10143-019-01101-8 |
| [28] |
Yue JK, Chang D, Caton MTJr, et al. The hybrid operative suite with intraoperative biplane rotational angiography in pediatric cerebrovascular neurosurgery: utility and lessons learned[J]. Pediatr Neurosurg, 2022, 57(4): 245-259. DOI:10.1159/000524875 |
| [29] |
Nam SM, Jang D, Wang KC, et al. Characteristics and treatment outcome of intracranial aneurysms in children and adolescents[J]. J Korean Neurosurg Soc, 2019, 62(5): 551-560. DOI:10.3340/jkns.2019.0140 |
| [30] |
Kim M, Lee HS, Lee S, et al. Pediatric intracranial aneurysms: favorable outcomes despite rareness and complexity[J]. World Neurosurg, 2019, 125: e1203-e1216. DOI:10.1016/j.wneu.2019.01.280 |
| [31] |
Yasin JT, Wallace AN, Madaelil TP, et al. Treatment of pediatric intracranial aneurysms: case series and meta-analysis[J]. J Neurointerv Surg, 2019, 11(3): 257-264. DOI:10.1136/neurintsurg-2018-014001 |
| [32] |
Deora H, Rao KVLN, Somanna S, et al. Surgically managed pediatric intracranial aneurysms: how different are they from adult intracranial aneurysms?[J]. Pediatr Neurosurg, 2017, 52(5): 313-317. DOI:10.1159/000477815 |
| [33] |
de Aguiar GB, Ozanne A, Elawady A, et al. Intracranial aneurysm in pediatric population: a single-center experience[J]. Pediatr Neurosurg, 2022, 57(4): 270-278. DOI:10.1159/000524523 |
| [34] |
Saraf R, Shrivastava M, Siddhartha W, et al. Intracranial pediatric aneurysms: endovascular treatment and its outcome[J]. J Neurosurg Pediatr, 2012, 10(3): 230-240. DOI:10.3171/2012.5.PEDS1210 |
| [35] |
Ostergaard JR. Aetiology of intracranial saccular aneurysms in childhood[J]. Br J Neurosurg, 1991, 5(6): 575-580. DOI:10.3109/02688699109002879 |
| [36] |
Sluzewski M, Brilstra EH, van Rooij WJ, et al. Bilateral vertebral artery balloon occlusion for giant vertebrobasilar aneurysms[J]. Neuroradiology, 2001, 43(4): 336-341. DOI:10.1007/s002340000498 |
| [37] |
Eddleman C, Nikas D, Shaibani A, et al. HydroCoil embolization of a ruptured infectious aneurysm in a pediatric patient: case report and review of the literature[J]. Childs Nerv Syst, 2007, 23(6): 707-712. DOI:10.1007/s00381-006-0264-7 |
| [38] |
Vargas SA, Diaz C, Herrera DA, et al. Intracranial aneurysms in children: the role of stenting and Flow-Diversion[J]. J Neuroimaging, 2016, 26(1): 41-45. DOI:10.1111/jon.12305 |
| [39] |
Eraky AM, Feller C, Tolba H, et al. Flow diverter stenting for intracranial aneurysms in the pediatric population: two case reports and literature review[J]. J Cerebrovasc Endovasc Neurosurg, 2024, 26(1): 58-64. DOI:10.7461/jcen.2023.E2023.04.001 |
| [40] |
Chen K, Shi Y, Bao KY, et al. Pediatric intracranial aneurysms: endovascular treatment[J]. Asian J Surg, 2023, 46(11): 5112-5113. DOI:10.1016/j.asjsur.2023.06.100 |
| [41] |
Fry L, Brake A, Heskett CA, et al. Endovascular management of pediatric traumatic intracranial pseudoaneurysms: a systematic review and case series[J]. World Neurosurg, 2023, 176: 213-226. DOI:10.1016/j.wneu.2023.04.028 |
| [42] |
Alawi A, Edgell RC, Elbabaa SK, et al. Treatment of cerebral aneurysms in children: analysis of the Kids' Inpatient Database[J]. J Neurosurg Pediatr, 2014, 14(1): 23-30. DOI:10.3171/2014.4.PEDS13464 |
| [43] |
Bhogal P, Pérez MA, Wendl C, et al. Paediatric aneurysms-Review of endovascular treatment strategies[J]. J Clin Neurosci, 2017, 45: 54-59. DOI:10.1016/j.jocn.2017.08.009 |
| [44] |
Saini V, Guada L, Yavagal DR. Global epidemiology of stroke and access to acute ischemic stroke interventions[J]. Neurology, 2021, 97: S6-S16. DOI:10.1212/WNL.0000000000012781 |
| [45] |
Lehman LL, Khoury JC, Taylor JM, et al. Pediatric stroke rates over 17 years: report from a population-based study[J]. J Child Neurol, 2018, 33(7): 463-467. DOI:10.1177/0883073818767039 |
| [46] |
Pero G, Ruggieri F, Macera A, et al. Endovascular treatment of acute ischemic stroke in childhood: a comprehensive literature review based on the experience of a single center[J]. Eur J Radiol Open, 2023, 11: 100528. DOI:10.1016/j.ejro.2023.100528 |
| [47] |
Krishnamurthi RV, deVeber G, Feigin VL, et al. Stroke prevalence, mortality and disability-adjusted life years in children and youth aged 0-19 years: data from the global and regional burden of stroke 2013[J]. Neuroepidemiology, 2015, 45(3): 177-189. DOI:10.1159/000441087 |
| [48] |
Nogueira RG, Haussen DC, Liebeskind DS, et al. Clinical effectiveness of endovascular stroke treatment in the early and extended time windows[J]. Int J Stroke, 2022, 17(4): 389-399. DOI:10.1177/17474930211005740 |
| [49] |
Powers WJ, Derdeyn CP, Biller J, et al. 2015 American Heart Association/American Stroke Association focused update of the 2013 guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2015, 46(10): 3020-3035. DOI:10.1161/STR.0000000000000074 |
| [50] |
Sporns PB, Kemmling A, Lee S, et al. A prospective multicenter registry on feasibility, safety, and outcome of endovascular recanalization in childhood stroke (save ChildS pro)[J]. Front Neurol, 2021, 12: 736092. DOI:10.3389/fneur.2021.736092 |
| [51] |
Sporns PB, Sträter R, Minnerup J, et al. Feasibility, safety, and outcome of endovascular recanalization in childhood stroke: the save ChildS study[J]. JAMA Neurol, 2020, 77(1): 25-34. DOI:10.1001/jamaneurol.2019.3403 |
| [52] |
Bhatia K, Kortman H, Blair C, et al. Mechanical thrombectomy in pediatric stroke: systematic review, individual patient data meta-analysis, and case series[J]. J Neurosurg Pediatr, 2019, 24(5): 558-571. DOI:10.3171/2019.5.PEDS19126 |
| [53] |
Satti S, Chen J, Sivapatham T, et al. Mechanical thrombectomy for pediatric acute ischemic stroke: review of the literature[J]. J Neurointerv Surg, 2017, 9(8): 732-737. DOI:10.1136/neurintsurg-2016-012320 |
| [54] |
Cobb MIPH, Laarakker AS, Gonzalez LF, et al. Endovascular therapies for acute ischemic stroke in children[J]. Stroke, 2017, 48(7): 2026-2030. DOI:10.1161/STROKEAHA.117.016887 |
| [55] |
Flores-Milan G, Rainone GJ, Peto I, et al. Timing of embolization, radiosurgery, and resection of arteriovenous malformations in pediatric patients: a retrospective, descriptive study[J]. World Neurosurg, 2024, 190: e488-e495. DOI:10.1016/j.wneu.2024.07.161 |
| [56] |
Blauwblomme T, Bourgeois M, Meyer P, et al. Long-term outcome of 106 consecutive pediatric ruptured brain arteriovenous malformations after combined treatment[J]. Stroke, 2014, 45(6): 1664-1671. DOI:10.1161/STROKEAHA.113.004292 |
| [57] |
Deng ZH, Chen Y, Ma L, et al. Long-term outcomes and prognostic predictors of 111 pediatric hemorrhagic cerebral arteriovenous malformations after microsurgical resection: a single-center experience[J]. Neurosurg Rev, 2021, 44(2): 915-923. DOI:10.1007/s10143-019-01210-4 |
| [58] |
Iv M, Choudhri O, Dodd RL, et al. High-resolution 3D volumetric contrast-enhanced MR angiography with a blood pool agent (ferumoxytol) for diagnostic evaluation of pediatric brain arteriovenous malformations[J]. J Neurosurg Pediatr, 2018, 22(3): 251-260. DOI:10.3171/2018.3.PEDS17723 |
| [59] |
López Álvarez JM, Pérez Quevedo O, Santana Cabrera L, et al. Vascular ultrasound in pediatrics: estimation of depth and diameter of jugular and femoral vessels[J]. J Ultrasound, 2017, 20(4): 285-292. DOI:10.1007/s40477-017-0272-3 |
| [60] |
Colby GP, Jiang BW, Bender MT, et al. Pipeline-assisted coil embolization of a large middle cerebral artery pseudoaneurysm in a 9-month-old infant: experience from the youngest flow diversion case[J]. J Neurosurg Pediatr, 2018, 22(5): 532-540. DOI:10.3171/2018.6.PEDS18165 |
| [61] |
Cobb MIPH, Zomorodi AR, Hauck EF, et al. Optimal pediatric dosing of anti-platelet agents for pipeline stent embolization-a case report and review of the literature[J]. Childs Nerv Syst, 2017, 33(4): 685-690. DOI:10.1007/s00381-016-3311-z |
| [62] |
Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct[J]. N Engl J Med, 2018, 378(1): 11-21. DOI:10.1056/NEJMoa1706442 |
| [63] |
Lee S, Heit JJ, Albers GW, et al. Neuroimaging selection for thrombectomy in pediatric stroke: a single-center experience[J]. J Neurointerv Surg, 2019, 11(9): 940-946. DOI:10.1136/neurintsurg-2019-014862 |
| [64] |
Wilkinson DA, Pandey AS, Garton HJ, et al. Late recanalization of basilar artery occlusion in a previously healthy 17-month-old child[J]. J Neurointerv Surg, 2018, 10(7): e17. DOI:10.1136/neurintsurg-2017-013277.rep |
| [65] |
Sporns PB, Psychogios MN, Straeter R, et al. Clinical diffusion mismatch to select pediatric patients for embolectomy 6 to 24 hours after stroke: an analysis of the save ChildS study[J]. Neurology, 2021, 96(3): e343-e351. DOI:10.1212/WNL.0000000000011107 |
 2025, Vol. 24
2025, Vol. 24


