儿童急性胰腺炎与成人急性胰腺炎有着较大的区别,常见病因主要为感染、胆胰管系统疾病、外伤、药物诱导等,而成人急性胰腺炎的主要病因为酗酒及胆石症。相对于成人急性胰腺炎,儿童急性胰腺炎绝大部分病例为轻症,总体预后良好。但培门冬酶相关胰腺炎多见于肿瘤患儿,多伴有化疗后的骨髓抑制,抗感染能力较弱,一旦发展为重症,病情进展快,病死率极高。现报告昆明市儿童医院收治的1例培门冬酶相关重症胰腺炎患儿的诊治经验。
患儿, 男,13岁,因“确诊急性淋巴细胞白血病6月余”入院。患儿6个月前骨髓病理学报告提示“急性淋巴细胞白血病骨髓象可能”;流式细胞学结果符合急性B淋巴细胞白血病/淋巴母细胞淋巴瘤免疫表型;融合基因筛查:E2A/PBX1基因、TCF3-PBX1基因阳性。诊断为“急性淋巴细胞白血病(中危组E2A/PBX1基因、TCF3-PBX1基因阳性)”。按中国儿童白血病协作组2018(Chinese Children Leukemia Group-Aacute lymphoblastic leukemia-2018, CCLG-ALL-2018)方案规律化疗,本次入院前已完成长春地辛、柔红霉素、培门冬酶和强的松(vindesine, daunorubicin, pegaspargase, prednisone, VDLP)方案化疗1周期,环磷酰胺、阿糖胞苷、巯嘌呤、培门冬酶(cyclophosphamide, cytarabine, mercaptopurine, pegaspargase, CAML)方案化疗2周期,大剂量甲氨喋呤、长春新碱、地塞米松(high dose methotrexate, vincristine, dexamethasone, HD-MTX+VD)方案化疗5周期。初次化疗后第15天微小残留病变(minimal residual disease, MRD)回报提示小于0.01%,第33天MRD提示完全缓解。患儿第2周期化疗开始前出现腹痛,血清淀粉酶及脂肪酶升高,腹部CT提示胰头周围有少许渗出,考虑“急性胰腺炎”,遂予禁食,生长抑素3.5 μg·kg-1·h-1持续泵入抑制胰腺组织分泌胰酶,乌司他丁抑制胰酶活性,为快速控制腹腔感染及保证患儿化疗安全有序进行,先后予头孢哌酮钠舒巴坦钠、美罗培南、哌拉西林钠他唑巴坦抗感染治疗,患儿胰腺炎好转后继续按CAML方案化疗,第3~7周期化疗进行顺利。
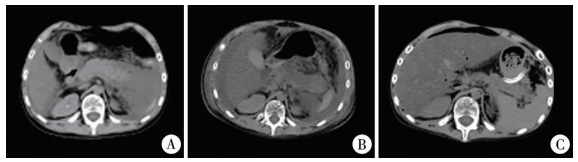
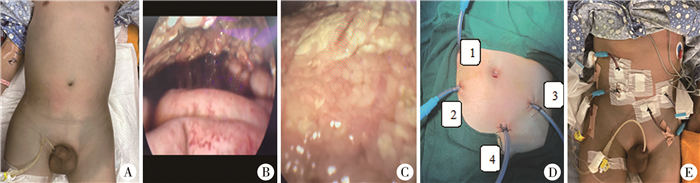
此次入院后第2天即予延迟强化方案:地塞米松+长春地辛+多柔比星+培门冬酶化疗,入院后第16天患儿诉腹痛,查血清脂肪酶及淀粉酶升高(淀粉酶:208 U/L,脂肪酶:211.1 U/L-),彩超及腹部CT提示胰腺炎可能(图 1),遂予禁食,美罗培南抗感染,甲泼尼龙琥珀酸钠抗炎,生长抑素抑制胰酶分泌,乌司他丁抑制胰酶活性及静脉营养支持等治疗。但患儿胰腺炎呈进行性加重,入院后第21天患儿腹胀、腹痛症状较前明显加重,查体见腹壁及大腿处皮肤青紫,出现Grey Turner征(图 2),全腹压痛,腹肌紧张,腹水征阳性。复查腹部CT(图 1)示:①胰腺炎并腹膜炎,较前加重;②腹腔大量积液,较前增多;③腹壁软组织肿胀。在全身麻醉下急诊行腹腔镜下胰腺周围坏死组织清除并置管引流术。术中于脐环下方穿刺入腹,注入CO2建立气腹,此处置5 mm Trocar并放入腹腔镜,腹腔镜直视下于左下腹、右侧肋缘下、右下腹、中下腹各置入5 mm Trocar一个,放入操作器械。探查见腹腔内有大量淡血性液体,大网膜见大量皂化斑,局部粘连,肝、胆囊、胃、结肠未见明显异常,小肠少许点状充血(图 2)。于大网膜无血管区切开后见胰腺体尾部坏死、发黑,术中诊断考虑“急性坏死性胰腺炎”,用大量生理盐水反复冲洗胰腺周围及腹腔,至引流液颜色清亮,在胰腺体尾部周围、温氏孔、左结肠旁沟及盆腔各留置腹腔引流管1根,分别经右下腹、右侧肋缘下、左下腹、中下腹Trocar引出,手术过程顺利,术中出血约20 mL。术后诊断为急性坏死性胰腺炎,继续予美罗培南+万古霉素抗感染,生长抑素3.5 μg·kg-1·h-1抑制胰酶分泌,乌司他丁10万U/次(每8 h 1次)抑制胰酶活性及减轻炎症反应等治疗,患儿恢复顺利,腹胀、腹痛症状缓解,腹壁及大腿处皮肤青紫逐渐消退(图 2),血清淀粉酶及脂肪酶指标快速降至正常(术后第3天淀粉酶31 U/L,脂肪酶10 U/L),4根腹腔引流管每天予500 mL生理盐水持续滴注冲洗8天,腹腔冲洗液颜色由浑浊暗红色逐渐转至清亮淡黄色,引流量逐渐减少,术后第14天拔除左侧结肠旁沟及盆腔引流管,术后第17天拔除温氏孔引流管,术后第21天拔除胰体尾部周围引流管,术后第23天复查血清淀粉酶及脂肪酶正常(淀粉酶:38 U/L,脂肪酶:8.5 U/L),腹部CT示未见明显异常(图 1)。术后随访至今约1年,未出现胰腺炎及肿瘤复发、进展。
|
图 1 培门冬酶相关重症胰腺炎患儿术前及术后腹部CT结果 Fig.1 Preoperative and postoperative abdominal CT of a child with pegaspargase-associated severe pancreatitis 注 A:为入院后第16天腹部平扫CT片,见胰腺肿胀明显,胰尾部周围出现积液,腹腔积液不多;B:为手术当天术前腹部平扫CT片,见腹腔出现大量积液,胰腺密度不均,胰腺周围组织界限模糊;C:为术后第21天腹部平扫CT片,无明显腹腔积液,胰腺密度均匀,周围无积液,肿胀已缓解 |
|
图 2 培门冬酶相关重症胰腺炎患儿术中及术后图片 Fig.2 Intraoperative and postoperative images of a child with pegaspargase-associated severe pancreatitis 注 A:术前患儿腹胀明显,腹壁及大腿处皮肤青紫,出现Grey Turner征;B、C:腹腔镜探查见腹腔内有大量血性腹水,大网膜出现皂化斑,小肠点状充血;D:术中选取脐环下方为腔镜观察孔,右下腹及右侧肋缘下Trocar为术者主操作孔,左下腹及中下腹Trocar为一助操作孔。1号为温氏孔处腹腔引流管;2号为胰腺体尾部周围腹腔引流管;3号为左结肠旁沟处腹腔引流管;4号为盆腔引流管;E:术后第2天患儿腹胀明显缓解,腹壁及大腿处皮肤青紫较前明显消退 |
急性淋巴细胞白血病是儿童时期最常见的恶性肿瘤,单纯化疗的完全缓解率达90%以上,5年无事件生存率约80%[1-2]。左旋门冬酰胺酶作为联合化疗方案中的主要用药,其常见副反应有凝血功能障碍、过敏反应、肝肾功能损害、胰腺炎、血糖升高及胃肠道不适等。培门冬酶作为新一代左旋门冬酰胺酶,有着更低的免疫原性和更长的半衰期等优越性,但其相关性胰腺炎发生率为2% ~18%[3]。其发病机制可能是门冬酰胺酶过度分解门冬酰胺,导致人体蛋白合成重要脏器(如胰腺、肝脏等)损伤,进而诱发胰腺炎以及继发全身炎症反应综合征[4]。有研究表明,培门冬酶引起胰腺炎的原因与累计用量、剂型、年龄及急性淋巴细胞性白血病危险度无明显关系,但肥胖、使用抗酸药物及补充凝血酶原可能增加胰腺炎的发生风险[5-6]。虽然培门冬酶相关性胰腺炎绝大多数为非重症胰腺炎,经过停用培门冬酶,同时给予禁食、抗感染、质子泵抑制剂及生长抑素类药物等治疗后多可缓解,但重症胰腺炎患儿可能出现多器官衰竭,甚至死亡。一旦停用培门冬酶或化疗中断时间过长则会影响急性淋巴细胞白血病患儿的预后,故针对急性胰腺炎发生后再次安全使用培门冬酶仍是目前临床亟待解决的问题。本例患儿在第2周期化疗开始前就出现了轻型急性胰腺炎症状,经过保守治疗后很快得到缓解,后续顺利完成了第3~7周期化疗,但在第8周期化疗完成后却发生了急性重症胰腺炎,该病例的成功治疗经验可以为今后治疗培门冬酶相关胰腺炎提供一个较好的临床诊治思路。笔者认为,针对培门冬酶相关胰腺炎,一方面需要积极做好预防工作并有效治疗轻症患儿。首先在培门冬酶化疗期间应严格控制饮食,使用培门冬酶的前3天至停药后5天应选择低脂肪、低蛋白的清淡易消化的食物,停药后6天至2周逐渐过渡到正常饮食,停药后2周至1年应保持饮食稳定,严禁高脂饮食[7]。其次在化疗期间应密切观察患儿临床症状及体征,定期复查血清淀粉酶及脂肪酶,一旦发生胰腺炎应做到早发现、早诊断、早治疗,采用多学科协作模式治疗以减少相关并发症[8-9]。此外,对于8~15岁的肥胖高危患儿以及既往发生过胰腺炎的患儿,化疗期间给予奥曲肽肌肉注射,同时联合鼻空肠置管进行肠内低脂营养能有效预防患儿再次发生胰腺炎。
其次是提高重症患儿的治疗成功率,一旦患儿在化疗期间发生急性重症胰腺炎,早期也可以尝试B超引导下腹腔穿刺置管及冲洗引流进行外科干预,但这种方式存在引流部位不精确及冲洗不彻底的缺点,若患儿胰腺炎症状进一步加重,则需要接受手术治疗。相对于传统开腹手术,我们认为选择微创手术治疗有诸多优点:第一,这类患儿为肿瘤患儿,化疗后多合并骨髓抑制,易感染、易出血。传统开腹手术创伤大,出血多,术后腹腔感染、伤口感染难以控制,恢复较慢,会导致术后序贯化疗停顿时间长,影响患儿预后;而腹腔镜微创手术具有创伤小,出血少,视野好,坏死组织清除彻底,术后伤口感染发生率低,恢复较快,能在较短时间内进一步完成后续化疗。第二,微创手术探查时腹腔视野开阔,腹腔干扰少,肠功能恢复快,术后发生粘连性肠梗阻的概率相对较低;第三,微创手术比传统开腹手术切口小,术后疼痛轻,愈合后切口更美观,有利于减少患儿心理层面的创伤。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 万成亮负责论文写作、病例资料整理;白强负责写作指导及修改;张传勃、方辉、黄纯锋负责病例资料收集及随访;郑陈军负责图片处理、英文翻译;海波参与论文写作、修改及指导
| [1] |
马军, 吴敏媛, 竺晓凡, 等. 第25届美国儿童血液肿瘤学术会议简介[J]. 中国小儿血液与肿瘤杂志, 2012, 17(3): 142-144. Ma J, Wu MY, Zhu XF, et al. Introduction to the 25th American conference on pediatric hematology and oncology[J]. J China Pediatr Blood Cancer, 2012, 17(3): 142-144. |
| [2] |
Ishii E. Hematological disorders in children: pathogenesis and treatment[M]. Singapore: Springer, 2017: 33-60.
|
| [3] |
石苇, 谢晓恬. 门冬酰胺酶相关儿童急性胰腺炎诊治研究[J]. 中国小儿血液与肿瘤杂志, 2016, 21(6): 310-314. Shi W, Xie XT. Diagnosis and treatment of children with asparaginase associated pancreatitis[J]. J China Pediatr Blood Cancer, 2016, 21(6): 310-314. DOI:10.3969/j.issn.1673-5323.2016.06.007 |
| [4] |
Raja RA, Schmiegelow K, Albertsen BK, et al. Asparaginase-associated pancreatitis in children with acute lymphoblastic leukaemia in the NOPHO ALL2008 protocol[J]. Br J Haematol, 2014, 165(1): 126-133. DOI:10.1111/bjh.12733 |
| [5] |
陈辉, 陈森. 儿童急性淋巴细胞白血病并发急性胰腺炎的临床特点分析[J]. 中国肿瘤临床, 2020, 47(13): 666-669. Chen H, Chen S. Clinical characteristics of children with acute lymphoblastic leukemia presenting with secondary acute pancreatitis[J]. Chin J Clin Oncol, 2020, 47(13): 666-669. DOI:10.3969/j.issn.1000-8179.2020.13.314 |
| [6] |
Wolthers BO, Frandsen TL, Patel CJ, et al. Trypsin-encoding PRSS1-PRSS2 variations influence the risk of asparaginase-associated pancreatitis in children with acute lymphoblastic leukemia: a Ponte di Legno toxicity working group report[J]. Haematologica, 2019, 104(3): 556-563. DOI:10.3324/haematol.2018.199356 |
| [7] |
刘晨曦, 沈树红. 门冬酰胺酶相关性胰腺炎的研究进展[J]. 国际儿科学杂志, 2020, 47(3): 180-183. Liu CX, Shen SH. Progress on asparaginase-associated pancreatitis[J]. Int J Pediatr, 2020, 47(3): 180-183. DOI:10.3760/cma.j.issn.1673-4408.2020.03.008 |
| [8] |
高琴丽, 陈彩, 乐少华, 等. 儿童急性淋巴细胞白血病化疗合并培门冬酶相关胰腺炎临床分析[J]. 中国小儿血液与肿瘤杂志, 2021, 26(5): 285-288, 293. Gao QL, Chen C, Yue SH, et al. Clinical analysis of PEG-asparaginase associated pancreatitis in children with acute lymphoblastic leukemia[J]. J China Pediatr Blood Cancer, 2021, 26(5): 285-288, 293. DOI:10.3969/j.issn.1673-5323.2021.05.006 |
| [9] |
Frontiers Editorial Office. Retraction: peg-asparaginase-associated pancreatitis in chemotherapy-treated pediatric patients: a 5-year retrospective study[J]. Front Oncol, 2021, 11: 709636. DOI:10.3389/fonc.2021.709636 |
 2025, Vol. 24
2025, Vol. 24


