泌尿系结石是泌尿外科常见疾病之一,按结石发生的部位可以分为上尿路结石(肾结石、输尿管结石)和下尿路结石(膀胱结石和尿道结石)。儿童泌尿系结石大部分为上尿路结石,发病率为1/1 700~1/1 000,占所有泌尿系结石的2% ~2.5%,且以每年4% ~10%的速度增长,其发病率的增加与饮食结构的改变、久坐的生活习惯以及影像检查技术的发展相关[1-5]。泌尿系结石患儿术后5年复发率为26% ~55%,且复发率呈逐年增长趋势[4, 6]。高复发率意味着儿童需面临多次手术和麻醉的风险,增加了对生长发育的影响及经济负担,有效预防复发有助于降低这些风险[7]。本研究旨在探讨儿童上尿路结石复发的影响因素,并建立列线图模型预测其复发风险。
资料与方法 一、临床资料本研究为回顾性研究,选取2014年6月至2020年12月期间于首都医科大学附属北京友谊医院接受手术治疗的218例汉族上尿路结石患儿为研究对象。纳入标准:①符合上尿路结石(肾结石、输尿管结石)诊断;②接受经尿道输尿管镜/软镜、经皮肾镜碎石手术;③年龄≤14岁;④汉族。排除标准:①临床资料不完整;②由明确的单基因病导致的上尿路结石,如胱氨酸尿症、原发性高草酸尿症、Dent病、腺嘌呤磷酸核糖转移酶缺乏等;③失访。本研究获得首都医科大学附属北京友谊医院伦理委员会审批通过(2018-P2-039-02),患儿及其家属均知情同意。
二、研究方法身体质量指数(body mass index, BMI)根据2000年美国疾病预防控制中心2~18岁儿童生长标准曲线图进行计算(2岁以下的患儿同样按照此表应用)[8]。将不同年龄段和性别的患儿与同年龄同性别人群参照值比较,体重指数低于第5百分位数者判定为消瘦,体重指数高于第85百分位数者判定为肥胖,其余判定为正常。通过CT非增强序列(平扫)评估:结石密度用平均CT值表示[亨氏单位(Hounsfield unit,Hu)],结石负荷被定义为结石的三维体积,具体计算方法为:通过Lmax[结石最大长径(cm)]×Wmax[与Lmax垂直的最大宽径(cm)]×0.785获得,由结石负荷与结石密度相乘获得结石质量(计量单位Hu·cm2)[9]。
解剖因素异常:患儿合并肾盂输尿管连接处狭窄、输尿管膀胱连接处狭窄、原发性巨输尿管、神经源性膀胱、膀胱输尿管反流或狭窄、马蹄肾及重复肾等引起尿路积水。治愈标准:患儿经外科腔内手术治疗,术后第4周复查泌尿系彩超、腹部平片、泌尿系CT评估无结石残留。随访方案:术后每6个月进行一次常规随访,通过结石相关临床表现(腹痛、血尿、恶心等)、泌尿系超声或泌尿系CT等影像学检查明确术后结石是否复发。复发标准:患儿经外科手术治愈后,经泌尿系彩超、泌尿系CT等影像学检查提示术侧存在新发结石。
三、统计学处理采用SPSS 26.0进行统计分析。计数分类资料使用频数、构成比表示,服从正态分布的计量资料使用x±s表示。使用Kaplan-Meier法绘制复发风险曲线。采用Cox回归模型进行单因素及多因素分析,筛选上尿路结石患儿术后复发的危险因素。使用R 4.0.3构建儿童上尿路结石术后复发的列线图模型。通过一致性指数(consistency index, C-index)评价列线图的区分度,C-index分值越高表示列线图区分度越好;采用受试者操作特征曲线下面积(area under curve, AUC)评价列线图的预测效能,并通过校准图评价列线图预测效能的准确度。P < 0.05为差异有统计学意义。
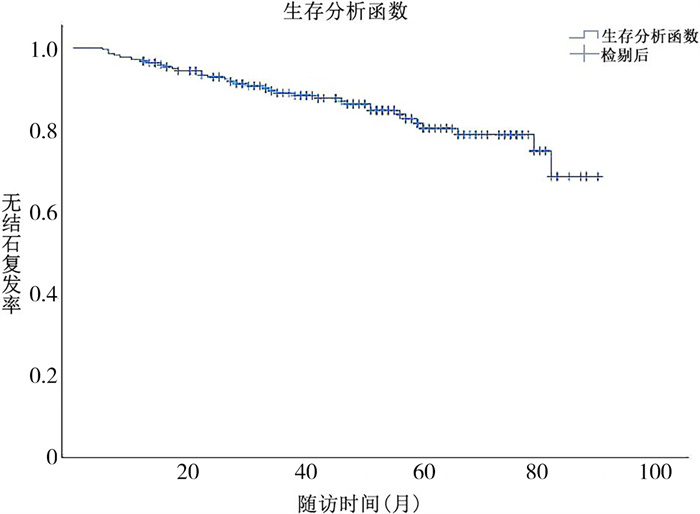
结果218例中,男157例、女61例。年龄(4.1±3.4)岁,随访(48.3±21.8)个月。随访期间35例患儿出现结石复发,总复发率为16.1%(35/218),见图 1。
|
图 1 上尿路结石患儿结石复发风险的生存曲线 Fig.1 Survival curve of stone recurrence risk in children with upper urinary tract stones. |
Cox单因素回归分析结果显示,不同年龄、BMI、尿pH值、术前尿白细胞及结石质量患儿的复发风险的差异有统计学意义(P<0.05);而不同性别、结石部位、结石侧别、结石数量、临床表现、术前尿培养、术后发热、解剖因素、结石家族史患儿的复发风险差异没有统计学意义(P>0.05)。见表 1。
| 表 1 218例上尿路结石患儿结石复发影响因素的单因素分析 Table 1 Univariable analysis of factors influencing stone recurrence in 218 children with upper urinary tract stones |
|
|
将Cox单因素回归分析中P<0.05的变量纳入多因素分析,Cox多因素回归分析结果显示年龄>3岁、肥胖、尿pH值6~7、术前尿白细胞阳性及结石质量>2 000 Hu·cm2是结石复发的独立危险因素(P<0.05)。见表 2。
| 表 2 218例上尿路结石患儿结石复发影响因素的多因素分析 Table 2 Multivariable analysis of factors influencing stone recurrence in 218 children with upper urinary tract stones |
|
|
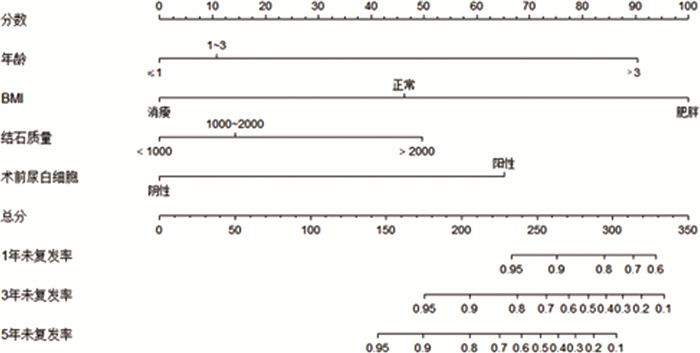
因多因素Cox回归模型中尿pH值<6对结石复发风险影响不如尿pH值6~7显著,这与尿pH值对结石影响的原理不符,可能存在偏倚,故不将其纳入列线图预测模型。模型中独立预测因素包括年龄、BMI、术前尿白细胞及结石质量,上述因素每个类别的分数相加得出总分,向下投射与1年、3年、5年未复发率坐标轴相交点即为各时间点的结石未复发率,从而得出相应时间点的结石复发率。其中一致性指数(C-index)为0.853,对结石复发具有较好的预测价值。1年未复发率预测模型的AUC为0.98,3年未复发率预测模型的AUC为0.96,5年未复发率预测模型的AUC为0.84,显示该模型具有良好的预测性能(图 2)。
|
图 2 预测儿童上尿路结石术后复发风险的列线图模型 Fig.2 Nomogram model for predicting postoperative recurrence risk of upper urinary tract stones in children 注 BMI:身体质量指数 |
符合度使用校正曲线表示, 以Bootstrap(B=1 000)进行重复抽样, 获得儿童上尿路结石术后复发率的预测模型校准曲线, 结果显示1、3、5年校准曲线图中预测值概率与实际值概率均走形基本相近, 表明本预测模型的预测进展情况和实际进展情况具有良好的一致性。
讨论儿童泌尿系结石好发于中东、南亚、北非等地区,在发达国家中较为罕见,但流行病学研究发现,西方国家发病率也在增加[10]。我国暂无全国性流行病学研究报道,多为单中心报道。儿童泌尿系结石呈现发病率、复发率不断增加的趋势[4]。结石患儿接受影像学检查及手术干预的风险增大,这也使得结石患儿处于麻醉和辐射的潜在危害及继发的后遗症风险之中[7]。有研究表明,肾结石与心血管疾病、慢性肾病、骨折的发生存在关联[11]。因此在及时诊断和治疗儿童泌尿系结石的同时,降低其术后复发率尤为重要。
本研究中结石总复发率为16.1%,这一结果明显低于当前国外数据。Medairo等[7]的研究表明,41%患儿出现结石复发,中位随访时间为2.9年。该研究同样排除了单基因疾病引起的结石患儿,但该研究患儿年龄较大,年龄中位数为11.5岁,结石复发患儿平均BMI达70.7。同时该研究纳入不同人种,其中白人占81.5%,亚裔仅占2%,而在复发患儿中,白人占79.3%,无一例亚裔复发。Üntan等[12]对土耳其结石患儿随访(23.93 ± 7.16)个月,在122例术后无结石残留的患儿中,15%(18/122)出现结石复发,这一数据与本研究结果较为接近。
年龄是结石形成的重要影响因素,而目前发病率的增长与青少年患病增加相关[4]。高龄儿童饮食中钙摄入减少、含糖饮料摄入增加,是该年龄段结石发病率增加的原因,摄入充足的钙可以减少肠道对草酸的吸收,而含糖饮料的摄入增加会导致尿中草酸含量的增加,造成结石形成[3]。本中心患儿的年龄为(4.1±3.4)岁,显著低于国外研究[4, 7, 12]。
针对成年人群的研究表明,高BMI与高胰岛素血症相关,胰岛素介导的餐后尿钙水平增加、餐后尿草酸水平升高有利于含钙结石的形成,但该机制暂未在儿童中得到证实[13]。有研究发现肥胖儿童饮水较少、尿量减少、水合作用差、尿pH值更低、尿中尿酸和钙水平升高、枸橼酸和钾含量降低,这些因素都会导致尿液过饱和状态及结石晶体析出[14-16]。本研究中,消瘦患者复发风险较低,基本符合这一结果。但也有研究发现,肥胖与结石复发并无显著相关[12]。美国的研究数据表明,来自太平洋西部(加利福尼亚州)、南部(田纳西州、弗吉尼亚州)和中西部(密歇根州)的结石患儿,BMI≥第85百分位数者尿量较少、尿液中尿酸水平较高;而中西部(威斯康星州)的患儿,BMI>第95百分位数者在尿量减少及代谢指标上没有显著差异,这一数据的差异可能与环境及饮食习惯的差异相关[16]。
结石质量这一概念由本中心首次提出,本研究中,结石质量>2 000 Hu·cm2的患儿复发显著增加。在成年人群的研究中,结石负荷越大,术后复发风险越高[17]。结石密度反映的是结石的含钙量,可以将草酸钙结石与尿酸石、鸟粪石区分,也能进一步鉴别一水草酸钙和二水草酸钙结石,结石密度可用以预测结石成分[18]。通过将结石负荷和结石密度两种因素结合,结石质量更能反映出结石整体特性。
泌尿系感染是引起结石形成的主要原因之一,感染性结石(鸟粪石)的形成与产尿素酶细菌(如奇异变形杆菌、肺炎克雷伯菌、金黄色葡萄球菌、铜绿假单胞菌等)引起的肾脏感染相关,尿素酶降解尿素并促使氨和二氧化碳的形成,导致尿液碱化和磷酸盐形成[19-20]。至于感染对钙基结石的形成的影响,有研究发现细菌可以破坏排列在肾乳头的粘蛋白和糖胺聚糖层,促进草酸钙的形成[19];基于小鼠模型的研究发现,接受大肠杆菌所致泌尿系感染的小鼠肾脏更可能产生草酸钙沉积[21]。因此泌尿系感染在感染性结石和非感染性结石的形成过程中均发挥着重要作用。本研究中,术前尿白细胞阳性是结石术后复发的独立危险因素,而术前尿培养对患儿复发风险影响不显著,这可能与尿培养结果对采集的要求较高,容易受到污染有关。尿白细胞更能反映机体的感染状态。新疆学者阿力木江等[22]对学龄前肾结石患儿平均随访49个月,发现术前尿白细胞阳性的患儿复发风险较阴性患儿显著增加,这一结果与本研究相符。
尿pH值主要通过改变尿液过饱和状态影响结石形成,如调节尿酸、胱氨酸、磷酸盐等物质的结晶或溶解[23]。尿酸结石的形成需要满足:低pH值(pH≤5.5)、低尿量以及高尿酸。当尿液中胱氨酸浓度高于250 mg/L且尿pH值<6时,胱氨酸迅速沉淀[23]。当pH值>6时,磷酸钙的过饱和状态增加,溶解度降低,形成结石。有研究显示,在pH值4.0时,一水草酸结晶的大小、数量和总质量最大,而在pH值8.0时最小[24]。尿pH值不仅影响成核条件,同时改变枸橼酸、蛋白质等分子的电离作用,在碱性尿液中,结石形成抑制剂的电离作用最大,影响尿液过饱和状态[23]。当尿pH值在5.8~6之间时,磷酸镁铵以可溶性盐的状态存在,pH值>7.2时结晶开始析出。本研究发现术前尿pH值影响结石复发,尿pH值6~7患儿的复发风险高于尿pH值≤6患儿,这一结果与上述原理不符,原因有以下几点:第一,可能与术后结石预防药物的使用有关。本研究中,有17例结石患儿术后服用枸橼酸钾药物碱化尿液、补充尿枸橼酸浓度,抑制结石形成,其中58.9%(10/17) 尿pH值≤6。第二,我们仅记录了一次术前尿pH值结果,而尿pH值的变化受多种因素影响。正常的尿pH值在4.5~8之间,饮食、药物、昼夜节律变化等因素都会影响尿pH值[23]。第三,本研究没有收录结石成分信息,不同的尿pH值对不同结石成分影响存在差异,这些因素可能是引起该结果的主要原因。
本研究存在以下局限性。第一,本研究为回顾性研究,虽设定了严格的纳入及排除标准,但难以避免研究中的选择偏倚。第二,作为单中心研究,无法全面反映当前儿童结石复发的实际情况,但本次研究对象时间跨度较大,样本量大,且本中心作为国内儿童泌尿系结石较大的中心之一,本次研究对目前汉族儿童泌尿系结石复发现状及预防具有一定的临床意义。但在收集的病例资料中,没有涉及代谢指标、24 h尿量、既往结石病史等数据,这些因素在有些研究中已被证实可影响结石复发[10, 25]。对于此次构建的模型,还需进行调整以更好地预测复发情况。同时我们采用的BMI量表可能并不能合理地评估我国汉族儿童生长发育情况,而且本研究对小于2岁的儿童同样采用2~18岁儿童的量表,这些将对结果产生影响。
综上所述,儿童上尿路结石术后有较高的复发率。高龄、大结石质量、肥胖、术前尿白细胞阳性是结石复发的独立危险因素。列线图模型有助于更好地识别高危患儿和给予预防建议,以降低儿童上尿路结石复发率。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 李春明、李钧、唐磊负责研究的设计、实施和起草文章;唐磊、李春明、李海明进行病例数据收集和分析;赵方舟、李海明、赵有权、李春明、李钧负责研究设计,并对文章知识性内容进行审阅
| [1] |
Dalkılınç A, Demirkan H, Özçelik G. Multidimensional analysis of urinary stone diseases in pediatric patients[J]. Sisli Etfal Hastan Tip Bul, 2019, 53(1): 46-48. DOI:10.14744/SEMB.2019.32858 |
| [2] |
Li Y, Bayne D, Wiener S, et al. Stone formation in patients less than 20 years of age is associated with higher rates of stone recurrence: Results from the Registry for Stones of the Kidney and Ureter (ReSKU)[J]. J Pediatr Urol, 2020, 16(3): 373.e1-373.e6. DOI:10.1016/j.jpurol.2020.03.014 |
| [3] |
Hernandez JD, Ellison JS, Lendvay TS. Current trends, evaluation, and management of pediatric nephrolithiasis[J]. JAMA Pediatr, 2015, 169(10): 964-970. DOI:10.1001/jamapediatrics.2015.1419 |
| [4] |
Ingvarsdottir SE, Indridason OS, Palsson R, et al. Stone recurrence among childhood kidney stone formers: results of a nationwide study in Iceland[J]. Urolithiasis, 2020, 48(5): 409-417. DOI:10.1007/s00240-020-01179-6 |
| [5] |
Kahraman O, Dogan HS, Asci A, et al. Factors associated with the stone-free status after retrograde intrarenal surgery in children[J]. Int J Clin Pract, 2021, 75(10): e14667. DOI:10.1111/ijcp.14667 |
| [6] |
Lao M, Kogan BA, White MD, et al. High recurrence rate at 5-year followup in children after upper urinary tract stone surgery[J]. J Urol, 2014, 191(2): 440-444. DOI:10.1016/j.juro.2013.09.021 |
| [7] |
Medairos R, Paloian NJ, Pan A, et al. Risk factors for subsequent stone events in pediatric nephrolithiasis: a multi-institutional analysis[J]. J Pediatr Urol, 2022, 18(1): 26.e1-26.e9. DOI:10.1016/j.jpurol.2021.11.012 |
| [8] |
Kuczmarski RJ, Ogden CL, Guo SS, et al. 2000 CDC growth charts for the United States: methods and development[J]. Vital Health Stat 11, 2002(246): 1-190. |
| [9] |
张宇, 王小川, 赵方舟, 等. 儿童上尿路结石腔内手术后结石复发的影响因素分析[J]. 现代泌尿外科杂志, 2020, 25(12): 1079-1084. Zhang Y, Wang XC, Zhao FZ, et al. Risk factors of stone recurrence in children with upper urinary tract calculi after endourological surgery[J]. J Mod Urol, 2020, 25(12): 1079-1084. DOI:10.3969/j.issn.1009-8291.2020.12.008 |
| [10] |
Tekgül S, Stein R, Bogaert G, et al. European Association of Urology and European Society for Paediatric Urology guidelines on paediatric urinary stone disease[J]. Eur Urol Focus, 2022, 8(3): 833-839. DOI:10.1016/j.euf.2021.05.006 |
| [11] |
Ang AJS, Sharma AA, Sharma A. Nephrolithiasis: approach to diagnosis and management[J]. Indian J Pediatr, 2020, 87(9): 716-725. DOI:10.1007/s12098-020-03424-7 |
| [12] |
Üntan İ, Üntan S, Tosun H, et al. Metabolic risk factors and the role of prophylaxis in pediatric urolithiasis[J]. J Pediatr Urol, 2021, 17(2): 215.e1-215.e6. DOI:10.1016/j.jpurol.2020.12.003 |
| [13] |
Taylor EN, Stampfer MJ, Curhan GC. Obesity, weight gain, and the risk of kidney stones[J]. JAMA, 2005, 293(4): 455-462. DOI:10.1001/jama.293.4.455 |
| [14] |
Maffeis C, Tommasi M, Tomasselli F, et al. Fluid intake and hydration status in obese vs normal weight children[J]. Eur J Clin Nutr, 2016, 70(5): 560-565. DOI:10.1038/ejcn.2015.170 |
| [15] |
Cambareri GM, Giel DW, Bayne AP, et al. Do overweight and obese pediatric stone formers have differences in metabolic abnormalities compared with normal-weight stone formers?[J]. Urology, 2017, 101: 26-30. DOI:10.1016/j.urology.2016.09.011 |
| [16] |
Murphy MO, Erpelding SG, Chishti AS, et al. Influence of BMI in nephrolithiasis in an Appalachian pediatric population: a single-center experience[J]. J Pediatr Urol, 2018, 14(4): 330.e1-330.e8. DOI:10.1016/j.jpurol.2018.03.024 |
| [17] |
Ito K, Takahashi T, Somiya S, et al. Predictors of repeat surgery and stone-related events after flexible ureteroscopy for renal stones[J]. Urology, 2021, 154: 96-102. DOI:10.1016/j.urology.2021.02.025 |
| [18] |
Li X, Wang LP, Ou LL, et al. Revolution spectral CT for urinary stone with a single/mixed composition in vivo: a large sample analysis[J]. World J Urol, 2021, 39(9): 3631-3642. DOI:10.1007/s00345-021-03597-6 |
| [19] |
Bauza JL, Pieras EC, Grases F, et al. Urinary tract infection's etiopathogenic role in nephrolithiasis formation[J]. Med Hypotheses, 2018, 118: 34-35. DOI:10.1016/j.mehy.2018.06.002 |
| [20] |
谢华伟, 周辉霞, 马立飞, 等. 两种经脐腹腔镜肾盂成形术治疗儿童肾积水的疗效比较[J]. 中华小儿外科杂志, 2015, 36(10): 732-735. Xie HW, Zhou HX, Ma LF, et al. Comparison of two transumbilical laparoscopic pyeloplasties for treating ureteropelvic junction obstruction in children[J]. Chin J Pediatr Surg, 2015, 36(10): 732-735. DOI:10.3760/cma.j.issn.0253-3006.2015.10.004 |
| [21] |
Cole E, Shaikh N, Forster CS. The pediatric urobiome in genitourinary conditions: a narrative review[J]. Pediatr Nephrol, 2022, 37(7): 1443-1452. DOI:10.1007/s00467-021-05274-7 |
| [22] |
阿力木江·阿不都热西提, 张宁, 甘之录, 等. 学龄前儿童肾结石成分分析及结石复发相关危险因素分析[J]. 临床泌尿外科杂志, 2021, 36(2): 135-138. Abdurexiti ALMJ, Zhang N, Gan ZL, et al. Analysis of components and risk factors of stone recurrence in preschool children[J]. J Clin Urol, 2021, 36(2): 135-138. DOI:10.13201/j.issn.1001-1420.2021.02.012 |
| [23] |
Kanashiro A, Angerri O. Urinary pH relevance on urolithiasis management[J]. Arch Esp Urol, 2021, 74(1): 102-111. |
| [24] |
Carvalho M. Urinary pH in calcium oxalate stone formers: does it matter?[J]. J Bras Nefrol, 2018, 40(1): 6-7. DOI:10.1590/1678-4685-JBN-2018-00010002 |
| [25] |
Bao YG, Tu X, Wei Q. Water for preventing urinary stones[J]. Cochrane Database Syst Rev, 2020, 2(2): CD004292. DOI:10.1002/14651858.CD004292.pub4 |
 2025, Vol. 24
2025, Vol. 24


