原发性高草酸尿症(primary hyperoxaluria, PH)是一种罕见的常染色体隐性遗传病,其主要临床表现为肾结石、肾钙质沉着和肾功能不全[1-2]。PH是由于GRHPR基因突变所致,进而导致该基因编码的甘油酸还原酶/羟基乳酸还原酶(glycerate reductase/hydroxylactate reductase, GRHPR)活性降低。PH的临床表现与草酸的过量积累密切相关,草酸在肝脏中合成,并通过肾脏排泄。草酸与钙离子结合形成高度不溶性的钙草酸盐(calcium oxalate, CaOx),这些盐类可导致反复发作的尿路结石和肾钙质沉着症,从而导致肾脏损伤逐渐加重,最终可能发展为终末期肾病(end-stage kidney disease, ESKD)。PH根据致病基因的不同主要分为三种亚型:PH1、PH2和PH3。PH1是其中最常见且最严重的亚型,其特征为丙氨酸- 乙醛酸氨基转移酶(alanine-glyoxylate aminotransferase, AGT)缺乏引起大量草酸尿和严重肾脏损害,该酶的缺乏是由于其编码基因AGXT突变所致。PH2患儿的肾脏损害较PH1轻,肾损害的进展速度也相对较慢。PH3是近年来才被定义的新亚型,其临床表现特征为复发性肾结石、高尿钙、更早的发病年龄和更好的肾脏预后,其病因为HOGA1基因突变导致编码的4-羟基-2-氧代葡萄糖酸烯醇化酶(4-hydroxy-2-oxoglutarate aldolase, HOGA)缺陷。PH1、PH2和PH3患儿占比分别约72%、10%和9%。PH1患儿从开始发育到成人期间,大部分会发展为ESKD,中国患儿ESRD的发生率约为51.1%;PH2患儿慢性肾病(chronic kidney disease, CKD) 的发生率约50%,ESKD的发生率约25%;PH3患儿则很少发生ESKD,但也有20%左右的患儿会进展至CKD2期及更严重的阶段[3]。由此可见,PH患儿与肾结石相关基因检测阴性肾结石患儿的诊疗方向并不相同,PH三种亚型的治疗方法也不相同。PH1和PH2患儿临床表现较严重,早期肝脏或联合肾脏移植治疗可一定程度上改善患儿预后;而PH3患儿由于临床表现较轻,通常不需要进行移植治疗[4-5]。本文对PH患儿和肾结石相关基因检测阴性肾结石患儿的临床表现进行研究,探讨不同PH亚型之间及PH患儿与肾结石相关基因检测阴性患儿的临床差异,为肾结石患儿的临床诊治提供参考和指导。
资料与方法 一、研究对象本研究为回顾性研究。纳入标准:①2016年5月至2024年10月在首都医科大学附属北京友谊医院接受全外显子组测序的儿童泌尿系结石患者;②年龄 < 18岁。排除标准:①明确为继发性尿石症病因;②大量临床数据缺失。共纳入82例患儿,包括54例PH患儿和28例肾结石相关基因检测阴性肾结石患儿,54例PH患儿中包括22例PH1患儿、9例PH2患儿和23例PH3患儿。所有患儿间无亲缘关系。本研究符合《赫尔辛基宣言》原则及相关伦理要求,伦理审批单位为首都医科大学附属北京友谊医院生命伦理委员会(2021-P2-019-01),患儿家属均知情同意。
二、研究方法 (1) 基因检测取患儿及家系外周血,提取脱氧核糖核酸进行文库制备及测序,根据外显子测序结果进行患儿基因变异评估。
(2) 临床资料收集根据患儿初诊信息,记录患儿性别、发病年龄及身体质量指数(body mass index, BMI)。根据患儿泌尿系B超、泌尿系腹部X线平扫(kidney, ureter, bladder plain film, KUB)和腹盆腔CT平扫判断患儿肾脏累及情况,包括肾钙质沉着、肾积水、多发结石及双侧结石,同时测量结石的CT值。血肌酐浓度获取方法:采集所有患儿入院次日清晨空腹静脉血5 mL,静置30 min,室温条件下1000 xg离心10 min,分离血清;采用肌氨酸氧化酶法检测血肌酐浓度。尿代谢指标(包括尿草酸/尿肌酐比值、尿枸橼酸/尿肌酐比值、尿尿酸/尿肌酐比值及尿钙/尿肌酐比值)的获取方法:患儿采集样本前5天停用影响草酸、尿酸等排泄的药物,并避免高嘌呤饮食。尿肌酐浓度采用肌氨酸氧化酶法测定,尿草酸和尿枸橼酸浓度采用气相色谱- 质谱联用法测定,尿尿酸浓度采用高效液相色谱法测定,尿钙浓度采用邻甲酚酞络合酮比色法测定。
三、统计学处理采用SPSS 25.0进行统计学分析。由于本研究中计量资料均不服从正态分布,故采用M(Q1,Q3)描述,组间比较采用曼惠特尼检验和克鲁斯卡尔- 沃利斯检验,两两比较采用邦弗朗尼检验。计数资料以频数、构成比表示,组间比较采用χ2检验和Fisher精确概率法。P < 0.05认为差异具有统计学意义。
结果 一、患儿一般情况及突变基因82例中,男60例、女22例,发病年龄为2.0(0.8, 5.0)岁,BMI为16.0(14.91, 17.29)kg/m2,肾钙质沉着率为31.7%(26/82),肾积水发生率为65.9%(54/82),多发结石率为80.5%(66/82),双侧肾结石率为56.1%(46/82),血肌酐为39.4 (30.0, 49.8)μmol/L,尿pH为6(6, 6.5),尿草酸/尿肌酐比值为298.86(140.74, 664.51)μg/mg,尿钙/尿肌酐比值为107.96(46.91, 246.91)μg/mg。
患儿年龄段分布:婴儿期(年龄 < 1岁)22例,幼儿期(年龄1~3岁)30例,学龄前期(年龄3~7岁)16例,学龄期(年龄≥7岁)14例。PH1患儿(AGXT基因突变)22例,PH2患儿(GRHPR基因突变)9例,PH3患儿(HOGA1基因突变)23例,肾结石相关基因突变检测阴性患儿28例。
二、PH与基因检测阴性患儿临床表现比较两组患儿肾钙质沉着症、肾积水、多发结石和双侧结石发生率以及血肌酐浓度差异有统计学意义(P < 0.05);发病年龄、性别、BMI和肾结石CT值差异无统计学意义(P>0.05)。见表 1。
| 表 1 PH组和肾结石相关基因检测阴性组患儿临床表现比较 Table 1 Comparison of clinical phenotypes between PH and gene mutation-negative groups |
|
|
两组患儿的尿草酸/尿肌酐,尿钙/尿肌酐浓度比和尿尿酸/尿肌酐浓度比差异有统计学意义(P < 0.05);尿pH和尿枸橼酸/尿肌酐浓度差异无统计学意义(P>0.05)。见表 2。
| 表 2 PH组和肾结石相关基因检测阴性组患儿尿PH和尿代谢比较 Table 2 Comparison of urinary pH and urinary metabolism between PH and gene mutation-negative groups |
|
|
三种亚型患儿发病年龄、肾钙质沉着症发生率、血肌酐浓度和尿pH差异有统计学意义(P < 0.05);性别、BMI、肾结石CT值、肾积水和多发结石发生率差异无统计学意义(P>0.05)。见表 3。
| 表 3 PH1、PH2和PH3组患儿临床表现比较 Table 3 Comparison of clinical phenotypes among PH1, PH2 and PH3 groups |
|
|
三种亚型患儿尿pH、尿尿酸/尿肌酐浓度比和尿钙/尿肌酐浓度比差异有统计学意义(P < 0.05);尿草酸/尿肌酐浓度比和尿枸橼酸/尿肌酐浓度比差异无统计学意义(P>0.05)。见表 4。
| 表 4 PH1、PH2和PH3组患儿尿PH和尿代谢比较 Table 4 Comparison of urinary pH and urinary metabolism among PH1, PH2 and PH3 groups |
|
|
PH是一种罕见的遗传病,截至目前,已有454例PH患儿被纳入罕见肾结石联盟登记册。PH的全球发病率估计为1/1 000 000~3/1 000 000,其中PH1约占所有PH患儿的3/4,PH2和PH3各占1/8左右[6]。截至2024年10月,在中国报道的PH1患儿共51例,PH2患儿共42例,PH3患儿共60例[7-9]。
PH患儿临床表现相比肾结石相关基因检测阴性肾结石患儿更严重。本研究中,PH患儿相比基因检测阴性肾结石患儿有着更高的肾钙质沉着率。由于PH患儿体内肝酶水平异常,导致其无法正常代谢草酸,进而导致血液和尿液中草酸浓度增加,其中尿液中的草酸和钙离子结合形成草酸钙盐,在患儿的肾实质和肾小管内沉积,导致肾钙质沉着,进一步引起肾损伤,严重者可出现肾衰竭。因此,肾钙质沉着是PH患儿预后的独立预测指标[10]。此外,PH患儿血肌酐浓度明显高于基因检测阴性肾结石患儿,进一步验证了PH患儿的肾功能损害更为严重。本研究中,PH组的尿草酸水平也明显高于基因检测阴性组,而尿钙水平则明显低于基因检测阴性组,提示了PH患儿“高草酸尿和低钙尿”的特点,尤其在PH1和PH2患儿中更常见,这是因为PH患儿的尿液中草酸和钙离子存在浓度平衡,尿液中的草酸浓度过高,与钙离子形成草酸钙,导致尿液中的钙离子浓度下降 [11]。同时,尿草酸排泄水平可以作为肾衰竭的监测指标,Shah等[12]分析了尿草酸对PH患儿估算肾小球滤过率(estimated glomerular filtration rate, eGFR)下降的预测价值,特别是在CKD 1期至3b期,尿草酸的监测具有重要的参考价值。
|
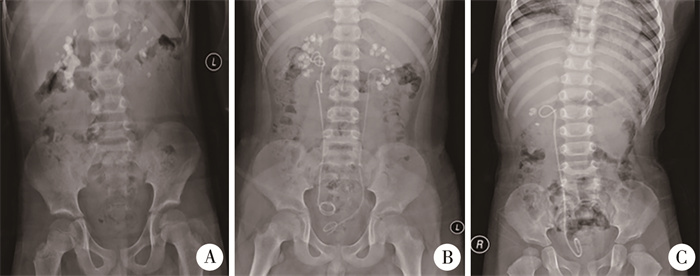
图 1 PH1、PH2和PH3患儿泌尿系腹部X线平扫影像 Fig.1 KUB films of children with PH1, PH2 and PH3 注 A:PH1患儿双侧多发肾结石,右肾为重;B:PH2患儿双侧多发肾结石,双侧置入输尿管支架后状态;C:PH3患儿右侧多发肾结石,右侧置入输尿管支架后状态;PH:原发性高草酸尿症 |
在PH各亚型中,PH3临床表现较PH1和PH2轻。本研究中,PH3患儿肾钙质沉着率、双侧肾结石发生率及血肌酐浓度均为最低。Singh等[13]研究中,PH3患儿临床表现最轻,PH1患儿表现最严重,PH1患儿肾钙质沉着症发生率最高(26%),其次为PH2(16%)和PH3(7%)(P=0.002);该研究随访PH患儿至40岁,仅有36.2%(95%CI:30% ~43%) 的PH1患儿在此期间未发展为肾衰竭,而PH3患儿有97.1%(95%CI:91.8% ~100%)未发展为肾衰竭。PH3患儿通常不易出现严重的肾脏累及,且随着年龄的增长,其病情可能会有所改善[14];但最近的研究结果表明,PH3患儿的高结石发生率会持续到60岁[15]。Wu等[7]的研究同样表明,PH1患儿的临床表型更为严重,且预后较差,其中51.1%的中国患儿会发展为终末期肾病,38.9%的患儿最终死亡。本研究中,尿草酸盐排泄在PH三种亚型间差异并无统计学意义,而在国外的一些研究中,Martin-Higueras等[16]发现PH3患儿的24 h尿草酸排泄水平(1.37 mmol/1.73 m2)与对维生素B6无反应的PH1(1.40 mmol/1.73 m2)和PH2患儿(1.16 mmol/1.73 m2)同样没有显著差异,但显著高于对维生素B6有反应的PH1患儿(0.94 mmol/1.73 m2)。基于中国人群的研究发现,PH患儿的尿钙/尿肌酐浓度比和尿草酸/尿肌酐浓度比存在负相关性(r=-0.360,P=0.04),其中PH3患儿的尿钙/尿草酸浓度比为0.001 (0.32/309.14),而PH1患儿为0.0004(0.19/457.9),这一差异可能导致了PH1和PH3患儿草酸钙结石成分的不同,所有PH1、PH2患儿以及33.3%的PH3患儿的结石成分主要为一水草酸钙结石,50%的PH3患儿为一水草酸钙结石和二水草酸钙结石的混合物,16.7%的PH3患儿为二水草酸钙结石[17]。
对于儿童肾结石的治疗,目前主要的治疗方法包括水化和药物促进结石溶解治疗。PH患儿的早期筛选和早期诊断尤为重要,因为其治疗方法和效果均有别于基因检测阴性的患儿;在疾病早期,水化、利尿剂、草酸盐结晶抑制剂、枸橼酸氢钾钠等药物可降低尿液中草酸和钙的浓度。进一步的治疗方法包括肝或肝肾联合移植以及基因治疗:PH1和PH2型患儿可行肝脏移植,对于肾衰竭的患儿可行肝肾同期联合移植或序贯移植;对于PH2患儿,由于身体内除肝脏外仍有其他器官也存在GRHPR酶,因此不推荐单纯肾脏移植[3, 18]。近年来,基因治疗(如核糖核酸干扰类药物)也在相应的临床试验中证明了其治疗PH1和PH2的有效性和安全性,但目前对PH3的疗效尚不明确,这种新型疗法为PH1患儿提供了潜在的治疗手段,有望改善他们的生活质量,并一定程度上避免了器官移植[19-20]。
本研究存在一定局限性。首先,由于PH是一种罕见的遗传病,导致本研究样本量较小,且本研究为单中心回顾性研究,以儿童结石患者为研究对象,随访时间较短,数据收集有限,在临床表现差异性分析中可能存在偏差。其次,由于采集患儿24 h尿样存在一定困难,本研究通过测定随机尿中溶质与肌酐的比值(即尿渗透压)来评估溶质排泄情况,这种方法能有效避免因尿样采集时间不准确而引发的意外偏差,较适用于儿童。
综上,PH患儿临床表现较肾结石相关基因检测阴性患儿重,PH3患儿临床表现较PH1和PH2患儿轻。对于发病年龄早、结石负荷大、肾功能损害早、尿草酸等代谢异常的患儿,应行基因检测明确诊断并进行早期干预。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 齐思宇、王文营、葛玉成负责文献检索,王文营、赵振强负责论文调查设计,何龙芝、邓昊鹏负责数据收集与分析,齐思宇、葛玉成、赵振强负责论文结果撰写,齐思宇、王文营、葛玉成负责论文讨论分析,并对文章知识性内容进行审阅
| [1] |
Zhao YN, Fang XL, Fan YJ, et al. Integration of exome sequencing and metabolic evaluation for the diagnosis of children with urolithiasis[J]. World J Urol, 2021, 39(7): 2759-2765. DOI:10.1007/s00345-020-03449-9 |
| [2] |
Zhao FZ, Li J, Tang L, et al. Characteristics of the genotype and phenotype in Chinese primary hyperoxaluria type 1 populations[J]. Urolithiasis, 2021, 49(1): 17-25. DOI:10.1007/s00240-020-01201-x |
| [3] |
Shee K, Stoller ML. Perspectives in primary hyperoxaluria: historical, current and future clinical interventions[J]. Nat Rev Urol, 2022, 19(3): 137-146. DOI:10.1038/s41585-021-00543-4 |
| [4] |
Metry EL, Garrelfs SF, Deesker LJ, et al. Determinants of kidney failure in primary hyperoxaluria type 1:findings of the European hyperoxaluria consortium[J]. Kidney Int Rep, 2023, 8(10): 2029-2042. DOI:10.1016/j.ekir.2023.07.025 |
| [5] |
Cai ZT, Ding M, Chen RG, et al. Primary hyperoxaluria diagnosed after kidney transplantation: a case report and literature review[J]. BMC Nephrol, 2021, 22(1): 393. DOI:10.1186/s12882-021-02546-0 |
| [6] |
Cochat P, Rumsby G. Primary hyperoxaluria[J]. N Engl J Med, 2013, 369(7): 649-658. DOI:10.1056/NEJMra1301564 |
| [7] |
Wu JY, Song J, He YZ, et al. Case series and literature review of primary hyperoxaluria type 1 in Chinese patients[J]. Urolithiasis, 2023, 51(1): 123. DOI:10.1007/s00240-023-01494-8 |
| [8] |
Ge YC, Liu YK, Zhan RC, et al. HOGA1 variants in Chinese patients with primary hyperoxaluria type 3:genetic features and genotype-phenotype relationships[J]. World J Urol, 2023, 41(8): 2141-2148. DOI:10.1007/s00345-023-04461-5 |
| [9] |
Liu YK, Zhao ZQ, Ge YC, et al. Clinical features and mutational spectrum of Chinese patients with primary hyperoxaluria type 2[J]. Urolithiasis, 2024, 52(1): 74. DOI:10.1007/s00240-024-01579-y |
| [10] |
Cornell LD, Amer H, Viehman JK, et al. Posttransplant recurrence of calcium oxalate crystals in patients with primary hyperoxaluria: incidence, risk factors, and effect on renal allograft function[J]. Am J Transplant, 2022, 22(1): 85-95. DOI:10.1111/ajt.16732 |
| [11] |
Michael M, Harvey E, Milliner DS, et al. Diagnosis and management of primary hyperoxalurias: best practices[J]. Pediatr Nephrol, 2024, 39(11): 3143-3155. DOI:10.1007/s00467-024-06328-2 |
| [12] |
Shah RJ, Vaughan LE, Enders FT, et al. Plasma oxalate as a predictor of kidney function decline in a primary hyperoxaluria cohort[J]. Int J Mol Sci, 2020, 21(10): 3608. DOI:10.3390/ijms21103608 |
| [13] |
Singh P, Viehman JK, Mehta RA, et al. Clinical characterization of primary hyperoxaluria type 3 in comparison with types 1 and 2[J]. Nephrol Dial Transplant, 2022, 37(5): 869-875. DOI:10.1093/ndt/gfab027 |
| [14] |
Arnous MG, Vaughan L, Mehta RA, et al. Characterization of stone events in patients with type 3 primary hyperoxaluria[J]. J Urol, 2023, 209(6): 1141-1150. DOI:10.1097/ju.0000000000003400 |
| [15] |
Sas DJ, Mara K, Mehta RA, et al. Natural history of urine and plasma oxalate in children with primary hyperoxaluria type 1[J]. Pediatr Nephrol, 2024, 39(1): 141-148. DOI:10.1007/s00467-023-06074-x |
| [16] |
Martin-Higueras C, Garrelfs SF, Groothoff JW, et al. A report from the European Hyperoxaluria Consortium (OxalEurope) Registry on a large cohort of patients with primary hyperoxaluria type 3[J]. Kidney Int, 2021, 100(3): 621-635. DOI:10.1016/j.kint.2021.03.031 |
| [17] |
Ge YC, Liu YK, Zhan RC, et al. Genotype and phenotype characteristics of Chinese pediatric patients with primary hyperoxaluria[J]. Hum Mutat, 2023, 2023: 4875680. DOI:10.1155/2023/4875680 |
| [18] |
Gupta A, Somers MJG, Baum MA. Treatment of primary hyperoxaluria type 1[J]. Clin Kidney J, 2022, 15(Suppl 1): i9-i13. DOI:10.1093/ckj/sfab232 |
| [19] |
Gang X, Liu F, Mao JH. Lumasiran for primary hyperoxaluria type 1:What we have learned?[J]. Front Pediatr, 2022, 10: 1052625. DOI:10.3389/fped.2022.1052625 |
| [20] |
Goldfarb DS, Lieske JC, Groothoff J, et al. Nedosiran in primary hyperoxaluria subtype 3:results from a phase I, single-dose study (PHYOX4)[J]. Urolithiasis, 2023, 51(1): 80. DOI:10.1007/s00240-023-01453-3 |
 2025, Vol. 24
2025, Vol. 24


