2. 淄博市张店区妇幼保健院儿童保健科, 淄博 255022;
3. 首都儿科研究所附属儿童医院普外科, 北京 100020;
4. 北京清华长庚医院小儿外科, 北京 102218
2. Department of Child Healthcare Zhangdian Maternal & Children's Health Hospital, Zibo 255022, China;
3. Department of General Surgery, Affiliated Children's Hospital, Capital Institute of Pediatrics, Beijing 100020, China;
4. Department of Pediatric Surgery, Tsinghua Changgeng Hospital, Beijing 102218, China
胆总管囊肿(choledochal cyst, CC)是最常见的先天性胆道畸形,亚洲国家发病率约1 : 1 000[1]。该病主要表现为胆总管不同程度扩张,可合并肝内胆管扩张[2]。胆道闭锁(biliary atresia, BA)是以炎症、肝内外胆道系统进行性纤维化为特征的胆道疾病,在中国台湾和日本的发病率约1.1 : 10 000~1.48 : 10 000[3]。囊肿型胆道闭锁(cystic biliary atresia, CBA)是伴有肝外囊肿的BA的一种亚型,临床表现及超声图像与CC相似,因此CBA在产前及产后容易被误诊为CC[4]。但CC和CBA的治疗方式和预后差异极大,CBA可通过肝门空肠吻合术治疗,手术效果与手术时年龄密切相关,文献报道出生后45 d以内手术可以获得较好的预后,而出生90 d以后手术则预后较差[5]。因此,尽早诊断CC或CBA至关重要。本研究旨在分析CC及CBA患儿的血液生化指标特点,并结合常用的其他临床指标进行多指标联合诊断,以期在出生后早期辅助鉴别诊断CC和CBA,从而为CBA的及时手术干预提供参考依据。
资料与方法 一、研究对象回顾性分析2013年1月至2022年12月济宁医学院附属医院小儿外科及首都儿科研究所附属儿童医院普外科收治的年龄小于45 d、术前超声检查发现肝门部囊肿患儿的临床资料。病例纳入标准:临床资料完整,经术中胆道造影确诊为囊肿型胆道闭锁或胆总管囊肿,患儿肝功能异常。排除标准:①存在其他影响肝功能指标的疾病,如自身免疫性肝病、进行性家族性肝内胆汁淤积症等;②术前血液生化检查结果不齐全;③术中胆道造影诊断为Ⅲ型BA。本研究经首都儿科研究所伦理委员会审核批准(SHERLL2022047),由于本研究为回顾性研究,免除对患儿家属知情同意的要求。
根据统计学中“每个预测变量至少需要10个病例”的原则,即每个预测变量至少需要10个病例,本研究涉及6个变量,因此至少需要60例患儿的数据。本研究共纳入99例患儿,符合本研究所需样本量要求。
二、研究方法纳入研究的99例患儿按照术中胆道造影及术后囊肿病理结果分为CC组和CBA组。诊断方法为:通过向胆囊或囊肿注入碘海醇观察肝外胆管及肠内有无显影,若肝内胆管及肠内均显影则诊断为胆总管囊肿;若未显影则反复冲洗或加压注射造影剂,若依然未显影且病理结果显示囊肿内膜异常,缺少完整的上皮组织覆盖,增厚的白色纤维素膜完全或部分与囊肿壁分离,则诊断为囊肿型胆道闭锁;若囊肿上皮细胞完好无损,没有上皮下瘢痕形成,则诊断为胆总管囊肿。
本研究CBA组37例,男11例、女26例,中位手术年龄26 d。CC组62例,男14例、女48例,中位手术年龄23 d。收集两组患儿术前血液生化指标,包括总胆汁酸(total bile acid, TBA)、谷氨酰转肽酶(γ-glutamyl transferase, GGT)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)等。
三、统计学处理采用SPSS 26.0进行统计学分析。不服从正态分布的计量资料采用M(Q1, Q3)表示,两组间比较采用Wilcoxon检验;计数资料采用例(%)表示,两组间比较采用χ2检验。通过单因素分析筛选与CC和CBA早期鉴别诊断相关的显著性参数,然后通过多因素分析进一步确认这些参数并建立诊断模型。为了排除参数间的重叠,计算各参数之间的相关系数,并使用方差膨胀系数(varinace inflation factor, VIF)评估多重共线性,相关系数<0.6、VIF值<5被认为相关性低,不存在重叠。使用受试者操作特征(receiver operating characteristic curve, ROC)曲线计算TBA、GGT、TBIL、DBIL、AST、ALT、预测模型的截断值以及对CBA和CC鉴别诊断的价值。P<0.05为差异有统计学意义。
结果两组患儿性别分布和手术时年龄比较,差异无统计学意义(P>0.05)。术前血液生化指标比较显示,CBA组GGT、TBIL、DBIL、AST、ALT和TBA均高于CC组(表 1);但两组GGT、AST和ALT的差异无统计学意义,见表 1。
| 表 1 CBA组和CC组患儿临床资料比较 Table 1 Comparison of clinical data of CBA and CC groups |
|
|
ROC诊断试验结果显示,GGT、AST、ALT的ROC曲线下面积分别为0.569(P=0.255)、0.611(P=0.065)、0.576(P=0.206),TBA、TBIL、DBIL的ROC曲线下面积分别为0.712(P<0.001)、及0.658(P=0.009)、0.677(P=0.003);TBIL的诊断灵敏度为75.7%,特异度为54.8%,阳性预测值为50.0%,阴性预测值为79.1%;DBIL的诊断灵敏度为97.3%,特异度为38.7%,阳性预测值为48.6%,阴性预测值为96.0%;TBA的诊断灵敏度为64.9%,特异度为69.4%,阳性预测值为55.8%,阴性预测值为76.8%。见图 1,表 2。
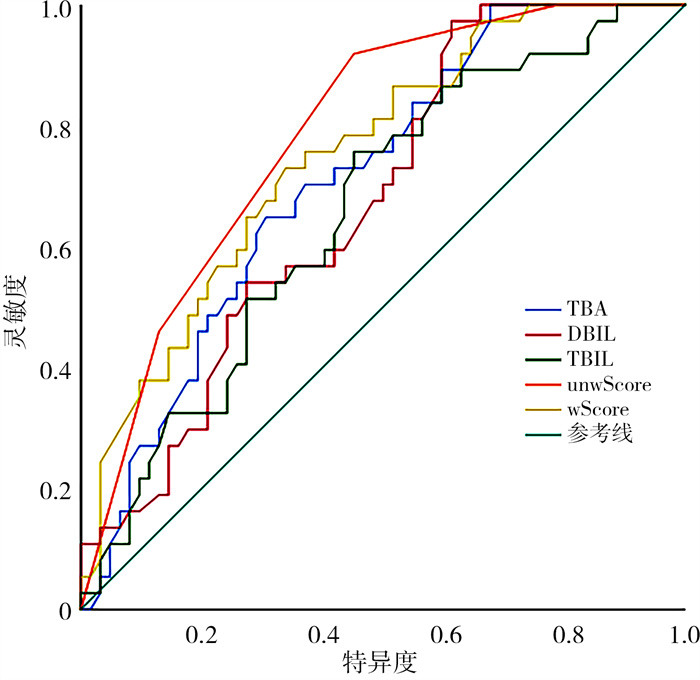
|
图 1 不同血液生化指标及联合预测模型鉴别诊断CBA和CC的受试者操作特征曲线 Fig.1 Receiver operating characteristic curves of different blood biochemical indicators and combined predictive models for children with CBA and CC 注 CBA:囊肿型胆道闭锁;CC:胆总管囊肿;TBA:总胆汁酸;DBIL:直接胆红素;TBIL:总胆红素;unwScore:非加权预测模型;wScore:加权预测模型 |
| 表 2 各生化指标鉴别诊断CBA和CC的诊断效能参数 Table 2 Diagnostic performance parameters of two prediction models and biochemical markers |
|
|
各参数相关系数均<0.6, VIF值均<5,各参数不存在重叠。①非加权预测模型(unwScore)结果:将数据分为CC组和CBA组,通过ROC曲线计算各指标的截断值(表 2),并根据截断值对每个指标生成新的二分类变量。TBA≥82.75 μmol/L、TBIL≥162.15 μmol/L、DBIL≥34.85 μmol/L。根据各指标的截断值计算患儿可能诊断为CBA的分值,即unwScore=STBA+STBIL+SDBIL。该模型分值的截断值为1.5分,分值越高,则越有可能被诊断为CBA。0、1、2、3分所对应的被诊断为CBA的概率为0%、12.5%、45.9%、68%。unwScore模型诊断CBA的曲线下面积为0.787(P<0.001),灵敏度为91.9%,特异度为54.8%,阳性预测值为54.8%,阴性预测值为91.9%。该模型的曲线下面积高于TBA、TBIL及DBIL(图 1,表 2),差异均有统计学意义(P=0.070、0.016、0.013)。②加权预测模型(wScore):对TBA、DBIL、TBIL进行二元Logistic回归分析,建立Logistic回归方程wScore=1/[1+e-(3.895-0.018×TBA-0.004×DBIL-0.01×TBIL)]。wScore截断值为0.618,该值越小,越有可能被诊断为CBA。wScore曲线下面积为0.752(P<0.001),灵敏度为66.1%,特异度为73.0%,阳性预测值为70.6%,阴性预测值为69.5%。该模型的曲线下面积高于TBA、TBIL及DBIL(图 1,表 2),但差异均没有统计学意义(P=0.258、0.079、0.083)。
讨论CC和BA是导致儿童梗阻性黄疸的常见病因。CC表现为胆总管不同程度扩张,并可伴有肝内胆管扩张[2]。日本胰胆管畸形临床指南提出,对于有症状的CC患儿应尽早行囊肿切除及肝管空肠吻合手术,而无症状的患儿可密切观察肝功能及症状,并在出生后3~6个月择期行手术治疗[6]。BA表现为炎症、进行性肝纤维化及肝外胆道闭塞[7]。该病预后与手术时间密切相关,出生后45 d前进行肝门空肠吻合手术,可以获得较好的预后,而手术年龄过大会因长时间胆汁淤积而导致肝纤维化程度加重,影响手术效果[8-9]。CBA是BA的一种亚型,尽管预后较好,但仍需要早期手术以避免肝脏纤维化严重而导致预后较差。B超在鉴别诊断CC与CBA中的作用已经越来越明显,CBA通常可于出生后6个月因肝纤维化程度较重而通过超声检查与CC相鉴别[10]。但在生后早期CBA与CC的鉴别诊断与超声医师的经验有关,因此需要实验室检查数据的补充。若CBA被误诊为CC将可能延误最佳手术时机,给治疗方案的选择带来了困难。
肝功能指标常用于BA的诊断,已有多项研究探索了单指标用于鉴别诊断CBA和CC[11]。但血生化指标随疾病进展而变化较大,目前尚无研究报道生后早期CC和CBA的生化指标对比,且单一指标的诊断效能通常较低。因此本研究旨在选择合适的血生化指标建立多指标联合检测模型,以实现CBA和CC的早期鉴别诊断以及CBA的早期诊治。
有研究报道,当GGT>250 U/L时更有可能诊断为胆道闭锁。但在本研究中CC组和CBA组GGT的差异没有统计学意义(P>0.05),无法用于二者的鉴别诊断。这可能是因为生后早期CC患者GGT生理性升高,且远端梗阻导致GGT进一步异常升高。当肝门部囊肿患儿TBA>111 μmol/L时应考虑诊断为CBA而不是CC。本研究CBA组TBA高于CC组,并可用于二者的鉴别诊断,与上述研究结果一致。本研究数据表明,当TBA>82.75时可考虑诊断为CBA。此外,本研究数据也显示,CBA组TBIL和DBIL显著高于CC组,这可能是由于CBA患儿肝内胆管发育通常较差,会有更重的胆汁淤积。而TBIL>162.15或者DBIL>34.85时,患儿更有可能被诊断为CBA。本研究还发现,CBA组AST和ALT虽然高于CC组,但差异没有统计学意义(P>0.05)。而于蒲等[12]报道CBA患儿ALT和AST显著高于CC患儿,这可能是因为本研究仅纳入了45日龄以内的患儿,通常这一年龄阶段患儿胆汁淤积时间较短,肝脏损伤轻微,因此两组ALT和ALT的差距不大。
尽管TBA、TBIL和DBIL对CBA和CC有一定的鉴别诊断价值,但是TBA的灵敏度(64.9%)和阴性预测值(76.8%)较低,而TBIL和DBIL的诊断准确性较低(65.8%,67.7%)。通过联合这三个指标建立预测模型提升了诊断效能,wScore模型准确性达到了75.2%,高于单指标诊断效能,但是差异没有统计学意义(P>0.05),且灵敏度(66.1%)和阴性预测值(69.5%)较低。而unwScore模型的准确性达到了78.7%,显著高于单指标诊断效能(P<0.05),且灵敏度和阴性预测值都达到了91.9%,然而,其特异度仅54.8%,有较高的风险将CC误诊为CBA。考虑到CBA的误诊及漏诊会导致手术时间推迟,影响预后,因此准确性、灵敏度和阴性预测值更高的unwScore模型对于CC和CBA的鉴别诊断有更大意义,但仍需结合其他诊断手段,如通过基质金属蛋白酶7、吲哚菁绿荧光粪便成像及磁共振胰胆管成像等来辅助鉴别诊断,以减少误诊风险。
综上所述,TBA、TBIL、DBIL对鉴别诊断CC和CBA有一定价值,而多指标联合检测有更高的诊断效能,其中unwScore模型有较高的准确率、灵敏度和阴性预测值;当unwScore模型诊断患者为CBA时,应尽快行胆管造影以明确诊断,以免延误最佳手术时机。但本研究仍然存在样本量小、模型诊断准确性依然较低等局限性,未来仍需多中心大样本的前瞻性研究来验证和改进该模型,以更好地为CC和CBA的早期诊断提供参考。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 孙明璇负责文献检索;王提学、封林负责论文设计;田宇负责数据收集;王提学负责研究结果分析与讨论;田宇、王提学负责论文撰写;李龙、孙劲松负责全文知识性内容的审读与修正
| [1] |
Ming GD, Guo WL, Cheng Y, et al. Identification and evaluation of fructose-bisphosphate aldolase B as a potential diagnostic biomarker in choledochal cysts patients: a quantitative proteomic analysis[J]. Transl Pediatr, 2021, 10(8): 2083-2094. DOI:10.21037/tp-21-336 |
| [2] |
Gomes C, Tivnan P, McAneny D, et al. Choledochal cyst or benign biliary dilation: is resection always necessary?[J]. J Gastrointest Surg, 2021, 25(9): 2353-2357. DOI:10.1007/s11605-020-04896-w |
| [3] |
Chung PHY, Zheng S, Tam PKH. Biliary atresia: east versus west[J]. Semin Pediatr Surg, 2020, 29(4): 150950. DOI:10.1016/j.sempedsurg.2020.150950 |
| [4] |
He L, Chung PHY, Lui VCH, et al. Current understanding in the clinical characteristics and molecular mechanisms in different subtypes of biliary atresia[J]. Int J Mol Sci, 2022, 23(9): 4841. DOI:10.3390/ijms23094841 |
| [5] |
Bezerra JA, Wells RG, Mack CL, et al. Biliary atresia: clinical and research challenges for the twenty-first century[J]. Hepatology, 2018, 68(3): 1163-1173. DOI:10.1002/hep.29905 |
| [6] |
Kamisawa T, Ando H, Suyama M, et al. Japanese clinical practice guidelines for pancreaticobiliary maljunction[J]. J Gastroenterol, 2012, 47(7): 731-759. DOI:10.1007/s00535-012-0611-2 |
| [7] |
Amarachintha SP, Mourya R, Ayabe H, et al. Biliary organoids uncover delayed epithelial development and barrier function in biliary atresia[J]. Hepatology, 2022, 75(1): 89-103. DOI:10.1002/hep.32107 |
| [8] |
Kelley-Quon LI, Shue E, Burke RV, et al. The need for early Kasai portoenterostomy: a Western Pediatric Surgery Research Consortium study[J]. Pediatr Surg Int, 2022, 38(2): 193-199. DOI:10.1007/s00383-021-05047-1 |
| [9] |
Okubo R, Nio M, Sasaki H, et al. Impacts of early Kasai portoenterostomy on short-term and long-term outcomes of biliary atresia[J]. Hepatol Commun, 2021, 5(2): 234-243. DOI:10.1002/hep4.1615 |
| [10] |
Ziegler KM, Pitt HA, Zyromski NJ, et al. Choledochoceles: are they choledochal cysts?[J]. Adv Surg, 2010, 252(4): 683-690. DOI:10.1097/SLA.0b013e3181f6931f |
| [11] |
Robie DK, Overfelt SR, Xie L. Differentiating biliary atresia from other causes of cholestatic jaundice[J]. Am Surg, 2014, 80(9): 827-831. |
| [12] |
于蒲, 潘永康, 李龙, 等. 囊肿型胆道闭锁与胆总管囊肿的临床对比研究[J]. 中华小儿外科杂志, 2018, 39(6): 440-444. Yu P, Pan YK, Li L, et al. Comparisons between cystic biliary atresia and choledochal cyst: a controlled clinical trial[J]. Chin J Pediatr Surg, 2018, 39(6): 440-444. DOI:10.3760/cma.j.issn.0253-3006.2018.06.008 |
 2024, Vol. 23
2024, Vol. 23


