2. 南京市儿童医院小儿外科, 南京 210000;
3. 安徽省儿童医院小儿外科, 合肥 230000;
4. 郑州大学第一附属医院小儿外科, 郑州 461499;
5. 河北医科大学第二附属医院小儿外科, 石家庄 050005;
6. 西安市儿童医院小儿外科, 西安 710018;
7. 天津市儿童医院小儿外科, 天津 300074;
8. 上海市儿童医院小儿外科, 上海 200062;
9. 山西省儿童医院小儿外科, 太原 030032;
10. 浙江大学附属儿童医院小儿外科, 杭州 310006;
11. 华中科技大学附属同济医院小儿外科, 武汉 430071;
12. 郑州大学附属第三医院小儿外科, 郑州 450012;
13. 贵州省人民医院小儿外科, 贵阳 550499
2. Department of Pediatric Surgery, Nanjing Children's Hospital, Nanjing 210000, China;
3. Department of Pediatric Surgery, Children's Hospital of Anhui Province, Hefei 230000, China;
4. Department of Pediatric Surgery, 1st Affiliated Hospital of Zhengzhou University, Zhengzhou 461499, China;
5. Department of Pediatric Surgery, 2nd Affiliated Hospital of Hebei Medical University, Shijiazhuang 050005, China;
6. Department of Pediatric Surgery, Children's Hospital of Xian, Xian 710018, China;
7. Department of Pediatric Surgery, Children's Hospital of Tianjin, Tianjin 300074, China;
8. Department of Pediatric Surgery, Children's Hospital of Shanghai, 200062, China;
9. Department of Pediatric Surgery, Children's Hospital of Shanxi Province, Taiyuan 030032, China;
10. Department of Pediatric Surgery, Children's Hospital of Zhejiang University, Hangzhou 310006, China;
11. Department of Pediatric Surgery, Tongji Hospital of Huazhong University of Science and Technology, Wuhan 430071, China;
12. Department of Pediatric Surgery, 3rd Affiliated Hospital of Zhengzhou University, Zhengzhou 450012, China;
13. Department of Pediatric Surgery, Guizhou Provincial People's Hospital, Guiyang 550499, China
胆道闭锁(biliary atresia, BA)是一种严重的新生儿胆道梗阻性疾病,其特征是肝内和肝外胆管出现进行性纤维炎症性阻塞,未接受治疗的情况下多于6个月内进展为肝硬化,1岁以内死亡[1-3]。Kasai肝门空肠吻合术(hepatoportoenterostomy,HPE)可以重建胆汁引流,延缓BA的快速进展,是目前治疗BA的首选术式[4]。HPE的治疗效果与手术年龄密切相关,早发现、早手术是改善BA整体预后的关键因素。
根据发病机制,BA可分为4种类型:孤立性BA(70% ~80%)、综合征型BA(10% ~15%)、CMV-IgM+ve型BA(10%),囊肿型BA(cystic biliary atresia, CBA,5% ~10%)[5]。CBA表现为肝外胆管的囊性改变,常于妊娠中期常规超声检查时被发现,是产前检查中常见的胆道系统畸形之一[6]。随着产前检查的普及,越来越多的CBA被发现,但产前发现的CBA需与另一种常见的胆道发育异常- 胆总管囊肿(choledochal cyst, CC)相鉴别。鉴于二者在产前超声检查中均表现为肝门区囊肿,Casaccia等[7]提出胆道囊性畸形(bile cystic malformation,BCM)的概念,即胆道系统存在囊肿改变,主要包括CC和CBA。
在亚洲国家,CC较CBA常见。在没有并发症的情况下,CC很少引起胆汁淤积性肝损伤,其进展和预后通常是良性的[8]。尽管有文献报道可以尝试根据囊肿大小及变化时间来区分CBA和CC,但至目前为止还没有明确的超声诊断标准来区分这两种情况,即使是在出生后,两者的早期鉴别诊断仍然具有挑战性[9-10]。CBA的预后很大程度上与及时诊断和手术相关,而CC的预后与诊断和手术时间关联不大,因此二者的早期鉴别很重要[11]。由于CBA在临床上相对罕见,因此我们在中国大陆多中心收集尽可能多的病例进行研究,通过对各中心CBA和CC患儿产前超声检查结果的分析,探讨CBA和CC的产前超声鉴别诊断特征。同时,BA是新生儿特发疾病,患儿出生后数日内结合胆红素、直接胆红素水平即升高[12-18]。因此,本研究也观察上述产前发现肝门区囊肿患儿出生后早期的肝功能生化指标,探讨结合胆红素(conjugated bilirubin,CB)和总胆汁酸(total bile acid,TBA)是否可以用于CBA和CC的早期鉴别诊断。
资料与方法 一、研究对象与方法本研究为多中心回顾性研究,参与单位涉及中国大陆13个三级儿科中心。病例收集时间为2020年10月至2021年12月,收集各中心产前超声诊断为肝门区囊肿的患儿临床资料,并根据术中诊断或最终临床结局将患儿分为CBA组和CC组。
病例纳入标准:①年龄≤6个月;②产前超声检查提示胎儿肝门区囊肿;③经术中胆道造影、明确的临床结局或术后肝脏病理检查结果明确诊断为CBA或CC;④出生后随访资料完整。排除标准:①合并其他严重伴发畸形;②无明确诊断结果;③失访。
本研究经中国医科大学附属盛京医院临床研究伦理委员会批准(2021PS008K),患儿家属知情并签署知情同意书。
二、数据收集与整理收集13个医疗中心产前诊断为胎儿肝门区囊肿患儿的一般资料,包括性别、首次超声诊断时胎龄、至分娩前的历次产前超声检查结果(包括胆囊描述、囊肿体积和最大直径)。囊肿体积计算公式为:V=π/6×A×B×C,“A”表示最大纵向长径(cm),“B”表示最大横向长径(cm),“C”表示最大前后直径(cm)。囊肿体积变化倍数(multiples of cyst volume,MCV)计算方法为分娩前测量的最后一次囊肿体积(Vb,cm3)除以首次诊断时初始体积(Va,cm3)。
患儿出生后2周内每周检查1次肝功能,包括结合胆红素(conjugated bilirubin,CB)和总胆汁酸(total bile acid,TBA),并根据测量时间记录为出生后第1周CB(CB1)、出生后第1周TBA(TBA1)、出生后第2周CB(CB2)、出生后第二周TBA(TBA2)。
三、统计学处理使用SPSS 26.0、MedCalc 12.7.0和GraphPad 8.0进行统计学分析。服从正态分布的连续型变量以x±s表示,组间比较采用两独立样本t检验;不服从正态分布的连续型变量以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验。分类变量以例数(百分比)表示,组间比较采用卡方检验。
对CBA组与CC组患儿出生后第1周、第2周CB和TBA水平比较中差异有统计学意义的指标,进行诊断性受试者操作特征(receiver operating characteristic, ROC)曲线分析。采用Delong's检验对ROC曲线下面积(area under the receiver operating characteristic curve,AUC)进行比较。P < 0.05为结果具有统计学意义。
结果 一、一般资料根据本研究纳入和排除标准,共有143例产前发现肝门区囊肿患儿纳入研究。首次超声诊断时孕周为(25.29±6.07)周(平均孕周为24周)。经手术及明确的临床结局证实为CBA 37例(CBA组),CC 106例(CC组)。在143例患儿中,女性患儿人数(107例)是男性(36例)的3倍左右,CBA组和CC组女性人数占比分别为75.7%和74.5%,高于男性人数占比(分别为24.3%和25.5%),但是CBA组与CC组之间性别比例差异并无统计学意义(P>0.05)。CBA组患儿手术年龄显著早于CC组,差异有统计学意义(P < 0.05),见表 1。
| 表 1 143例产前发现肝门区囊肿患儿一般资料及产前超声检查数据 Table 1 General profiles and prenatal ultrasonographic data of 143 neonates of fetal portal cyst |
|
|
CBA组产前超声检查首次发现时间略早于CC组,初始囊肿体积及初始囊肿最大长径差异均无统计学意义(P > 0.05)。CBA组Vb (3.39 cm3)明显小于CC组(20.38 cm3),差异有统计学意义(P < 0.001)。CBA和CC的MCV分别为1.48倍和8.34倍,差异亦有统计学意义(P < 0.001)。见表 1。
以Vb作为诊断指标鉴别CBA与CC,当Vb临界值为4.84 cm3时,其鉴别诊断CBA和CC的AUC、约登指数、灵敏度、特异度、阳性预测值(positive predictive value,PPV) 以及阴性预测值(negative predictive value,NPV)分别为0.756(95%CI: 0.660~0.851)、0.398、60.6%、79.2%、47.6%、86.6%。以MCV作为诊断指标鉴别CBA和CC,当MCV临界值为3.92倍时,其鉴别诊断CBA和CC的AUC、约登指数、灵敏度、特异度、PPV和NPV分别为0.828(95%CI: 0.728~0.929)、0.534、83.3%、70.1%、42.9%和94.0%,见表 2。MCV对于产前鉴别CBA和CC具有更好的诊断效能,当囊肿体积增大不足3.90倍时,患CBA的可能性更大。
| 表 2 Vb和MCV对于CBA和CC的诊断效能 Table 2 Diagnostic performances of Vb and MCV in differentiating CBA and CC |
|
|
除囊肿体积变化外,本研究还分析了胆囊的描述性数据。CBA中对胆囊描述最多的是“胆囊壁僵硬且壁厚”、“曲折管状”、“内壁不光滑”或“胆囊萎缩”,上述表述出现在14例(38%)CBA的超声检查报告中,而CC组无一例此类描述。CBA组有5例(13.5%)在产前系列超声检查提示“胆囊不可见”。相比之下,CC组有7例在首次产前超声检查时提示“胆囊不可见”,但在随后的系列超声检查中可见胆囊。
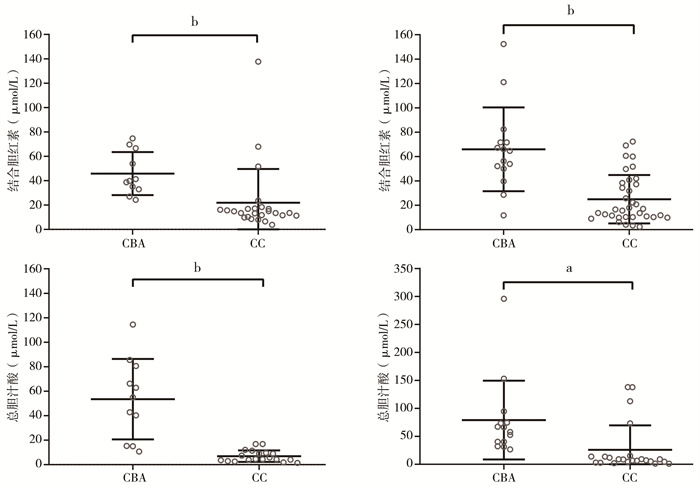
三、CBA组和CC组出生后2周肝功能生化指标比较本研究获取了11例CBA和25例CC患儿出生后第1周、第2周的肝功能检查结果,另有4例CBA和10例CC患儿仅有出生后第2周肝功能检查结果。经分析发现,CBA组患儿的CB和TBA水平于出生后第1周即升高(平均值:39.80 μmol/L和54.90 μmol/L),显著高于CC组患儿(平均值13.50 μmol/L和4.50 μmol/L),差异均有统计学意义(P < 0.001),并于第2周继续升高。CBA组患儿第2周CB和TBA平均值分别为62.7 μmol/L和62.05 μmol/L,显著高于CC组患儿的平均值(分别为16.60 μmol/L和8.70 μmol/L),差异有统计学意义(P < 0.001);见图 1、表 3。
|
图 1 囊肿型胆道闭锁和胆总管囊肿患儿出生后第1周和第2周肝功能指标差异统计图 Fig.1 Scatter plots of differences in liver function parameters between the first and second week of life in neonates with cystic biliary atresia and choledochal cyst 注 左栏图为:出生后第1周;右栏图为:出生后第2周;CBA:囊肿型胆道闭锁;CC:胆总管囊肿,CB:结合胆红素;a: 与对照组相比,P < 0.001;b: 组间比较,P < 0.0001 |
| 表 3 CBA组和CC组患儿出生后2周内CB和TBA变化[M(Q1, Q3), μmol/L] Table 3 Comparison of CB and TBA in CBA and CC children[M(Q1, Q3), μmol/L] |
|
|
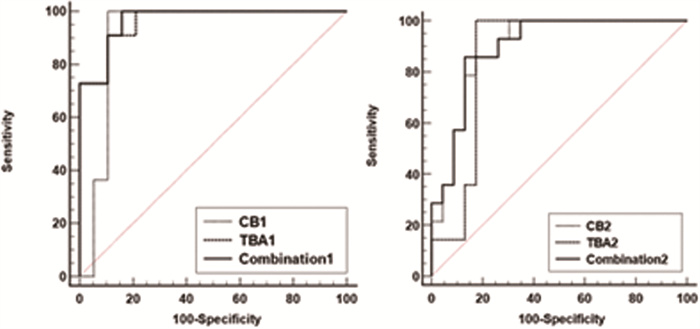
在鉴别诊断CBA和CC时,将CB和TBA纳入ROC曲线分析。当单独使用CB1时,其AUC为0.902(95%CI: 0.793~1.000),而单独使用TBA1时,其AUC为0.962(95%CI: 0.902~1.000)。联合CB1和TBA1时,AUC增加至0.967。Delong's检验结果显示,CB1、TBA1以及联合使用CB1和TBA1的AUC值差异并无统计学意义(P>0.05)。单独使用CB2和TBA2鉴别CBA和CC时,AUC分别为0.870(95%CI: 0.763~0.977)和0.860(95%CI: 0.730~0.991);联合使用CB2和TBA2鉴别CBA和CC时,AUC增加至0.898,经Delong's分析显示,上述AUC差异也无统计学意义(P>0.05);见表 4、图 2A。
| 表 4 CB和TBA鉴别CBA与CC时的诊断效能 Table 4 Diagnostic effectiveness of CB and TBA in distinguishing CBA from CC |
|
|
|
图 2 CB和TBA鉴别CBA和CC的受试者操作特征曲线 Fig.2 CB and TBA identify the ROC curves of CBA and CC 注 A为出生后第1周;B为出生后第2周;CB:结合胆红素;CBA:囊肿型胆道闭锁;CC:胆总管囊肿;TBA:总胆汁酸;CB1:出生后第1周结合胆红素;TBA1:出生后第1周总胆汁酸 |
使用ROC曲线进一步分析CB与TBA以鉴别CBA和CC时发现,当CB1临界值为24 μmol/L时,约登指数、灵敏度和特异度分别为0.880、100%和88%;当TBA1临界值为13.6 μmol/L时,约登指数、灵敏度和特异度分别为0.804、90.9%和89.5%;当CB2临界值为50 μmol/L时,约登指数、灵敏度和特异度分别为0.657、80.8%和85.7%;当TBA2临界值为20.9 μmol/L时,约登指数、灵敏度和特异度分别为0.826、100%和82.6%;在CB1为24 μmol/L、TBA2为20.9 μmol/L时约登指数达到较大值,即当CB1≧24 μmol/L、TBA2≧20.9 μmol/L时,诊断效能最高,即患有CBA的可能性较大,且此时诊断灵敏度最高,可以避免漏诊;见表 4、图 2。
讨论随着产前超声技术的进步,越来越多的胆道系统异常能够在胎儿期被检测出来,这为临床医师提供了早期诊断和干预的机会,特别是CBA和CC。本研究143例产前发现肝门区囊肿患儿中,25.9%诊断为CBA,提示当产前超声检查提示肝门区囊肿时,临床医师应警惕CBA的发生。然而CBA和CC的鉴别诊断仍然是产前产后诊断的一个挑战,尤其是在影像学和初步临床表现上存在相似之处时。本研究旨在通过系统的产前超声影像特征以及出生后早期肝功能检查评估,探讨这两种疾病在诊断上的关键差异。
CBA是一种预后与手术时间高度相关的胆道疾病,而CC是一种更常见的异常,手术时间较CBA宽松,预后一般较好,产前鉴别两者具有一定困难。有研究表明,产前超声检查中观察到的小囊肿、胆囊异常(如检测不到、胆囊小、胆囊壁僵硬、胆囊内空虚或胆囊壁增厚、胆囊位置异常等)以及右肝动脉扩张等特征可能提示CBA。然而,这些结果大多缺乏统一的客观标准,导致在临床应用中的不确定性和诊断的复杂性[9-10, 19]。鉴于此,我们开展了这项多中心研究,旨在通过更大规模的数据收集和分析,以更系统的方式评估这些超声影像特征在鉴别CBA和CC中的价值。本研究中,CBA和CC的初始囊肿体积和直径没有差异,但CC囊肿增长更快、更显著,至妊娠末期时,CC组囊肿体积增加8倍以上,至产前末次检查时平均囊肿体积超过20 cm3;而CBA平均囊肿体积增加不到1.5倍,末次检查时囊肿体积平均小于3.4 cm3。当使用囊肿增长倍数MCV和分娩前囊肿体积Vb作为指标来区分CBA和CC时,研究结果显示,MCV的诊断效能优于Vb。具体而言,当MCV达到3.9倍时,鉴别CBA的AUC为0.828,显示出较高的诊断价值,其灵敏度为83.3%。值得注意的是,尽管MCV在鉴别CBA方面表现出较好的诊断效能,但此时95%CI相对较宽,这一现象可能是由于个别CBA患儿囊肿显著增大所致。
有关胆囊形态学在BA产前诊断中的研究已有较多报道[7, 20-21]。胆囊形态学的变化可能是由于胆道闭锁导致胆汁无法正常排出,从而引起胆囊结构和功能上的改变。胆汁淤积不仅会损害肝脏,还会导致胆囊壁的炎症反应,进而使胆囊壁增厚。此外,长期缺乏胆汁流动可能导致胆囊萎缩或变形。这些发现对于产前诊断具有重要意义,为医师提供了早期识别CBA的线索。在本研究中,CBA患儿胆囊的典型超声表现包括“胆囊壁增厚且僵硬”、“胆囊呈管状扭曲”、“胆囊内壁不光滑”以及“胆囊萎缩”。本研究中有14例(占38%)CBA患儿的超声报告中有上述描述,而在CC组患儿中并未观察到这些特征。Casaccia等[7]提出,小囊肿和胆囊缺失是提示BA的重要超声表现。本研究发现,在CBA患儿中有5例(13.5%)表现为“胆囊不可见”,而在对照组中,有7例在初次检查时提示“胆囊不可见”,但在随后的检查中又观察到了胆囊。因此,如果怀疑“胆囊缺失”,必须进行重复检查。
产前诊断中发现的肝门区囊肿常常引起孕妇焦虑,甚至导致一些孕妇终止妊娠。另外,异常的超声检查结果也提醒父母需在婴儿出生后尽早寻求医疗咨询,以避免错过CBA的最佳手术时机。即使在出生后,仅依靠超声或MRI进行鉴别诊断也是具有挑战性的,通常还需要结合血清生化检查等辅助手段来进行确诊。在本研究中,HPE的平均年龄为49 d,远低于另一项多中心研究[21]。这表明参与本研究的医疗机构对CBA的产前和产后诊断给予了足够的重视,同时也凸显了本研究在临床实践中的重要价值。
目前,已建立的BA大规模筛查方法包括粪便颜色卡、CB/直接胆红素(direct bilirubin,DB)测定、粪便颜色饱和度,以及一些新的生化方法,包括尿硫酸胆汁酸测定、血清MMP7等。尽管粪便颜色卡被认为是基于人群筛查的最具成本效益的方法,但一些研究表明,CB/DB筛查更为敏感,且接受HPE的患儿年龄更小。很少有研究报道TBA在BA筛查中的应用。Zhou等[19]报道,与对照组相比,出生3~4 d的BA婴儿TBA显著增加,其AUC为75%。对于产前发现的异常,应首先进行针对性检查。我们在临床中发现,大多数CBA婴儿出生后有正常胎便,直到出生后2~3周才排出“白色”便,这比血清生化指标中CB和TBA值升高的时间要晚得多。因此,我们认为粪便颜色卡筛查不适合用于出生后2周内的早期诊断。
血清生化检查发现,CBA婴儿的CB和TBA自出生后第1周开始增加,此后持续高于CC婴儿。尽管在一些CC患儿中,由于囊肿较大、合并胆泥等原因表现为一定程度的胆道梗阻,但这些患儿的血清生化中是CB而不是TBA略有增加。比较出生后前2周的CB和TBA,对鉴别CBA和CC有较好的诊断作用。当优先考虑诊断的灵敏度时,第1周CB在24 μmol/L和第2周TBA在21 μmol/L时,其诊断的灵敏度可达100%。这意味着在这些阈值下,几乎所有CBA病例都可以被识别出来,这对于避免漏诊具有重要意义。尽管CB和TBA在出生后2周内的AUC没有显著差异,但动态监测这两种指标的变化趋势仍然可以为早期诊断提供有价值的信息。特别是在第1周CB达到24 μmol/L和第2周TBA达到21 μmol/L的情况下,可以作为临床上早期识别CBA的重要依据。
本研究存在一定的局限性。首先,作为一项多中心研究,各中心患儿的依从性不同,导致收集到的数据不完整,限制了可以进行连续分析的患儿数量。其次,各中心的超声检查报告模板不一致,导致对胆囊的描述缺乏统一的标准。最后,本研究的结果尚未经过前瞻性研究验证。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 童明欣负责文献检索、研究结果分析与讨论、论文撰写,张志波负责论文设计,其他作者负责数据收集,冯杰雄负责全文知识性内容的审读与修正
| [1] |
Hartley JL, Davenport M, Kelly DA. Biliary atresia[J]. Lancet, 2009, 374(9702): 1704-1713. DOI:10.1016/S0140-6736(09)60946-6 |
| [2] |
Bezerra JA, Wells RG, Mack CL, et al. Biliary atresia: clinical and research challenges for the Twenty-First century[J]. Hepatology, 2018, 68(3): 1163-1173. DOI:10.1002/hep.29905 |
| [3] |
Chung PHY, Zheng S, Tam PKH. Biliary atresia: east versus west[J]. Semin Pediatr Surg, 2020, 29(4): 150950. DOI:10.1016/j.sempedsurg.2020.150950 |
| [4] |
Serinet MO, Wildhaber BE, Broué P, et al. Impact of age at Kasai operation on its results in late childhood and adolescence: a rational basis for biliary atresia screening[J]. Pediatrics, 2009, 123(5): 1280-1286. DOI:10.1542/peds.2008-1949 |
| [5] |
Lakshminarayanan B, Davenport M. Biliary atresia: A comprehensive review[J]. Autoimmun, 2016, 73: 1-9. DOI:10.1016/j.jaut.2016.06.005 |
| [6] |
Scottoni F, Davenport M. Biliary atresia: potential for a new decade[J]. Semin Pediatr Surg, 2020, 29(4): 150940. DOI:10.1016/j.sempedsurg.2020.150940 |
| [7] |
Casaccia G, Bilancioni E, Nahom A, et al. Cystic anomalies of biliary tree in the fetus: is it possible to make a more specific prenatal diagnosis?[J]. J Pediatr Surg, 2002, 37(8): 1191-1194. DOI:10.1053/jpsu.2002.34470 |
| [8] |
Yang D, Li L, Diao M, et al. Prenatal diagnosis at different gestational times and clinical features of choledochal cysts: a single tertiary center report[J]. Pediatr Surg Int, 2023, 39(1): 105. DOI:10.1007/s00383-023-05374-5 |
| [9] |
Shin HJ, Yoon H, Han SJ, et al. Key imaging features for differentiating cystic biliary atresia from choledochal cyst: prenatal ultrasonography and postnatal ultrasonography and MRI[J]. Ultrasonography, 2021, 40(2): 301-311. DOI:10.14366/usg.20061 |
| [10] |
Yu P, Dong N, Pan YK, et al. Comparison between cystic biliary atresia and choledochal cyst: a clinical controlled study[J]. Pediatr Surg Int, 2022, 38(1): 109-114. DOI:10.1007/s00383-021-05004-y |
| [11] |
Caponcelli E, Knisely AS, Davenport M. Cystic biliary atresia: an etiologic and prognostic subgroup[J]. J Pediatr Surg, 2008, 43(9): 1619-1624. DOI:10.1016/j.jpedsurg.2007.12.058 |
| [12] |
Harpavat S, Garcia-Prats JA, Anaya C, et al. Diagnostic yield of newborn screening for biliary atresia using direct or conjugated bilirubin measurements[J]. JAMA, 2020, 323(12): 1141-1150. DOI:10.1001/jama.2020.0837 |
| [13] |
Harpavat S, Garcia-Prats JA, Shneider BL. Newborn bilirubin screening for biliary atresia[J]. N Engl J Med, 2016, 375(6): 605-606. DOI:10.1056/NEJMc1601230 |
| [14] |
Harpavat S, Finegold MJ, Karpen SJ. Patients with biliary atresia have elevated direct/conjugated bilirubin levels shortly after birth[J]. Pediatrics, 2011, 128(6): e1428-e1433. DOI:10.1542/peds.2011-1869 |
| [15] |
Gong ZH, Wu YB, Zheng LL, et al. Can free carnitine or bilirubin in blood be used in neonatal screening for biliary atresia?[J]. Eur J Pediatr Surg, 2020, 30(5): 459-464. DOI:10.1055/s-0039-1698764 |
| [16] |
Noorulla F, Dedon R, Maisels MJ. Association of early direct bilirubin levels and biliary atresia among neonates[J]. JAMA Netw Open, 2019, 2(10): e1913321. DOI:10.1001/jamanetworkopen.2019.13321 |
| [17] |
Kastenberg ZJ, Deneau MR, O'Brien EA, et al. Fractionated bilirubin among 252 892 Utah newborns with and without biliary atresia: a 15-year historical birth cohort study[J]. J Pediatr, 2023, 257: 113339. DOI:10.1016/j.jpeds.2022.12.041 |
| [18] |
Hoshino E, Moriwaki K, Morimoto K, et al. Cost-effectiveness analysis of universal screening for biliary atresia in Japan[J]. J Pediatr, 2023, 253: 101-106.e2. DOI:10.1016/j.jpeds.2022.09.028 |
| [19] |
Zhou KJ, Lin N, Xiao YT, et al. Elevated bile acids in newborns with Biliary Atresia (BA)[J]. PLoS One, 2012, 7(11): e49270. DOI:10.1371/journal.pone.0049270 |
| [20] |
Chen LZ, He FJ, Zeng KH, et al. Differentiation of cystic biliary atresia and choledochal cysts using prenatal ultrasonography[J]. Ultrasonography, 2022, 41(1): 140-149. DOI:10.14366/usg.21028 |
| [21] |
詹江华, 余晨. 胆道闭锁发病机制研究概述与启示[J]. 临床小儿外科杂志, 2018, 17(11): 801-804. Zhan JH, Yu C. An overview and enlightenment of the pathogenesis of biliary atresia[J]. J Clin Ped Sur, 2018, 17(11): 801-804. DOI:10.3969/j.issn.1671-6353.2018.11.001 |
 2024, Vol. 23
2024, Vol. 23


