2. 国家儿童区域医疗中心 广州医科大学附属妇女儿童医疗中心新生儿外科监护室, 广州 510623
2. Department of Surgical Neonatal Intensive Care Unit, Municipal Women & Children's Medical Center, Guangzhou Medical University, National Children's Regional Medical Center, Guangzhou 510623, China
畸胎瘤是源自胎儿生殖细胞层的多能体细胞干细胞肿瘤,理论上可以形成多种软组织结构[1]。畸胎瘤通常发生在性腺,也可以在松果体至尾骨中线任一水平上发展。在胎儿和新生儿中,骶尾部畸胎瘤(sacrococcygeal teratoma, SCT)是最常见的性腺外肿瘤,发病率接近1/27 000,男女发病比例约1 : 3[2-4]。既往文献报道经产前诊断为骶尾部畸胎瘤的胎儿病死率高达63%[5]。产前产后全过程多学科诊疗模式(multidisciplinary treatment, MDT)有望降低胎儿不良结局的发生率,改善预后。本研究旨在回顾性分析广州医科大学附属妇女儿童医疗中心经产前产后多学科诊疗模式管理的胎儿骶尾部畸胎瘤(fetal sacrococcygeal teratoma, FSCT)患儿临床资料、诊疗方案及出生后结局,探讨FSCT产前产后多学科诊疗模式的临床经验。
资料与方法 一、研究对象本研究为回顾性研究。选择2015年1月至2024年6月广州医科大学附属妇女儿童医疗中心收治的44例FSCT患儿作为研究对象。纳入标准:产前经超声诊断并在胎儿会诊中心咨询的FSCT。排除标准:出生后发现及收治的SCT。根据孕期超声测量肿瘤长径分为高危组(肿瘤最大长径>10 cm)和低危组(长径≤10 cm),本研究已通过广州医科大学附属妇女儿童医疗中心伦理委员会批准(穗妇儿科伦批字[2024]第484A01号)。
二、FSCT的产前产后全过程多学科诊疗模式 (一) 产前诊断及评估产前诊断主要以超声检查为主,针对经本院或外院筛查怀疑合并FSCT的孕妇进行检查,但孕期会接受一次核磁共振(magnetic resonance, MRI)检查。产前评估内容包括首次发现孕周、超声及磁共振,超声评估内容包括肿瘤体积(tumor volume, TV)、肿瘤体积指数(tumor volume index, TVI)、肿瘤体积/胎儿体重(tumor volume/fetal weight, TFR)、SCT生长速率(SCT growth rate, SCTs)、心输出量(cardiac output, CCO)、胎儿水肿以及羊水过多等,排除存在严重出生缺陷或染色体异常病例。高危指标包括:TVI>60 cm3/cm,TFR>0.12,SCTs>61 cm3/周,CCO>625 mL·kg-1·min-1。
(二) 产前咨询产前咨询主要由本院胎儿/新生儿外科MDT团队根据B超及MRI检查结果(如TV、TVI、TFR、SCTs、CCO等)进行综合分析和讨论,告知孕妇及家属妊娠风险、治疗方法、预后以及大概费用情况等,指导孕妇详细随访方案。
(三) 产前产后多学科管理如果胎儿小于24周,合并胎儿水肿或心力衰竭、或严重致死性结构异常、或染色体异常,则由MDT团队讨论后,建议终止妊娠。对于瘤体长径>10 cm或实体成分长径>5 cm胎儿,如无其他高危因素,可于妊娠36周后剖宫产娩出;对于瘤体长径≤10 cm或实体成分长径≤5 cm胎儿,如无剖宫产指针,则尽量选择经阴道自然分娩。患儿生后转入新生儿外科监护室(neonatal surgical intensive care unit, SNICU)进一步治疗。
(四) 围术期管理患儿出生后一经确诊,应积极做好术前准备,及早手术切除。术前准备包括评估有无瘤体破裂出血,肛门指诊,骶尾部CT检查,脊柱MRI检查,心脏超声以及术前甲胎蛋白(α-fetoprotein, AFP)、人绒毛膜促性腺激素β亚基(β-human chorionic gonadotropin, β-HCG)检测。术前讨论应由新生儿外科、麻醉科、影像科及重症监护科组成的多学科团队完成,旨在综合评估患儿病情,明确畸胎瘤的性质和分类,评估是否存在手术禁忌证,并制定相应的手术方案。手术时机选择需依据患儿具体情况,通常可分为急诊手术和亚急诊手术。急诊手术适用于肿瘤破溃或感染者,无肿瘤破溃或感染者属于亚急诊手术范畴。术前应留置尿管,采取骶尾部入路切除肿瘤。术中游离肿瘤至尾骨时,需使用电刀切除尾骨尖,并注意避免脑脊液漏出。此外,需注意切除肿瘤浸润部分的耻骨直肠肌,切除后对其进行重建。术毕常规留置引流管。
(五) 术后计划和随访对于恶性畸胎瘤,采取包括手术、手术后化疗以及定期门诊随访的综合治疗模式;对于良性和未成熟性畸胎瘤,术后采取定期门诊随访。
SCT手术后组织学分型按Gonzalez-Crussi分级,分级为0、Ⅰ、Ⅱ级者术后采取常规随访策略,即术后3个月、6个月以及1年监测AFP、β-HCG水平,进行原发部位影像学检查,评估有无复发,36月龄时评估肛门直肠功能和尿控功能[6];分级为Ⅲ级的未成熟型畸胎瘤,术后不予化疗,采取密切随访策略,即术后1、2、3、6、9、12、18、24、30及36个月持续监测AFP、β-HCG水平,进行原发部位影像学检查,评估有无复发,36月龄时评估肛门直肠功能和尿控功能;对于恶性畸胎瘤,经MDT讨论后,根据肿瘤分级采用个体化疗方案[7]。
如出现复发或复发高危因素,则由新生儿外科、肿瘤内外科、影像科进行多学科讨论后,采取包括直接手术切除或病理活检或化疗等个体化治疗方案。
三、相关定义TV:指产前超声测量肿瘤体积(长×宽×深×0.523 cm3);TVI:指通过椭球公式计算肿瘤大小为肿瘤体积(cm3)/双顶径(cm);TFR:为肿瘤体积(cm3)/胎儿体重(g);SCTs:妊娠晚期和早期超声检查肿瘤体积差/两次评估的时间差(cm3/周)。
四、资料收集通过查阅电子病历系统收集患儿临床资料。①产前资料:首次诊断胎龄,产前超声评估指标:肿瘤最大长径、最大TV、首次及最大TVI、TVI、首次及最大TFR、SCTs、CCO、有无胎儿水肿以及羊水过多;②结局:是否早产,是否存活,有无复发;不良结局定义为宫内死亡、引产、出生后死亡。
五、统计学处理应用SPSS 25.0进行数据分析。计量资料以M(Q1,Q3)表示,组间比较采用两独立样本Mann-Whitney U检验。计数资料以例(%)表示,两组比较采用卡方检验或Fisher精确概率法。P < 0.05为差异有统计学意义。
结果 一、FSCT患儿产前资料与临床结局研究期间共收治48例FSCT患儿,其中4例失访,最终44例纳入研究。44例患儿诊断时孕周24.28 (20.57, 29.86)周,瘤体长径6(3.6, 13.38)cm,最大TV 112.85(19.09,332.20)cm3,首次TVI 68.03(1.36,25.31);最大TVI 16.47(2.95,56.21),首次TFR 0.03(0.01,0.19),最大TFR 0.05(0.01,0.32)。SCTs 25.85(7.61,154.31)cm3/周。6例(6/44,13.6%)合并羊水过多。8例(8/44, 18.2%)CCO>625 mL·kg-1·min-1。
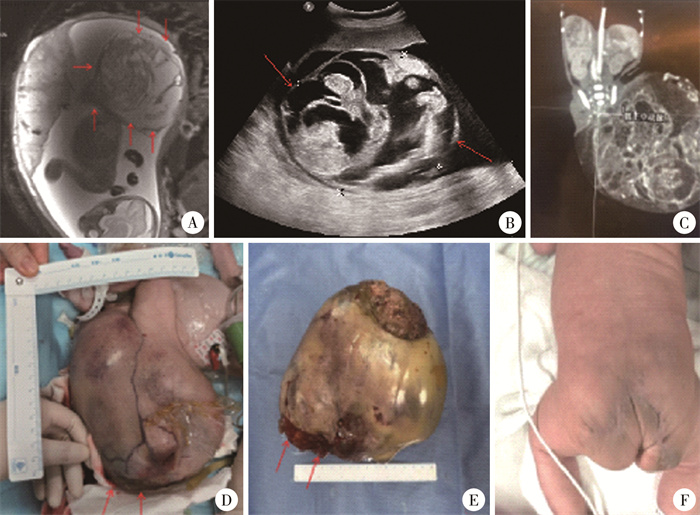
44例FSCT中,17例发生不良结局;28例活产出生,出生胎龄38.3(30.28~44.28)周,其中10例早产。27例存活(96.43%),1例死亡(3.57%)。27例存活患儿于新生儿期接受完整手术切除,手术日龄6(3, 15)d,住院时间为15(9, 42)d。1例在胎儿28周时MRI及B超提示囊实性肿块,约113 mm×147 mm×142 mm大小,TVI 176.41,TFR 0.78,SCTs为571.95 cm3/周,按产前产后多学科诊疗模式管理,于胎龄30+2周剖宫产娩出,出生体重2.8 kg,出生时出现瘤体破损、内环境紊乱,考虑存在瘤内溶解综合征,经MTD讨论后急诊行骶尾部畸胎瘤切除术,术后病理结果提示为未成熟性畸胎瘤(Ⅲ级),AFP由术前190 510 ng/mL逐渐降至1 830 ng/mL(术后2个月),经MDT讨论后未行化疗,密切随访,目前无复发(图 1)。1例高危组患儿于妊娠28周出现胎儿水肿、心力衰竭,孕32周剖宫产时肿瘤破溃出血,未能创造急诊手术条件,生后3 h死亡。
|
图 1 1例骶尾部畸胎瘤早产儿治疗过程 Fig.1 Treatment of a premature neonate with FSCT 注 A:孕28周时胎儿MRI提示巨大囊实性肿物(113 mm×147 mm×142 mm);B:孕28周时胎儿B超提示巨大囊实性肿物(131 mm×122 mm×152 mm);C:生后CT扫描提示巨大囊实性肿物,骶正中动脉供血支;D:患儿出生时肿物照片, 箭头示肿瘤破溃;E:手术完整切除肿物,肿物重1.67 kg;F:术后3个月随访时臀部外观 |
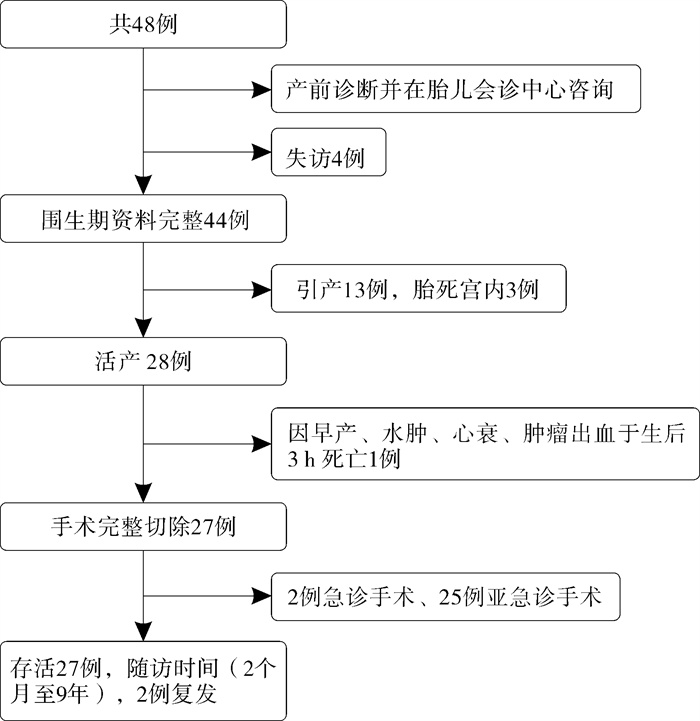
17例胎儿不良结局中,1例出生后死亡,3例宫内死亡(均为低危组,1例胎儿合并双肾增大、膀胱增大、羊水少,于孕33+周胎死宫内;1例孕妇存在桥本氏甲状腺炎,孕29周出现胎儿水肿、颅内出血,孕29周胎死宫内;1例未明确高危因素,于24+周胎死宫内),13例引产(2例为高危组,11例低危组),见图 2。
|
图 2 44例胎儿骶尾部畸胎瘤患儿临床结局 Fig.2 Clinical outcomes of FSCT |
27例手术后存活患儿按照Gonzalez-Crussi病理分级系统,0级7例,1级11例,2级5例,3级4例。手术后均未化疗,予规范随访,最长随访时间9年,其中25例AFP正常,影像学检查无复发;2例(2/27, 7.4%)复发,但患儿第一次手术时病理检查均未提示恶性成分。1例术后9个月AFP升高,MRI提示原切除部位复发,手术后予化疗;1例于术后2年复发,病理活检提示恶性复发,经化疗后病灶缩小,予手术切除后继续原化疗方案;上述两例均存活。27例手术患儿中,3例早期出现大便次数增多,其中1例随访至1岁3个月后控便能力明显好转;1例术中分离肿物时损伤直肠,予间断缝合修补后预后良好;8例出现切口愈合不良,经治疗后痊愈。
二、高危组与低危组FSCT患儿的产前资料及临床结局高危组11例,低危组33例。高危组首次诊断时胎龄较小,瘤体最大长径、最大TV、首次TVI、最大TVI、首次TVI、最大TFR以及SCTs明显较低危组大(P < 0.05)。高危组出现高CCO、羊水多以及早产的风险明显高于低危组(P < 0.05)。两组总体存活率差异无统计学意义(P > 0.05),高危组与低危组FSCT患儿的一般资料及临床结局见表 1。
| 表 1 两组骶尾部畸胎瘤患儿的产前资料及临床结局 Table 1 Prenatal profiles and clinical outcomes of two groups of FSCT |
|
|
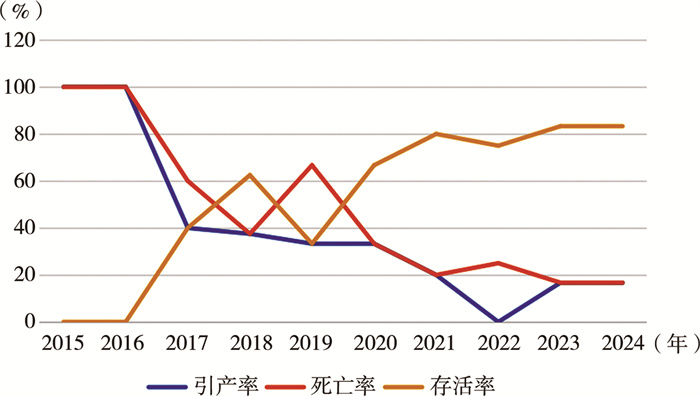
本中心在产前产后全过程多学科诊疗模式刚开始运行时,FSCT胎儿引产率较高,最初两年达100%,胎死宫内数量较多,整体存活率不高。之后引产率逐年下降,存活率逐年上升。近两年无一例因FSCT引产,近5年FSCT死亡率16.7% ~25%,存活率75% ~83.3%,见图 3。
|
图 3 广州医科大学附属妇女儿童医疗中心近10年胎儿骶尾部畸胎瘤患儿引产率、死亡率及存活率情况 Fig.3 Induced abortion rate, mortality rate and survival rate of FSCT |
FSCT由于血供丰富以及肿瘤快速生长特性,可能导致高输出量心力衰竭、羊水过多、胎儿水肿等,高危型SCT即使经过产前宫内干预或提前终止妊娠等措施,围产期病死率仍然高达63%[5]。本研究通过回顾性分析44例FSCT患儿产前产后多学科
全过程管理的经验与结果,发现SCT的总体存活率达61.4%(27/44),病死率38.6%(17/44,其中3例宫内死亡、13例引产、1例出生后死亡,病死率远低于既往文献报道[5]。随着产前产后全过程多学科诊疗模式的推行,FSCT的引产率及死亡率呈逐年下降趋势。产前产后全过程多学科管理模式可显著改善FSCT的临床结局。
一、FSCT的产前诊断及风险评估孕期通过超声、MRI不仅可对胎儿骶尾部畸胎瘤进行产前诊断,而且B超可用于监测FSCT的增长情况及并发症。有研究证实,产前超声诊断FSCT的灵敏度接近100%,特异度达96.6%[8]。本研究中,FSCT的首次超声诊断孕周为24.28(20.57, 29.86)周,提示该疾病在孕中期较常见,与既往研究结论一致[5]。目前孕期评估指标主要包括肿瘤TV、TVI、TFR、SCTs、CCO、有无胎儿水肿以及羊水过多等[9-11]。由于FSCT生长速度个体差异大,对妊娠结局的影响也不同。有研究提出,肿瘤生长快速阶段先于胎盘肿大和水肿的发展,提示胎儿有死亡的风险,建议对胎儿进行干预。因此,系统超声评估肿瘤发展趋势有利于指导临床抉择。有作者提出,TVI可以预测骶尾部畸胎瘤新生儿的存活率,TVI > 60 cm3/cm预测新生儿死亡的敏感度和特异度均为100%[9]。而妊娠24周前TFR>0.12是预测胎儿不良预后的最佳指标,往往提示发生水肿、死胎或围产儿死亡的风险较高。也有文献报道,孕32周前TFR最佳截断值>0.11是预测胎儿不良预后的最敏感和最特异指标[10]。本研究中,TVI为2.95~56.21,首次检测TFR波动在0.01~0.19,提示部分患儿预后不良。SCTs和CCO也可以作为肿瘤精准评估的指标,SCTs是一项有效的不良结局预测指标,SCTs>61 cm3/周时,预测不良预后的敏感度为82%,特异度为82%;而CCO > 625 mL·kg-1·min-1时,存在肿瘤内出血、贫血、羊水急剧增加及母体镜像综合征(mirror syndrome)的风险[11]。本研究中,SCTs为25.85 cm3/周及CCO > 625 mL·kg-1·min-1提示FSCT可能出现预后不良。此外,羊水过多也可能预示FSCT预后不良。因此,合理利用超声检查对FSCT进行产前诊断和风险评估,可为产前咨询和分娩后处理提供更好的依据。
结合既往研究及本中心经验,本研究采取肿瘤长径大小作为判断高低危患儿的初筛指标,高危组患儿TV、TVI、TFR、SCTs以及CCO的中位数值均提示预后不良风险,但11例FSCT中仅2例患儿家属选择引产,最终8例存活,存活率占活产胎儿的88.9%,总体死亡率为27.3%,明显低于既往研究报道,提示本中心提出的产前产后多学科诊疗模式能有效改善临床结局[12]。低危组患儿尽管监测的超声指标中位数均低于阈值,最终仍有11例引产,导致FSCT患儿整体死亡率升高。这可能与国内对该疾病的认识不同有关,之前国内有文献报道FSCT引产率为40%,远高于本研究[13-14]。本研究中,低危组的另外19例活产胎儿均存活,预后良好。且随着产前产后全过程多学科管理模式的推行,引产率逐年下降,FSCT的死亡率也逐年下降,存活率逐年升高,提示产前产后全过程多学科管理模式能有效改善FSCT的临床结局。建议在产前产后全过程多学科管理中,提高对FSCT的认识,形成更为精准的超声评估,以识别产前产后高危因素,并且强调家庭参与,对家属给予更多的心理支持。
二、高危组FSCT的精细化管理既往研究表明,高危组FSCT早产、高CCO及羊水过多的风险显著增加,且可能加剧胎儿病情,影响产前产后生存结局[11]。文献报道超声检查胎儿实质性SCT长径>10 cm,且瘤体血供丰富,预示胎儿死亡率约为50%[15]。高危FSCT胎儿的死亡率为40% ~50%,常由低阻力、快速生长的肿瘤引起动静脉分流,导致高输出量心力衰竭。此外,肿瘤内出血可能引起贫血,进而导致胎儿水肿,最终在胎儿水肿的晚期可能导致母体镜像综合征的发生。在出现胎儿水肿及肿瘤内出血的情况下,延迟分娩的生存率仅42%。因此,当胎儿出现腹水、头皮水肿、胎盘肿大恶化和贫血等先兆时,支持在27~32周提前分娩[15]。相反,对于胎龄较小的胎儿,即使有宫内肿瘤内出血的高风险,保持宫内对胎儿存活是必要的[16]。因分娩孕周可以影响骶尾部畸胎瘤胎儿的短期预后,因此,无论采用何种分娩方式或是否有必要在胎儿期进行干预,监测并发症(包括羊水过多)都可以预防早产,改善可能的不良结局。另外,有文献报道宫外产时手术治疗巨大FSCT合并心功能衰竭获存活的病例[17]。本研究中,1例高危组患儿出生后死亡,该患儿在胎龄28周时即出现胎儿水肿、心力衰竭,胎龄32周剖宫产时肿瘤破溃出血,失去急诊手术条件,于生后3 h死亡。结合既往研究,对于个别高危病例,及时终止妊娠或进行产时手术,可能会改变不良结局,这也是未来产前产后全过程多学科管理模式需要改进的地方。另外,本研究中有1例高危组患儿,系列超声随访监测到胎儿水肿、心力衰竭趋势,出生胎龄30+2周,生后短时间出现肿瘤内溶解,经急诊手术治疗后存活。这些高危病例均提示产前产后全过程管理需要更系统精准的超声评估,以识别高危因素,只有通过MDT为FSCT胎儿提供更全面的评估和更合适的治疗计划,加以精细化管理,才能提高FSCT的救治成功率,降低死亡率。
三、围手术期管理患儿出生后一经确诊,即应做好术前准备,及早手术切除。手术时机的选择视患儿情况而定,通常分为急诊手术与亚急诊手术。当骶尾部肿瘤出现破溃、恶化或感染或肿瘤溶解综合征时应采取急诊手术,必要时分娩后即刻手术,此与之前文献提及的手术时机一致[18];而肿瘤未出现破溃或感染的情况均属亚急诊手术,应于完善检查、MDT讨论后尽早手术切除。本研究中,27例新生儿接受完整手术切除,手术日龄6(3~15)d。大部分患儿为亚急诊手术,1例早产患儿因为生后出现肿瘤溶解,急诊手术治疗后存活。国外报道了一例FSCT早产儿,术前出现自发性肿瘤溶解综合征,于生后40 h手术治疗,最终患儿存活[19]。因此,早期识别和治疗肿瘤溶解综合征,及时切除SCT非常重要。本院出生并存活的27例患儿住院时间15(9~42)d,与既往文献报道的住院时间2周左右基本一致[5]。
四、术后随访手术后的随访至关重要。2024年荷兰的一项研究指出,术后随访应在出院后1~2周、6周、3个月、6个月和1年进行;首次切除后的前三年随访为每3个月1次;随访内容包括体格检查、血清AFP水平及腹部超声检查[20]。本研究中,新生儿期接受手术切除的患儿普遍预后良好,仅2例(7.4%)术后出现恶性复发,经后续综合治疗后存活。研究表明,SCT复发的高危因素包括:肿瘤组织残留,尾骨残留,第一次手术中肿瘤破裂,病理结果含卵黄囊瘤成分[21]。因此,在手术过程中,彻底切除肿瘤,包括尾骨,可能是减少复发的方法。关于新生儿特别是早产儿Ⅲ级未成熟畸胎瘤手术后是否化疗目前尚存在争议,文献报道胎儿、早产儿未成熟畸胎瘤,甚至含卵黄囊等恶性成分者仍有转为良性或消失的可能。基于恶性畸胎瘤综合治疗效果良好、MDT团队密切随访流程清晰、早产儿或新生儿化疗副作用较大等因素,我们对Ⅲ级未成熟畸胎瘤患儿均采取积极密切随访AFP及影像学的策略[22-23]。
综上所述,FSCT能在产前进行诊断并精准评估肿瘤,这为胎儿会诊提供了客观依据,并有助于实施适当的产前咨询以及分娩后处理。对于高危FSCT应尽早识别,进行精细化管理,积极探索分娩及手术时机,以改善不良结局。在产前产后多学科诊疗模式的规范化管理下,FSCT预后良好,流程化管理模式值得推广。同时,随着医疗技术的进步和多学科诊疗模式的不断完善,应进一步优化长期随访方案,以提高患儿的生存质量和改善远期预后。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 侯龙龙与吕俊健负责文献检索,何秋明与钟微负责论文设计,徐素婷与夏波负责数据收集,夏波负责研究结果分析与讨论,侯龙龙负责论文撰写;钟微负责全文知识性内容的审读与修正
| [1] |
Cass DL. Fetal abdominal tumors and cysts[J]. Transl Pediatr, 2021, 10(5): 1530-1541. DOI:10.21037/tp-20-440 |
| [2] |
Marcu ML, Bacalbaşa N, Candrea E, et al. Fetal sacrococcygeal immature teratoma-report of two cases and review of the literature[J]. Rom J Morphol Embryol, 2022, 63(1): 203-207. DOI:10.47162/RJME.63.1.22 |
| [3] |
朱海涛, 沈淳. 胎儿骶尾部畸胎瘤的产前诊治策略[J]. 中华妇幼临床医学杂志(电子版), 2021, 17(3): 268-272. Zhu HT, Shen C. Prenatal strategies for fetal sacrococcygeal teratoma[J]. Chin J Obstet Gynecol Pediatr(Electron Ed), 2021, 17(3): 268-272. DOI:10.3877/cma.j.issn.1673-5250.2021.03.005 |
| [4] |
Fumino S, Hirohata Y, Takayama S, et al. Long-term outcomes of infantile sacrococcygeal teratoma: results from a multi-institutional retrospective observational study in Japan[J]. J Pediatr Surg, 2024, 59(4): 587-592. DOI:10.1016/j.jpedsurg.2023.11.016 |
| [5] |
田松, 朱小春, 肖尚杰, 等. 新生儿骶尾部畸胎瘤的产前诊断与多学科协作模式治疗[J]. 临床小儿外科杂志, 2022, 21(9): 844-849. Tian S, Zhu XC, Xiao SJ, et al. Prenatal diagnosis and multidisciplinary treatment mode of neonatal sacrococcygeal teratoma[J]. J Clin Ped Sur, 2022, 21(9): 844-849. DOI:10.3760/cma.j.cn101785-202106067-009 |
| [6] |
Harms D, Zahn S, Göbel U, et al. Pathology and molecular biology of teratomas in childhood and adolescence[J]. Klin Padiatr, 2006, 218(6): 296-302. DOI:10.1055/s-2006-942271 |
| [7] |
Cushing B, Giller R, Cullen JW, et al. Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study: Pediatric Oncology Group 9049 and Children's Cancer Group 8882[J]. J Clin Oncol, 2004, 22(13): 2691-2700. DOI:10.1200/JCO.2004.08.015 |
| [8] |
Arisoy R, Erdogdu E, Kumru P, et al. Prenatal diagnosis and outcomes of fetal teratomas[J]. J Clin Ultrasound, 2016, 44(2): 118-125. DOI:10.1002/jcu.22310 |
| [9] |
van Heurn LJ, Coumans ABC, Derikx JPM, et al. Factors associated with poor outcome in fetuses prenatally diagnosed with sacrococcygeal teratoma[J]. Prenat Diagn, 2021, 41(11): 1430-1438. DOI:10.1002/pd.6026 |
| [10] |
Gebb JS, Khalek N, Qamar H, et al. High tumor volume to fetal weight ratio is associated with worse fetal outcomes and increased maternal risk in fetuses with sacrococcygeal teratoma[J]. Fetal Diagn Ther, 2019, 45(2): 94-101. DOI:10.1159/000486782 |
| [11] |
Wohlmuth C, Bergh E, Bell C, et al. Clinical monitoring of sacrococcygeal teratoma[J]. Fetal Diagn Ther, 2019, 46(5): 333-340. DOI:10.1159/000496841 |
| [12] |
Baumgarten HD, Gebb JS, Khalek N, et al. Preemptive delivery and immediate resection for fetuses with high-risk sacrococcygeal teratomas[J]. Fetal Diagn Ther, 2019, 45(3): 137-144. DOI:10.1159/000487542 |
| [13] |
周微笑, 陈璐, 张艳花, 等. 胎儿骶尾部畸胎瘤的产前诊断和预后影响因素分析[J]. 中华妇产科杂志, 2022, 57(6): 413-418. Zhou WX, Chen L, Zhang YH, et al. Prenatal diagnosis and prognostic factors analysis of fetal sacrococcygeal teratoma[J]. Chin J Obstet Gynecol, 2022, 57(6): 413-418. DOI:10.3760/cma.j.cn112141-20220115-00025 |
| [14] |
Zheng XQ, Yan JY, Xu RL, et al. A clinical analysis of the diagnosis and treatment of fetal sacrococcygeal teratomas[J]. Cancer Manag Res, 2020, 12: 13185-13193. DOI:10.2147/CMAR.S287682 |
| [15] |
Akinkuotu AC, Coleman A, Shue E, et al. Predictors of poor prognosis in prenatally diagnosed sacrococcygeal teratoma: a multiinstitutional review[J]. J Pediatr Surg, 2015, 50(5): 771-774. DOI:10.1016/j.jpedsurg.2015.02.034 |
| [16] |
Konno H, Okpaise OO, Sbragia L, et al. Perinatal outcomes of intrauterine interventions for fetal sacrococcygeal teratoma based on different surgical techniques-a systematic review[J]. J Clin Med, 2024, 13(9): 2649. DOI:10.3390/jcm13092649 |
| [17] |
赵杭燕, 诸纪华, 王金湖, 等. 胎儿巨大骶尾部畸胎瘤宫外产时处理1例[J]. 临床小儿外科杂志, 2022, 21(11): 1098-1100. Zhao HY, Zhu JH, Wang JH, et al. Fetal giant sacrococcygeal teratoma during ex utero intrapartum treatment: one case report[J]. J Clin Ped Sur, 2022, 21(11): 1098-1100. DOI:10.3760/cma.j.cn101785-202201032-019 |
| [18] |
Yao W, Li K, Zheng S, et al. Analysis of recurrence risks for sacrococcygeal teratoma in children[J]. J Pediatr Surg, 2014, 49(12): 1839-1842. DOI:10.1016/j.jpedsurg.2014.09.036.DOI:10.1016/j.jpedsurg.2014.09.036 |
| [19] |
Dey A, Wyrebek R, Torres L, et al. Tumor lysis syndrome in premature infant prompting early resection of a large sacrococcygeal teratoma: a case report[J]. BMC Pediatr, 2023, 23(1): 440. DOI:10.1186/s12887-023-04193-w |
| [20] |
van Heurn LJ, Kremer MEB, de Blaauw I, et al. The diagnostic accuracy of serum alpha-fetoprotein levels in follow-up for recurrence of sacrococcygeal teratoma; a nationwide review of SCT cases in the Netherlands[J]. J Pediatr Surg, 2024, 59(9): 1740-1745. DOI:10.1016/j.jpedsurg.2024.01.048 |
| [21] |
Derikx JPM, De Backer A, van de Schoot L, et al. Long-term functional sequelae of sacrococcygeal teratoma: a national study in The Netherlands[J]. J Pediatr Surg, 2007, 42(6): 1122-1126. DOI:10.1016/j.jpedsurg.2007.01.050 |
| [22] |
Graf JL, Housely HT, Albanese CT, et al. A surprising histological evolution of preterm sacrococcygeal teratoma[J]. J Pediatr Surg, 1998, 33(2): 177-179. DOI:10.1016/s0022-3468(98)90427-4 |
| [23] |
Varlas VN, Cloţea EM, Varlas RG, et al. Immature sacrococcygeal teratoma: a case report and extensive review of the literature[J]. Diagnostics (Basel), 2024, 14(3): 246. DOI:10.3390/diagnostics14030246 |
 2024, Vol. 23
2024, Vol. 23


