先天性胫骨假关节(congenital pseudarthrosis of the tibia, CPT)是一种罕见且治疗复杂的骨骼系统疾病。在儿童骨科领域,CPT因治疗难度极大以及致残率极高而被认知。CPT患儿通常在出生时(或出生后不久)表现出小腿弓状弯曲,X线检查可进一步明确胫骨呈前外侧弯曲畸形,这是CPT的主要临床特征。患儿胫骨一旦发生骨折,几乎不可能自愈,最终导致假关节形成。CPT的发病机制目前尚不完全清楚,但已知遗传因素、骨膜病变可能在CPT进展过程中扮演一定角色。虽然CPT发病率相对较低,但其治疗难度和对患者生活质量的严重影响不容忽视。近年来,中国儿童骨科医师积累了大量CPT相关诊疗经验,并逐渐认识到其治疗需求的迫切性。尽管有经验丰富的医师和研究人员不断努力,却尚未形成一致的、具有临床指导意义的CPT诊疗指导意见。这也正是《先天性胫骨假关节临床诊治专家共识》制定的背景和动机。
为了更好地应对CPT的治疗挑战,推动CPT诊治的规范化和同质化,中华医学会小儿外科学分会小儿骨科学组发起了本次专家共识的编写工作,并邀请了国内相关领域专家,依照循证医学原则编写了首版《先天性胫骨假关节临床诊疗专家共识(2024版)》。
该专家共识提供了一份全面的CPT临床诊治指导意见,囊括了CPT诊断、治疗、手术方法选择、操作要点以及手术并发症处理等方面内容,以期为儿童骨科医师、研究者和医疗机构提供一份全面的参考工具,更好地理解和诊治CPT。共识的制定是多项临床研究与实践的综合总结,具有较高的权威性和可操作性。然而,在参考本共识时,医师应根据患者具体情况和需求,评估潜在的治疗风险,并制定个体化的诊疗方案。
一、CPT的流行病学及临床表现问题1:什么是CPT?CPT的自然病程表现是什么?
推荐意见:CPT是一种罕见的骨骼疾病,通常在新生儿期或学龄前期出现症状。其自然病程特点包括:妊娠期间通过超声检查可发现胎儿胫骨弯曲畸形;出生后,患儿可表现为胫骨前外侧弯曲、病理性骨折、假关节形成,以及可能伴随的膝关节、踝关节畸形和双下肢不等长等并发症(强推荐,陈述同意率95%,证据等级:4级)。
证据概述:胫骨前外侧弯曲是CPT的主要临床特征,通常在出生时或学龄前期即被发现,是常见的临床诊断依据之一。这种前外侧弯曲畸形在一些情况下会随着时间推移而逐渐加重,即使在没有明显外伤的情况下也可能导致胫骨病理性骨折且骨折难以愈合,形成假关节[1]。部分患儿的胫骨近端干骺端逐渐外翻以及远端干骺端外翻等会进一步影响下肢的正常功能[2]。然而,实现假关节的骨性愈合非常具有挑战性,通常需要手术干预。即使成功实现假关节的愈合,仍然存在再骨折的高风险,这增加了治疗的复杂性。一旦骨骼成熟,再骨折的风险会随之降低,通常只在经历严重外伤后才会发生[3]。
问题2:CPT发病率是多少?
推荐意见:CPT是一种罕见病,根据现有文献报道,该病在新生人口中年发病率小于1/140 000(强推荐,陈述同意率为100%,证据等级:4级)。
证据概述:CPT是一种公认的骨骼系统罕见疾病,但其确切发病率尚无确凿数据。不同地区和研究中报道的发病率存在差异。20世纪中叶的一项研究报道,每19万例活产儿中可能存在1例CPT病例[4]。意大利博洛尼亚骨科诊所50年时间内,仅观察到50例CPT患者[5]。加拿大多伦多儿童医院和美国波士顿儿童医疗中心两家单位在40年内共收治了40例CPT患者[6]。美国夏林儿童医院就诊信息显示,CPT患者人数比例低于同时期入院患者总数的0.1%[7]。最近的文献报告显示,不同地区CPT的发病率差异显著,芬兰报道CPT发病率约1/28 000,英国报道CPT发病率约1/190 000[8]。目前文献中引用较多且较为公认的发病率数据为当年出生人口的1/250 000~1/140 000[9-10]。需要注意的是,由于CPT是一种罕见疾病,这些数据可能会因地区和研究对象的不同而有所变化。
问题3:哪一种CPT分型方法最适于临床?
推荐意见3:建议临床使用Crawford分型对CPT进行分类(强推荐,陈述同意率90%,证据等级:4级)。
证据概述:CPT的分型方法多种多样,近年来出现了近10种不同的分型方法,每种方法侧重方面各不同[11]。最早的CPT分型方法可以追溯到1973年,由Andersen[12]首次提出。随后,不同研究者从不同角度提出了CPT的分型方法,包括1982年Boyd[3]结合自然病史发展的X线表现和病理学研究的分型。1986年Crawford等[13]根据CPT患儿胫骨病变的影像学特征提出的分型。Paley[14]根据胫腓骨的完整性、腓骨远端有无近端移位以及胫骨是否存在大段缺损提出了Paley分型:1型为胫腓骨均无骨折;2a型为腓骨骨折但无腓骨近端移位,胫骨无骨折;2b型为腓骨骨折伴腓骨近端移位,胫骨无骨折;3型为胫骨骨折,无腓骨骨折;4a型为胫腓骨骨折,无腓骨近端移位;4b型为胫腓骨骨折伴腓骨近端移位;4c型为胫骨中段大段缺损,腓骨骨折伴近端移位。国内一些研究者也提出了基于CPT患儿就诊时胫骨和腓骨不同X线表现的分型[15]。这些分型方法的提出旨在更好地理解CPT,并指导相关治疗方法的选择。
目前应用最广泛的分型是Crawford分型,它基于CPT患儿胫骨病变的影像学特征提出了以下4型。Ⅰ型:胫骨前外侧弯曲合并骨皮质增厚,髓腔密度增高;Ⅱ型:胫骨前外侧弯曲合并髓腔狭窄,骨小梁缺失;Ⅲ型:胫骨前外侧弯曲合并骨囊性病变;Ⅳ型:胫骨前外侧弯曲合并胫腓骨发育不良,胫骨假关节或腓骨假关节同时存在。根据我国单中心数据,Crawford Ⅰ型占6.1%,Crawford Ⅱ型占20.1%,Crawford Ⅲ型占10.9%,Crawford Ⅳ型占62.9%[9]。
问题4:CPT与神经纤维瘤病之间有什么联系?
推荐意见4:CPT与神经纤维瘤病1型(neurofibromatosis type 1,NF1)之间存在紧密关联。实际上大部分CPT的症状可视为NF1的一种表现(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:CPT与NF1之间存在密切关系。NF1是一种由NF1基因突变引起的常染色体显性遗传病,涉及神经、皮肤、骨骼、眼睛等多系统,患病率为1/3 000~1/2 500,高于CPT在一般人群中的患病率(1/250 000~1/140 000)[16]。虽然NF1患者中出现CPT症状的比例相对较低(约4%),但CPT患者同时被诊断为NF1的比例相对较高(38.5% ~84%)[17]。我国一项针对514例CPT患者进行的横断面研究发现,约有67.9%的CPT患者同时被确诊为NF1[9]。
Zhu等[18]对CPT的基因型与表型进行研究发现:即使80%以上同时诊断为NF1的CPT患者在外周血DNA检测中发现NF1基因致病胚系突变,但携带相同突变的个体发生CPT的一致性不到5%。而在同卵双胞胎的研究中未发现CPT患者特有基因致病胚系突变[19]。所有未同时诊断为NF1的患者均未检测出NF1基因致病胚系突变。对病变骨膜基因检测发现,约21%的非NF1患者有NF1基因体细胞突变,合并NF1的CPT患者中约67%发现NF1基因“二次打击”[19]。此研究结果强调了CPT与NF1之间的关联,尽管其确切机制尚未明确,但大部分CPT患儿的症状可视为NF1的表现之一。
二、CPT的病因、诊断与评估问题5:CPT的病因及病理如何?
推荐意见5:CPT的确切病因尚不明确,但主要病理特征是在假关节周围形成病变骨膜组织和纤维瘤样病变组织,这导致了骨生成能力的降低和骨吸收程度的增加(强推荐,陈述同意率95%,证据等级:3级)。
证据概述:CPT的确切病因目前尚未完全明确,学术界提出了多种理论,包括遗传缺陷、胎儿受压迫、营养缺乏、激素紊乱以及早期神经血管缺陷等。然而,尚未找到确凿的病因解释[20]。
胫骨骨膜病变是导致假关节症状形成的重要原因之一。与正常骨膜相比,CPT患者的骨膜存在差异蛋白表达,表现为与骨生成相关的部分细胞外基质蛋白表达减少、纤维蛋白表达增加等,从而影响局部骨骼的骨生成能力[21]。CPT的主要病理特征是在假关节周围形成一层增厚且供血不足的病变骨膜及纤维瘤样病变组织[22-24]。研究表明,在这些纤维瘤样病变组织来源细胞中,核因子κB配体激活物(receptor activator of nuclear factor-κB ligand,RANKL)的表达水平较高,而骨保护素(osteoclastogenesis inhibitory factor,OPG)水平较低,导致细胞对于骨形态发生蛋白的刺激应答减弱,从而降低了骨生成能力,但增加了破骨细胞分化的可能性[25]。新的研究发现骨膜间充质干细胞内RNA间相互作用与调控异常可影响成骨分化能力改变,可能与假关节形成有关[26]。一些CPT患儿经手术治疗后,假关节部位的骨移植物被迅速吸收,这提供了破骨细胞活性增加的证据。因此目前的共识是,在手术中需要完全切除位于假关节部位及其周围的病变骨膜及纤维瘤样病变组织,这对于有效治疗CPT非常关键[22]。
问题6:如何确诊CPT?
推荐意见6:CPT的诊断通常需要综合考虑患儿的出生史、外伤史及X线影像学检查结果。对于患有神经纤维瘤病的高风险患者,应进行详细的下肢体格检查,并在必要时进行X线检查以确诊(强推荐,陈述同意率85%,证据等级:5级)。
证据概述:CPT的诊断通常是基于患儿病史、临床症状及影像学检查结果。医师需详细询问患儿出生史和外伤史,因为CPT的发病与这些因素密切相关。对于高风险患者(尤其是已诊断为神经纤维瘤病的患者),医师应进行细致的下肢体格检查,以便发现CPT的可能症状。影像学检查在诊断CPT时至关重要,能发现胫骨前外侧弯曲、髓腔狭窄、骨骼囊性病变以及假关节形成等特征。这些影像学特点对确认CPT临床类型和严重程度极为关键。尤其需要注意的是胫骨前外侧弯曲畸形是CPT的重要特征,与其他胫骨畸形(如前内侧弯曲、后内侧成角)有明显不同。综合患儿的临床症状和X线检查结果,医师可以做出CPT的诊断。
三、CPT的临床治疗问题7:目前治疗CPT Crawford Ⅳ型的手术方式有哪些?
推荐意见7:针对CPT Crawford Ⅳ型,手术方式的选择需综合考虑患儿年龄、CPT分型以及是否合并腓骨假关节。目前主流治疗方式包括:①克氏针髓内固定;②联合手术:即胫骨假关节病变骨膜切除、髓内棒固定、伊式架外固定、自体髂骨包裹式植骨术;③“三合一”骨融合术+联合手术;④“四合一”骨融合术+联合手术;⑤胫腓骨交叉联合+髓内固定+钢板内固定术;⑥截肢术(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:CPT Crawford Ⅳ型的具体术式需要考虑患儿年龄以及是否合并腓骨假关节。目前手术方式主要包括以下几种:①克氏针髓内固定:对于1岁以内的Crawford Ⅳ型患儿,克氏针髓内固定是一种有效的治疗方法。它有助于恢复和维持胫骨的机械轴线,使患儿在支具的保护下学习站立和行走,同时防止废用性骨萎缩和胫骨成角畸形的进一步加重,降低二期联合手术的难度[27-28]。②联合手术:联合手术包括多个步骤,通常涉及假关节病变骨膜袖套状切除、包裹式自体髂骨植骨、髓内棒固定以及伊式架外固定术[29]。③“三合一”骨融合术+联合手术:这是一种综合治疗方法,包括骨融合术和联合手术,可应用于假关节断端骨质萎缩特定情况下增加骨性融合面积,以提高治疗效果[30-31]。④“四合一”骨融合术+联合手术:类似于“三合一”方法,这种治疗方案可更好地应对胫骨假关节合并同平面腓骨假关节的复杂CPT情况[32-33]。我国CPT多中心临床研究发现:包裹式植骨联合手术是治疗CPT的一种有效方法,初期愈合率高。单纯运用伊氏架、钢板、弹性髓内针、克氏针等治疗的患儿初期愈合率低,常需要再次手术治疗[34]。⑤胫腓骨交叉融合+髓内固定+钢板内固定:这种方法需要将纤维瘤样病变组织从胫骨和腓骨切除更长的距离,以便形成较长的交叉愈合。⑥当患儿遭遇多次手术失败、面临大段骨缺损,或家属与患儿决定放弃肢体功能恢复时,截肢术成为可选方案。术后借助假肢适配,能一定程度上辅助患儿恢复行动能力,使其逐步回归正常生活。
问题8:CPT合并腓骨假关节时如何治疗?
推荐意见8:对于胫、腓骨假关节断端位于同一平面的情况,可采用“四合一”联合手术;而在假关节断端不处于同一平面,或存在假关节骨质萎缩且需增加骨性融合面积以提高骨性融合率的情况下,可选择联合手术或“三合一”联合手术(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:刘尧喜等[32]报道采用“联合手术+四合一骨融合术”成功治疗12例合并腓骨假关节的CPT患儿。在这项研究中,所有患儿的假关节都在一期实现骨性愈合,且在平均28.5个月的随访时间内未发生再骨折。此外,伍江雁等[30]也报告“联合手术+三合一骨融合术”治疗17例均伴有腓骨完整的CPT患儿的治疗结果。这些患儿成功地实现了假关节一期骨性愈合,平均愈合时间为4.9个月。
问题9:CPT术后常见的并发症有哪些?
推荐意见9:依据CPT并发症发生率的高低,其主要并发症依次为:①踝外翻;②双下肢不等长;③再骨折;④胫骨近端外翻;⑤骨髓炎;⑥髓内棒移位;⑦假关节处骨性不愈合(强推荐,陈述同意率100%,证据等级:4级)。
证据概述:Zhou等[9]在研究336例CPT患儿手术后并发症时发现,主要并发症包括:踝关节外翻(101例,39.60%)、双下肢不等长(91例,35.69%)、再骨折(38例,14.90%)、骨髓炎(15例,5.88%)以及髓内棒内固定移位(10例,3.93%)。此外,刘尧喜等[35]报道了44例经联合手术治疗的CPT患儿,术后胫骨近端外翻的发生率为25.0%。
问题10:导致先天性胫骨前外侧弯曲畸形发生骨折的危险因素有哪些?
推荐意见10:导致先天性胫骨前外侧弯曲畸形发生骨折的危险因素包括胫骨向外侧弯曲畸形角度≥25.55°、胫骨合并骨囊性变以及伴有外伤史(强推荐,陈述同意率90%,证据等级:4级)。
证据概述:湖南省儿童医院研究团队在分析先天性胫骨前外侧弯曲畸形并发胫骨骨折的危险因素时发现,胫骨向外侧弯曲畸形角度、胫骨向前侧弯曲畸形角度、外伤史以及胫骨合并骨囊性变4个因素在组间无骨折生存率上差异具有统计学意义(P < 0.05)。多因素Cox比例风险回归分析结果显示,胫骨向外侧弯曲畸形角度≥25.55°(HR=2.73,P=0.007)、胫骨合并骨囊性变(HR=2.35,P=0.018)、有外伤史(HR=2.65,P=0.004)是骨折发生的促进因素[36]。
问题11:先天性胫骨前外侧弯曲畸形患儿是否需要手术干预?
推荐意见11:目前关于先天性胫骨前外侧弯曲的手术治疗仍缺乏明确的共识和指南。然而,根据最新研究和临床经验,胫骨远端骨骺引导生长技术被认为是该疾病的主要手术治疗方式。这种治疗方法通常需要根据每位患者具体情况来制定方案,因此建议患者在专业医师的指导下接受评估,以确定最合适的治疗方案(强推荐,陈述同意率85%,证据等级:3级)。
证据概述:先天性胫骨前外侧弯曲畸形患儿的干预方式主要包括胫骨远端骨骺引导生长治疗和McFarland手术。胫骨远端骨骺引导生长治疗通过在畸形部位置入钢板和螺钉,利用生长的力量来纠正畸形。该方法相对较为简单、微创,且能保留骨骺的生长能力[37]。McFarland手术则采用异体骨移植,为弯曲的胫骨提供机械支撑,增强稳定性。此方法可以预防骨折,但成功率存在个体差异。据Grill等[38]研究,McFarland手术成功率虽然存在个体差异,但少数患者能改善胫骨弯曲程度。最新研究表明,胫骨远端骨骺引导生长治疗能有效改善胫骨畸形,预防骨折,且相比McFarland手术,不良反应更少[37]。总之,目前关于先天性胫骨前外侧弯曲畸形的循证研究数据较少,有待更高质量的研究报道。
问题12:术后如何评价假关节愈合情况?
推荐意见12:采用胫骨骨折愈合的影像学愈合评分系统(Radiographic Union Scoring System for tibial fracture healing, RUST),RUST评分≥8分即可判定为胫骨假关节骨性愈合(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:2010年,Whelan等[39]引入了一种用于客观评估正常胫骨骨折愈合的放射学评分系统,即RUST;该系统通过对胫骨的正侧位X线片进行评估,即骨折线的清晰度、骨痂的生长情况以及骨皮质的连续性,以评价胫骨骨折的愈合程度。Richards等[40]应用RUST评分系统对12例CPT患者的36组X线片进行评估,包括术前、术后6个月和术后1年3个时间点X线片,研究结果显示,该评分系统同样适用于评估CPT患儿的假关节愈合情况,并且具有良好的一致性。
问题13:CPT行联合手术的远期随访结果如何?
推荐意见13:联合手术治疗儿童CPT初期愈合率高,但远期随访中有一定概率出现CPT术后相关并发症,需要多次手术干预(强推荐,陈述同意率92.5%,证据等级:3级)。
证据概述:刘尧喜等[35]报道采用联合手术治疗44例儿童CPT患儿,其中男33例、女11例,手术时年龄(3.7±2.2)岁,术后随访时间为(10.9±0.7)年(范围:10~11年)。39例(88.6%)实现胫骨假关节初期愈合,愈合时间(4.3±1.1)个月。末次随访时,胫骨不等长36例(81.8%),再骨折20例(45.4%),踝外翻18例(40.9%),胫骨近端外翻9例(20.4%),高弓足11例(25.0%)。9例(20.4%)出现胫骨远端骺板骨桥。17例(38.6%)出现胫骨机械轴线异常。7例(15.9%)出现针道感染,1例(2.3%)出现胫骨骨髓炎。21例(47.7%)患侧股骨过度生长。5例(11.3%)出现踝关节僵硬,34例(77.2%)髓内棒未在胫骨髓腔中央,其中8例(18.1%)胫骨骨皮质凸出。18例患儿骨骼已发育成熟。再骨折发生率较高,但与国外文献报道基本一致。尽管再骨折为最严重的并发症,但有部分患儿通过保守治疗可实现骨折愈合。
问题14:假关节术中切除范围如何界定?
推荐意见14:假关节切除包括软组织切除和骨性组织切除。软组织切除边界在正常骨膜与纤维瘤样病变组织交界处;假关节骨性结构切除范围为两端松脆的骨组织,可保留假关节两端虽有硬化但髓腔仍有血流的骨端(强推荐,陈述同意率92.5%,证据等级:3级)。
证据概述:假关节的切除需要切除骨的病理末端和周围的纤维瘤样病变组织[8]。然而,大范围根治性切除易造成较大范围骨质缺失,并易伤及邻近的神经血管结构。Uchida等[41]认为假关节骨性组织只需切除胫骨碎片的硬化端即可,且不会影响假关节愈合。梅海波等[29]强调术中需钝性分离和显露呈袖套状包裹胫骨假关节的纤维瘤样病变组织,切除范围为假关节平面远近端各2 cm,直至显露出假关节两端正常骨膜为止。在假关节远近端的正常骨膜与纤维瘤样病变组织交界处作环形切开,于胫骨前方再纵行切开假关节周围袖套状纤维瘤样病变组织,经骨膜下剥离后将袖套状纤维瘤样病变组织完整切除;切除假关节两端松脆的骨组织以及纤维组织,保留假关节两端虽有硬化但髓腔仍有血流的骨端,尽可能保留胫骨的长度。
问题15:术中假关节包裹植骨处使用骨形态发生蛋白(bone morphogenetic protein,BMP)是否可以提高假关节骨性愈合率?
推荐意见15:BMP对提高假关节骨性愈合无确切疗效(强推荐,陈述同意率85%,证据等级:3级)。
证据概述:目前关于使用BMP治疗CPT的高质量临床研究有限。rhBMP-2虽然有可能缩短愈合时间,但对提高骨性愈合发生率并无效果[42]。一项关于CPT治疗方式的荟萃研究发现:无论是单纯髓内固定或是通过联合手术治疗CPT,BMP对两种方法治疗后假关节初始愈合率、愈合时间、再骨折发生率均无影响。这项荟萃分析表明使用BMP的好处是不确定的,其主要原因是CPT的临床疗效受到多种因素影响[43]。Ilizarov外固定架技术和髓内固定技术的提高,一定程度上提高了CPT的治疗效果,因此在研究过程中试图分离BMP效应显得较为困难。一项平均随访14.6个月的研究同样支持上述观点,即使用BMP治疗CPT的益处尚不确定。
问题16:手术后或重返日常活动时需要长期佩戴保护性支具吗?
推荐意见16:支具治疗在预防或延迟CPT患者骨折发生,以及手术后再骨折的发生上有重要作用。手术后或在CPT患者重返日常活动时,除洗澡、游泳之外,推荐24 h使用支具来保护并提供下肢载荷负重的支持和稳定,以预防复发,直至佩戴至骨骼成熟(强推荐,陈述同意率90%,证据等级:4级)。
证据概述:支具治疗在CPT的管理中起到了关键作用且具有显著益处。特别是在手术之前,支具的使用有助于预防或延迟CPT患者骨折的发生,这对于缓解病情进展和成年期不适至关重要[44]。此外,手术后佩戴支具可以有效防止骨折复发,确保手术的成功和骨折部位的稳定。不仅如此,支具治疗还能够提供必要的支持和稳定性,以促进骨折的愈合,这在长期康复过程中至关重要。支具的种类包括长腿管型石膏、足踝矫形器(ankle-foot orthosis, AFO)和膝踝足矫形器(knee-ankle-foot orthosis,KAFO),其中AFO通常包括一个强硬的前部支撑,以支持前弯的胫骨,而KAFO可能涵盖更广的肢体范围[45]。支具的设计还可能采用免负荷式小腿矫形器如髌韧带承重(patella tendon bearing,PTB)支具,以更好地适应患者需求[46]。支具的使用需要随着患者的生长而调整,以确保持续的支持和有效的治疗,直到骨骼成熟[47-50]。
问题17:双磷酸盐对于治疗先天性胫骨假关节的疗效是否确切?
推荐意见17:双膦酸盐可被建议作为手术治疗的辅助手段,但其在治疗中的使用方式需要根据个体情况和临床实践来确定(强推荐,陈述同意率87.5%,证据等级:4级)。
证据概述:双磷酸盐治疗可以改善骨密度、减少骨折风险,已被证实可用于治疗儿童骨脆性疾病。其在儿童中应用的安全性已被证实,不会对骨生长和骨形成产生负面影响。此外双磷酸盐通过增加骨小梁数量和骨皮质宽度来促进骨生长和骨形成。这些效应已在相关研究中得到验证[51]。然而,关于双磷酸盐在CPT治疗中的确切效果,目前只有极少数观察性研究提到,而且这些研究缺乏必要的对照[14]。因此,尚无明确的证据证明它们在CPT治疗中的确切有效性。双磷酸盐治疗在儿童中是相对安全的,然而一些罕见但严重的不良反应(如低钙血症、低磷血症、非典型股骨骨折、颌骨坏死等)可能会发生,使用前需充分告知患儿及家属。双膦酸盐可被建议作为手术治疗的辅助手段,但最终针对CPT的治疗方法应该由专业骨科医师或小儿骨科专家根据患者具体情况来制定[52]。
四、CPT并发症处理问题18:CPT术后出现踝外翻的危险因素有哪些?
推荐意见18:术前伴有腓骨假关节的患者,踝关节外翻畸形发生的风险显著增加(强推荐,陈述同意率90%,证据等级:4级)。
证据概述:湖南省儿童医院开展的一项涉及319例CPT患儿手术治疗的研究发现,140例术后出现了踝关节外翻畸形;进一步研究发现,术前合并腓骨假关节显著增加了术后发展为踝关节外翻畸形的风险,尤其在CPT位于胫骨远端1/3位置、初次手术年龄 < 3岁、双下肢长度差异在1~2 cm以及合并NF1的患者,这一风险更为显著[53]。
问题19:何种程度的踝外翻需要积极干预?
推荐意见19:测量胫腓骨正位X线片中胫骨远端外侧角(lateral distal tibial angle, LDTA)或胫骨距骨角(tibiotalar angle, TTA),当LDTA > 94°或TTA > 4°时,需要积极干预踝外翻畸形。通过评估患儿骨龄,以确定潜在生长能力,可以选择采用内踝半骨骺阻滞或踝上截骨的治疗方法(强推荐,陈述同意率82.5%,证据等级:3级)。
证据概述:踝关节外翻可引起负重状态下地面反作用力向外侧偏移,这进一步导致了胫骨远端外侧骨骺逐渐发生楔形变,并引起腓骨对后足的挤压。临床上表现为跟骨向外侧移位,内踝突出,腓骨挤压后足跟骨而引发疼痛[54]。
踝外翻的影像学检查需要在负重状态下进行,以避免将后足外翻与踝外翻混淆。在负重位下拍摄的踝关节正位X线片可以用于测量LDTA或TTA,以评估踝外翻的情况。此时需要注意,正常情况下踝关节的生理性踝外翻一般不超过4°。当LDTA大于94°或TTA大于4°时,可认为踝外翻已经达到需要积极干预的程度。此时,佩戴支具通常无法有效治疗,而应结合评估患儿骨龄来确定其潜在生长能力,进而选择内踝半骨骺阻滞或踝上截骨等治疗方法[53-55]。
问题20:假关节骨性愈合后再骨折的危险因素有哪些?
推荐意见20:再骨折发生是一个较为随机的事件,胫骨假关节愈合区域的横截面积越大、胫骨机械轴线趋近正常、不伴发腓骨假关节以及具有良好佩戴支具依从性是避免发生CPT术后再骨折的保护性因素(强推荐,陈述同意率85%,证据等级:4级)。
证据概述:湖南省儿童医院对255例接受联合手术治疗的患儿进行回顾性分析,发现再骨折的发生率达到13.3%。然而,该研究并未发现与再骨折显著相关的任何因素。尽管有研究指出,年龄在首次手术时可能对假关节骨性愈合产生影响,年龄越小似乎越有利于术后骨性愈合,但这一趋势在统计分析中并未得到明确证实。此外,假关节在胫骨发生部位可能对再骨折风险有影响(特别是胫骨近端的CPT),但这一观点在统计学上亦未得到明确证实。因此,推测再骨折可能与随机外伤事件有关[56]。另一方面,胫骨假关节愈合区域的横截面积越大、胫骨机械轴线趋近正常、不伴发腓骨假关节以及具有良好的佩戴支具依从性,是避免发生CPT术后再骨折的保护性因素[57-58]。
问题21:胫骨延长过程如何评价截骨断端骨痂生长状态?
推荐意见21:建议通过X线检查截骨端骨痂形态和密度情况进行评价。其中骨痂形态包括:纺锤形、圆柱形、凹陷形(中间骨痂缩窄)、偏心型和中央细长型。骨痂密度情况包括稀疏低密型、均匀条纹型、异质型(密集斑点)、边缘型、断端周围型、均匀密度型、不规则密度型、低密齿状线型、骨痂均匀硬化型和骨痂不均匀硬化型(强推荐,陈述同意率87.5%,证据等级:4级)。
证据概述:Li等[59]对超过6 000张X线片进行分析,将牵张成骨新生骨痂进行了形状和类型的详细分类。形状方面包括纺锤型、圆柱型、凹陷型(中间骨痂缩窄)、偏心型和中央细长型。类型方面依据新生骨痂密度情况分为稀疏低密型、均匀条纹型、异质型和透亮型等十种。该分类系统在一致性和可重复性方面均达到一般水平以上。研究发现,稀疏低密型、边缘型、均匀密度型和骨痂均匀硬化型与良好的治疗结果相关,而异质型、断端周围型、不规则密度型和骨痂不均匀硬化型更可能导致不良治疗结果。同时,对于边缘型和不规则密度型骨痂,采取必要的干预手段可以避免不良结果的发生(图 1)。
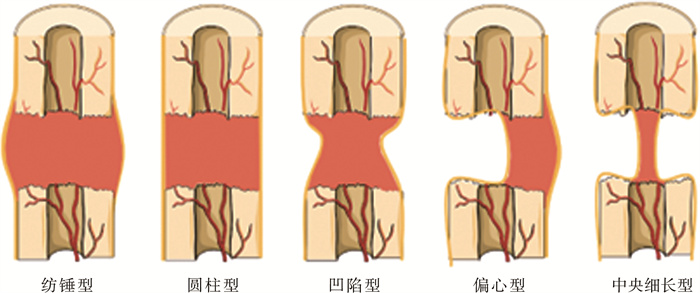
|
图 1 胫骨延长后断端骨痂愈合分型示意图 Fig.1 Diagram of bone healing types at the tibia lengthening site |
问题22:对存在生长潜力的CPT患儿出现踝外翻如何处理?
推荐意见22:对于存在生长潜力的CPT患儿出现踝外翻,可以采取半骺板阻滞术治疗,手术方式包括“U”形钉半骨骺阻滞、空心螺钉半骨骺阻滞和皮质骨螺钉半骨骺阻滞(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:Hu等[60]回顾性评估治疗CPT术后踝外翻的3种不同植入物的有效性。研究选择了41例术后存在踝外翻的CPT患者,其中23例采用“U”形钉半骨骺阻滞,10例采用空心螺钉治疗,8例采用皮质骨螺钉治疗。研究结果显示,“U”形钉半骨骺阻滞的矫正率为0.71度/月,空心螺钉组和皮质骨螺钉组的矫正率分别为0.64度/月和0.61度/月,三组矫正率差异无统计学意义(P > 0.05)。“U”形钉或螺钉暂时性半骨骺阻滞是治疗儿童CPT术后踝外翻畸形的有效方法。
问题23:CPT患儿出现胫骨近端外翻如何处理?
推荐意见23:如果胫骨近端缺乏生长潜力,推荐进行胫骨近端内翻截骨术。对于具有生长潜力的患者,可以考虑采用半骨骺阻滞术治疗,通常采用“8”字钢板半骨骺阻滞术作为手术方式(强推荐,陈述同意率92.5%,证据等级:3级)。
证据概述:Dai等[61]对135例青少年膝关节周围冠状面畸形患者进行回顾性研究,患者均采用“8”字钢板半骨骺阻滞术治疗,结果显示约94.06%的畸形得到了完全矫正。
问题24:CPT患者患侧胫骨行截骨术后是否能正常愈合?
推荐意见24:CPT患者可行患侧胫骨非假关节处截骨手术,并能够实现愈合(强推荐,陈述同意率90%,证据等级:3级)。
证据概述:Nahm等[62]回顾了10例CPT患者截骨手术后情况。其中,4例进行了截骨矫形,3例进行了截骨延长,另外3例进行了髓内固定调整。尽管仅1例在截骨处进行了植骨,但所有手术病例均实现了骨性愈合。需要注意的是,一些并发症(如骨筋膜室综合征、骨髓炎和截骨术后骨折)仍有可能发生。尽管在CPT患者中进行截骨手术是安全可行的,医务人员需密切监测并注意可能的并发症的发生。
五、共识制订过程与方法 (一) 共识的目标受众和适用范围该共识针对的是16岁以下儿童和青少年,他们的骨骼尚未完全闭合,胫腓骨尚具有生长潜力。对骨骼成熟患者不适用于本共识。适用该共识的人员包括我国二、三级医疗机构的专科医务人员,如骨科医师、小儿外科医师、康复科医师,以及相应专业护士,还包括基层卫生保健机构的医务人员。
(二) 临床问题解析与证据检索为了处理所涉及的临床问题,我们按照循证医学文献检索的标准格式(即PICO原则,包括人群、干预措施、对照、结局指标)对这些问题进行了详细分析。我们根据对这些问题的详细分析进行了证据检索,具体步骤如下:①数据库检索:我们在多个数据库进行了检索,包括但不限于Medline、Embase以及Cochrane Library。②研究类型筛选:我们首先优先筛选了过去5年内发表的系统评价、荟萃分析以及随机对照试验(randomized controlled trial,RCT)等高质量研究。当最新的高质量证据不足或者证据等级较低时,我们扩大了检索范围,包括了5年前发表的系统评价、荟萃分析等。这样确保了我们获取到最全面和最可信的临床证据。
(三) 证据评价及推荐意见形成这份共识包括24条临床问题和对应的陈述。最初由中华医学会小儿外科学分会小儿骨科学组发起。全国各地的儿童骨科学专家对所有临床问题及对应的陈述初稿进行了反复讨论和修订。根据牛津循证医学中心的证据级别分类(表 1),我们将这些声明的推荐级别分为“强烈推荐”和“有限推荐”(表 2)。在此基础上,我们采用了改进的Delphi方法,以匿名投票的形式对这些共识声明进行表决,表决的级别标准见表 3。如果某个声明的A级或B级投票比例(即陈述同意率)超过80%,则认为该声明已达成共识并获得通过。如果未能满足这一要求,放弃该声明。
| 表 1 基于牛津循证医学中心的证据水平 Table 1 Levels of evidence based on the Oxford Centre for Evidence-Based Medicine |
|
|
| 表 2 先天性胫骨假关节临床诊治共识意见中对于推荐等级的定义 Table 2 Definition of recommendation grades in the clinical diagnosis and treatment consensus for congenital pseudarthrosis of the tibia |
|
|
| 表 3 先天性胫骨假关节临床诊治共识意见中针对陈述的投票表决等级定义 Table 3 Definition of voting grades for statements in the clinical diagnosis and treatment consensus for congenital pseudarthrosis of the tibia |
|
|
编写专家组成员(按姓氏笔画排序):
刘尧喜 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)骨科
杨戈 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)骨科
胡雄科 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)骨科
专家组成员(按姓氏笔画排序):
丁晓飞 广西医科大学第一附属医院
王志刚 上海交通大学医学院附属上海儿童医学中心
王跃 浙江大学医学院附属第一医院
韦宜山 内蒙古医科大学第二附属医院
付桂兵 深圳市儿童医院
宁波 复旦大学附属儿科医院
朱光辉 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)
刘昆 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)
刘星 重庆医科大学附属儿童医院
许韧 厦门大学医学院
李连永 中国医科大学附属盛京医院
李卓扬 浙江大学医学院附属第一医院
杨征 北京积水潭医院
张学军 首都医科大学附属北京儿童医院
张中礼 天津医院
陈顺有 福州市第二总医院
邵景范 华中科技大学同济医学院附属同济医院
赵卫华 湖南省人民医院(湖南师范大学附属第一医院)
南国新 东莞市儿童医院
徐宏文 广州市妇女儿童医疗中心
郭东 首都医科大学附属北京儿童医院
唐欣 浙江大学医学院附属儿童医院
梅海波 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)
康晓鹏 昆明市儿童医院
蒋飞 大连市妇女儿童医疗中心
鲍琨 上海市第六人民医院
谭谦 湖南省儿童医院(中南大学湘雅医学院附属儿童医院)
执笔人:杨戈
利益冲突 所有作者声明不存在利益冲突
实践指南注册:国际实践指南注册与透明化平台,注册号(PREPARE-2024CN922)
Registration of Practice Guidelines:Practice Guideline Registration for Transparency(PREPARE—2024CN922)
| [1] |
Vander Have KL, Hensinger RN, Caird M, et al. Congenital pseudarthrosis of the tibia[J]. J Am Acad Orthop Surg, 2008, 16(4): 228-236. DOI:10.5435/00124635-200804000-00006 |
| [2] |
Deng HJ, Mei HB, Wang EB, et al. The association between fibular status and frontal plane tibial alignment post-union in congenital pseudarthrosis of the tibia[J]. J Child Orthop, 2021, 15(3): 261-269. DOI:10.1302/1863-2548.15.200255 |
| [3] |
Boyd HB. Pathology and natural history of congenital pseudarthrosis of the tibia[J]. Clin Orthop Relat Res, 1982, 166: 5-13. |
| [4] |
Andersen KS. Congenital pseudarthrosis of the tibia and neurofibromatosis[J]. Acta Orthop Scand, 1976, 47(1): 108-111. DOI:10.3109/17453677608998981 |
| [5] |
Pais C. Congenital pseudarthrosis of the tibia[J]. Rev Chir Orthop Reparatrice Appar Mot, 1953, 39(5/6): 701-707. |
| [6] |
Morrissy RT, Riseborough EJ, Hall JE. Congenital pseudarthrosis of the tibia[J]. J Bone Joint Surg Br, 1981, 63-B(3): 367-375. DOI:10.1302/0301-620X.63B3.6790551 |
| [7] |
Sofield HA. Congenital pseudarthrosis of the tibia[J]. Clin Orthop Relat Res, 1971, 76: 33-42. DOI:10.1097/00003086-197105000-00008 |
| [8] |
Khan T, Joseph B. Controversies in the management of congenital pseudarthrosis of the tibia and fibula[J]. Bone Joint J, 2013, 95-B(8): 1027-1034. DOI:10.1302/0301-620X.95B8.31434 |
| [9] |
Zhou YJ, Tan Q, Liu K, et al. Epidemiological and clinical characteristics of congenital pseudarthrosis of the tibia in China[J]. Front Pediatr, 2022, 10: 943917. DOI:10.3389/fped.2022.943917 |
| [10] |
Vitale MG, Guha A, Skaggs DL. Orthopaedic manifestations of neurofibromatosis in children: an update[J]. Clin Orthop Relat Res, 2002, 401: 107-118. DOI:10.1097/00003086-200208000-00013 |
| [11] |
简书浪, 梅海波. 儿童先天性胫骨假关节分型方法与治疗策略研究进展[J]. 中华小儿外科杂志, 2023, 44(3): 281-288. Jian SL, Mei HB. Advances of classifying and managing congenital pseudarthrosis of the tibia in children[J]. Chin J Pediatr Surg, 2023, 44(3): 281-288. DOI:10.3760/cma.j.cn421158-20211213-00607 |
| [12] |
Andersen KS. Radiological classification of congenital pseudarthrosis of the tibia[J]. Acta Orthop Scand, 1973, 44(6): 719-727. DOI:10.3109/17453677308989112 |
| [13] |
Crawford AH Jr, Bagamery N. Osseous manifestations of neurofibromatosis in childhood[J]. J Pediatr Orthop, 1986, 6(1): 72-88. DOI:10.1097/01241398-198601000-00015 |
| [14] |
Paley D. Congenital pseudarthrosis of the tibia: biological and biomechanical considerations to achieve union and prevent refracture[J]. J Child Orthop, 2019, 13(2): 120-133. DOI:10.1302/1863-2548.13.180147 |
| [15] |
刘尧喜, 梅海波, 刘昆, 等. 一种新的儿童先天性胫骨假关节的X线分型[J]. 中华小儿外科杂志, 2016, 37(1): 29-33. Liu YX, Mei HB, Liu K, et al. A new radiographic classification scheme of congenital pseudarthrosis of the tibia[J]. Chin J Pediatr Surg, 2016, 37(1): 29-33. DOI:10.3760/cma.j.issn.0253-3006.2016.01.007 |
| [16] |
Williams VC, Lucas J, Babcock MA, et al. Neurofibromatosis type 1 revisited[J]. Pediatrics, 2009, 123(1): 124-133. DOI:10.1542/peds.2007-3204 |
| [17] |
El-Rosasy MAM. Congenital pseudarthrosis of the tibia: the outcome of a pathology-oriented classification system and treatment protocol[J]. J Pediatr Orthop B, 2020, 29(4): 337-347. DOI:10.1097/BPB.0000000000000660 |
| [18] |
Zhu GH, Zheng Y, Liu YX, et al. Identification and characterization of NF1 and non-NF1 congenital pseudarthrosis of the tibia based on germline NF1 variants: genetic and clinical analysis of 75 patients[J]. Orphanet J Rare Dis, 2019, 14(1): 221. DOI:10.1186/s13023-019-1196-0 |
| [19] |
Zheng Y, Zhu GH, Liu YX, et al. Case series of congenital pseudarthrosis of the tibia unfulfilling neurofibromatosis type 1 diagnosis: 21% with somatic NF1 haploinsufficiency in the periosteum[J]. Hum Genet, 2022, 141(8): 1371-1383. DOI:10.1007/s00439-021-02429-2 |
| [20] |
Agrawal U, Tiwari V. Congenital tibial pseudarthrosis[M]. Treasure Island (FL): StatPearls Publishing, 2023.
|
| [21] |
刘尧喜, 陈琰, 郑宇, 等. 儿童先天性胫骨假关节病变骨膜组织的蛋白质组学研究[J]. 中华骨科杂志, 2021, 41(2): 92-102. Liu YX, Chen Y, Zheng Y, et al. Proteomics investigation on periosteum of children with tibia congenital pseudarthrosis[J]. Chin J Orthop, 2021, 41(2): 92-102. DOI:10.3760/cma.j.cn121113-20200920-00570 |
| [22] |
Ippolito E, Corsi A, Grill F, et al. Pathology of bone lesions associated with congenital pseudarthrosis of the leg[J]. J Pediatr Orthop B, 2000, 9(1): 3-10. DOI:10.1097/01202412-200001000-00002 |
| [23] |
Mariaud-Schmidt RP, Rosales-Quintana S, Bitar E, et al. Hamartoma involving the pseudarthrosis site in patients with neurofibromatosis type 1[J]. Pediatr Dev Pathol, 2005, 8(2): 190-196. DOI:10.1007/s10024-004-1004-1 |
| [24] |
Kuorilehto T, Kinnunen P, Nissinen M, et al. Vasculopathy in two cases of NF1-related congenital pseudarthrosis[J]. Pathol Res Pract, 2006, 202(9): 687-690. DOI:10.1016/j.prp.2006.03.006 |
| [25] |
Cho TJ, Seo JB, Lee HR, et al. Biologic characteristics of fibrous hamartoma from congenital pseudarthrosis of the tibia associated with neurofibromatosis type 1[J]. J Bone Joint Surg Am, 2008, 90(12): 2735-2744. DOI:10.2106/JBJS.H.00014 |
| [26] |
Li ZY, Liu YX, Huang YY, et al. Circ_0000888 regulates osteogenic differentiation of periosteal mesenchymal stem cells in congenital pseudarthrosis of the tibia[J]. iScience, 2023, 26(10): 107923. DOI:10.1016/j.isci.2023.107923 |
| [27] |
刘尧喜, 刘昆, 伍江雁, 等. 克氏针髓内固定治疗一岁以内先天性胫骨假关节的临床研究[J]. 中华小儿外科杂志, 2019, 40(10): 930-934. Liu YX, Liu K, Wu JY, et al. Preliminary outcomes of intramedullary fixation of Kirschner's wire for congenital pseudarthrosis of tibia in children aged under 1 year[J]. Chin J Pediatr Surg, 2019, 40(10): 930-934. DOI:10.3760/cma.j.issn.0253-3006.2019.10.013 |
| [28] |
Liu YX, Mei HB, Zhu GH, et al. Congenital pseudarthrosis of the tibia in children: should we defer surgery until 3 years old?[J]. J Pediatr Orthop B, 2018, 27(1): 17-25. DOI:10.1097/BPB.0000000000000468 |
| [29] |
梅海波, 赫荣国, 刘昆, 等. 联合手术技术治疗儿童先天性胫骨假关节[J]. 中华小儿外科杂志, 2012, 33(6): 421-425. Mei HB, He RG, Liu K, et al. Intramedullary rod combined with ring external fixation for treatment of congenital pseudarthrosis of tibia in children[J]. Chin J Pediatr Surg, 2012, 33(6): 421-425. DOI:10.3760/cma.j.issn.0253-3006.2012.06.005 |
| [30] |
伍江雁, 梅海波, 刘尧喜, 等. 三合一骨融合术在儿童先天性胫骨假关节联合手术中的应用[J]. 中华小儿外科杂志, 2017, 38(9): 691-697. Wu JY, Mei HB, Liu YX, et al. Application of 3-in-1 osteosynthesis in combined surgical technique for congenital pseudarthrosis of the tibia in children[J]. Chin J Pediatr Surg, 2017, 38(9): 691-697. DOI:10.3760/cma.j.issn.0253-3006.2017.09.010 |
| [31] |
Liu YX, Yang G, Liu K, et al. Combined surgery with 3-in-1 osteosynthesis in congenital pseudarthrosis of the tibia with intact fibula[J]. Orphanet J Rare Dis, 2020, 15(1): 62. DOI:10.1186/s13023-020-1330-z |
| [32] |
刘尧喜, 梅海波, 刘昆, 等. 四合-骨融合术在儿童先天性胫骨假关节联合手术中的应用[J]. 中华骨科杂志, 2016, 36(12): 770-777. Liu YX, Mei HB, Liu K, et al. Application of "4-in-1 osteosynthesis" in the combined surgical technique for the treatment of congenital pseudarthrosisof tibia in children[J]. Chin J Orthop, 2016, 36(12): 770-777. DOI:10.3760/cma.j.issn.0253-2352.2016.12.003 |
| [33] |
Choi IH, Lee SJ, Moon HJ, et al. "4-in-1 osteosynthesis" for atrophic-type congenital pseudarthrosis of the tibia[J]. J Pediatr Orthop, 2011, 31(6): 697-704. DOI:10.1097/BPO.0b013e318221ebce |
| [34] |
刘尧喜, 张学军, 郭跃明, 等. 儿童先天性胫骨假关节行不同术式疗效的多中心临床研究[J]. 中华小儿外科杂志, 2020, 41(10): 933-937. Liu YX, Zhang XJ, Guo YM, et al. A multicenter clinical trial on the efficacy of different surgical procedures for congenital pseudarthrosis of tibia in children[J]. Chin J Pediatr Surg, 2020, 41(10): 933-937. DOI:10.3760/cma.j.cn421158-20200520-00355 |
| [35] |
刘尧喜, 杨戈, 胡雄科, 等. 联合手术治疗儿童先天性胫骨假关节的长期随访评价[J]. 中华外科杂志, 2023, 61(8): 675-680. Liu YX, Yang G, Hu XK, et al. Long term follow-up evaluation of combined surgery for congenital tibial pseudarthrosis in children[J]. Chin J Surg, 2023, 61(8): 675-680. DOI:10.3760/cma.j.cn112139-20230205-00051 |
| [36] |
简书浪, 毛庆庆, 许思宇, 等. 先天性胫骨前外侧弯曲畸形并发胫骨骨折的危险因素分析[J]. 中华骨科杂志, 2023, 43(17): 1164-1173. Jian SL, Mao QQ, Xu SY, et al. Risk factors analysis for tibial fracture in patients with congenital anterolateral bowing of the tibia[J]. Chin J Orthop, 2023, 43(17): 1164-1173. DOI:10.3760/cma.j.cn121113-20230419-00246 |
| [37] |
Laine JC, Novotny SA, Weber EW, et al. Distal tibial guided growth for anterolateral bowing of the tibia: fracture may be prevented[J]. J Bone Joint Surg Am, 2020, 102(23): 2077-2086. DOI:10.2106/JBJS.20.00657 |
| [38] |
Grill F, Bollini G, Dungl P, et al. Treatment approaches for congenital pseudarthrosis of tibia: results of the EPOS multicenter study.European Paediatric Orthopaedic Society (EPOS)[J]. J Pediatr Orthop B, 2000, 9(2): 75-89. DOI:10.1097/01202412-200004000-00002 |
| [39] |
Whelan DB, Bhandari M, Stephen D, et al. Development of the radiographic union score for tibial fractures for the assessment of tibial fracture healing after intramedullary fixation[J]. J Trauma, 2010, 68(3): 629-632. DOI:10.1097/TA.0b013e3181a7c16d |
| [40] |
Richards BS, Wilkes D, Dempsey M, et al. A radiographic scoring system to assess healing in congenital pseudarthrosis of the tibia[J]. J Pediatr Orthop B, 2015, 24(2): 118-122. DOI:10.1097/BPB.0000000000000141 |
| [41] |
Uchida Y, Kojima T, Sugioka Y. Vascularised fibular graft for congenital pseudarthrosis of the tibia.Long-term results[J]. J Bone Joint Surg Br, 1991, 73(5): 846-850. DOI:10.1302/0301-620X.73B5.1894680 |
| [42] |
Richards BS, Anderson TD. rhBMP-2 and intramedullary fixation in congenital pseudarthrosis of the tibia[J]. J Pediatr Orthop, 2018, 38(4): 230-238. DOI:10.1097/BPO.0000000000000789 |
| [43] |
Kesireddy N, Kheireldin RK, Lu A, et al. Current treatment of congenital pseudarthrosis of the tibia: a systematic review and meta-analysis[J]. J Pediatr Orthop B, 2018, 27(6): 541-550. DOI:10.1097/BPB.0000000000000524 |
| [44] |
Shah H, Rousset M, Canavese F. Congenital pseudarthrosis of the tibia: management and complications[J]. Indian J Orthop, 2012, 46(6): 616-626. DOI:10.4103/0019-5413.104184 |
| [45] |
Eisenberg KA, Vuillermin CB. Management of congenital pseudoarthrosis of the tibia and fibula[J]. Curr Rev Musculoskelet Med, 2019, 12(3): 356-368. DOI:10.1007/s12178-019-09566-2 |
| [46] |
Paley D. Congenital pseudarthrosis of the tibia: combined pharmacologic and surgical treatment using biphosphonate intravenous infusion and bone morphogenic protein with periosteal and cancellous autogenous bone grafting, tibio-fibular cross union, intramedullary[M]//Zorzi AR, De Miranda JB. Bone Grafting. London: IntechOpen, 2012, 91-106. DOI: 10.5772/31149.
|
| [47] |
Crawford AH. Neurofibromatosis in children[J]. Acta Orthop Scand, 1986, 57(218): 8-60. DOI:10.3109/17453678609156819 |
| [48] |
Paley D, Catagni M, Argnani F, et al. Treatment of congenital pseudoarthrosis of the tibia using the Ilizarov technique[J]. Clin Orthop Relat Res, 1992, 280: 81-93. |
| [49] |
Horn J, Steen H, Terjesen T. Epidemiology and treatment outcome of congenital pseudarthrosis of the tibia[J]. J Child Orthop, 2013, 7(2): 157-166. DOI:10.1007/s11832-012-0477-0 |
| [50] |
Mathieu L, Vialle R, Thevenin-Lemoine C, et al. Association of Ilizarov's technique and intramedullary rodding in the treatment of congenital pseudarthrosis of the tibia[J]. J Child Orthop, 2008, 2(6): 449-455. DOI:10.1007/s11832-008-0139-4 |
| [51] |
Rauch F, Travers R, Plotkin H, et al. The effects of intravenous pamidronate on the bone tissue of children and adolescents with osteogenesis imperfecta[J]. J Clin Invest, 2002, 110(9): 1293-1299. DOI:10.1172/JCI15952 |
| [52] |
Siebert MJ, Makarewich CA. Anterolateral tibial bowing and congenital pseudoarthrosis of the tibia: current concept review and future directions[J]. Curr Rev Musculoskelet Med, 2022, 15(6): 438-446. DOI:10.1007/s12178-022-09779-y |
| [53] |
Yu H, Li ZY, Tan Q, et al. Association between preoperative concurrent fibular pseudarthrosis and risk of postoperative ankle valgus in patients with congenital pseudarthrosis of the tibia[J]. BMJ Paediatr Open, 2023, 7(1): e001763. DOI:10.1136/bmjpo-2022-001763 |
| [54] |
Stevens PM, Kennedy JM, Hung M. Guided growth for ankle valgus[J]. J Pediatr Orthop, 2011, 31(8): 878-883. DOI:10.1097/BPO.0b013e318236b1df |
| [55] |
Paley D. Principles of deformity correction[M]. Berlin: Springer, 2002.
|
| [56] |
Li ZY, Yu H, Huang YY, et al. Analysis of risk factors affecting union and refracture after combined surgery for congenital pseudarthrosis of the tibia: a retrospective study of 255 cases[J]. Orphanet J Rare Dis, 2022, 17(1): 245. DOI:10.1186/s13023-022-02375-w |
| [57] |
Cho TJ, Choi IH, Lee SM, et al. Refracture after Ilizarov osteosynthesis in atrophic-type congenital pseudarthrosis of the tibia[J]. J Bone Joint Surg Br, 2008, 90(4): 488-493. DOI:10.1302/0301-620X.90B4.20153 |
| [58] |
刘尧喜, 梅海波, 刘昆, 等. 儿童先天性胫骨假关节愈合后的X线分型与术后再骨折的相关性研究[J]. 中华外科杂志, 2016, 54(6): 456-460. Liu YX, Mei HB, Liu K, et al. Correlative study between X-ray type after healing of congenital pseudarthrosis of the tibia in children and postoperative refracture[J]. Chin J Surg, 2016, 54(6): 456-460. DOI:10.3760/cma.j.issn.0529-5815.2016.06.013 |
| [59] |
Li R, Saleh M, Yang L, et al. Radiographic classification of osteogenesis during bone distraction[J]. J Orthop Res, 2006, 24(3): 339-347. DOI:10.1002/jor.20026 |
| [60] |
Hu XK, Li AP, Liu K, et al. Efficacy comparison of 3 kinds of distal tibial hemiepiphyseal implants in the treatment of postoperative ankle valgus of congenital pseudarthrosis of the tibia[J]. J Pediatr Orthop, 2022, 42(5): e441-e447. DOI:10.1097/BPO.0000000000002101 |
| [61] |
Dai ZZ, Liang ZP, Li H, et al. Temporary hemiepiphysiodesis using an eight-plate implant for coronal angular deformity around the knee in children aged less than 10 years: efficacy, complications, occurrence of rebound and risk factors[J]. BMC Musculoskelet Disord, 2021, 22(1): 53. DOI:10.1186/s12891-020-03915-w |
| [62] |
Nahm NJ, Makarewich CA, Rosenwasser KA, et al. Does an osteotomy performed in congenital pseudarthrosis of the tibia heal?[J]. J Pediatr Orthop, 2022, 42(6): e630-e635. DOI:10.1097/BPO.0000000000002148 |
 2024, Vol. 23
2024, Vol. 23
