2. 国家儿童健康与疾病临床医学研究中心儿童癌症研究中心, 杭州 310052;
3. 遵义医科大学附属医院小儿外科, 遵义 563000
2. Pediatric Cancer Research Center, National Clinical Research Center for Child Health, Hangzhou 310052, China;
3. Department of Pediatric Surgery, Affiliated Hospital of Zunyi Medical University, Zunyi 563000, China
横纹肌肉瘤(rhabdomyosarcoma, RMS)是儿童和青少年最常见的软组织肉瘤,可发生于全身各个区域,其中头颈部及泌尿生殖系统是最为常见的发病部位。本文报告1例胚胎性横纹肌肉瘤(embryonal RMS, ERMS)伴额顶叶转移患儿的诊治过程,并对其转录组测序数据进行分析,以期为RMS的诊治提供参考。本研究经浙江大学医学院附属儿童医院伦理委员会审批通过(2020-IRB-049-A1)。
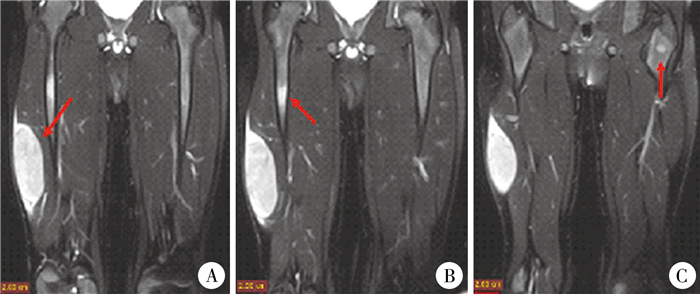
患儿,男,4岁4个月,因发现右下肢肿物1月余入院。体格检查:右大腿触及一质硬肿物,边界清,移动度差,无压痛,透光实验阴性。双下肢增强MR:右下肢股外侧肌内见一梭形肿块影,大小约62 mm×27 mm,边界尚清,呈长T2信号,内见条状短T2信号影,增强后肿块明显不均匀强化,右股骨上段及左股骨相隆间见结节状长T2信号,增强后可见强化,考虑右大腿股外侧肌内恶性肿瘤占位,伴右股骨上段及左股骨粗隆间骨转移可能(图 1)。
|
图 1 胚胎性横纹肌肉瘤患儿化疗前原发病灶及下肢转移病灶的MR图 Fig.1 MR schematic diagram of primary lesions and lower limb metastases of ERMS before chemotherapy 注 A.化疗前双下肢MR,右下肢股外侧肌内见一梭形肿块影,呈长T2信号;B.右侧股骨上段见结节状长T2信号;C.左股骨粗隆间见结节状长T2信号。 |
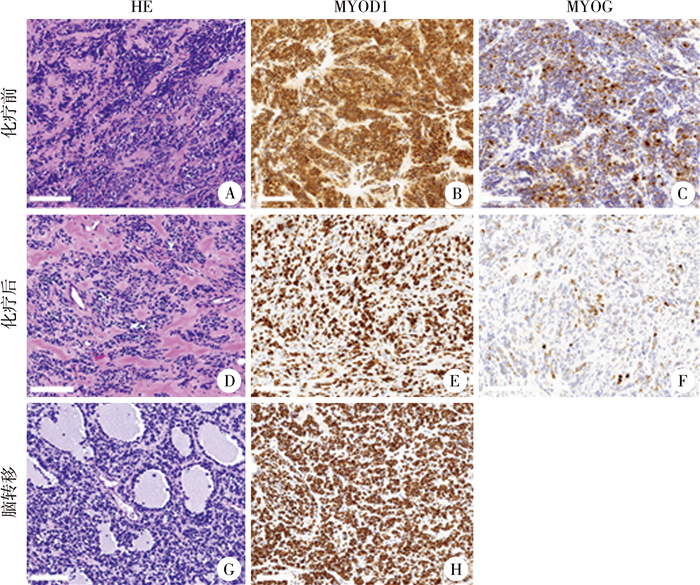
全身麻醉下行右侧大腿肿物切取活检。形态学特征:弥漫生长的小圆蓝肿瘤细胞浸润性生长,弥漫性分布,腺泡状结构不明显(图 2A)。免疫表型:Myogenin(部分+)、MyoD1(+)、Ki-67(90%+)、Desmin(部分核周点状+)、INI1(+)、WT1(+)、CD56(+)(图 2B、图 2C)。荧光原位杂交检测:使用PAX3、FKHR、ALK和EWSR1基因断裂探针,均未发现上述基因断裂。综合形态学特征和基因检测结果,考虑为胚胎性横纹肌肉瘤。
|
图 2 胚胎性横纹肌肉瘤伴额顶叶转移患儿化疗前、后及脑转移术后的组织化学染色(HE染色,×200,比例尺:100 μm) Fig.2 Histochemical staining diagrams of ERMS patients with frontal-parietal lobe metastases before and after chemotherapy and post-brain metastasis surgery (HE, ×200, scale: 100 μm) 注 A-C: 分别为化疗前组织的病理染色及MYOD1和MYOG免疫组化图像; D-F: 分别为化疗后组织的病理染色及MYOD1和MYOG免疫组化图像; G-H: 分别为脑转移组织的病理染色及MYOD1免疫组化图像 |
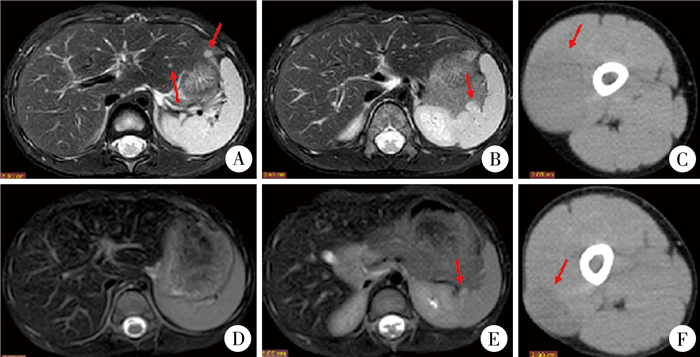
正电子发射计算机断层显像:①右侧股外侧肌内软组织肿块,FDG代谢弥漫性增高,考虑恶性肿瘤;②右侧股骨上端骨髓腔内局灶性FDG代谢增高,左侧耻骨、骶骨及胸骨骨折破坏伴FDG代谢增高,考虑转移。腹部MR:肝内可见多发大小不等结节样长T2信号影,较大者长径约5.8 mm,脾门区结节,考虑转移灶(图 3A、3B)。活检术后予“长春地辛+放线菌素D+环磷酰胺”方案化疗3次,复查腹部MR示肝内多发结节已不明显,脾门区结节较前明显缩小(图 3C、3D)。CT示右下肢病灶明显缩小(图 3E、3F)。
|
图 3 胚胎性横纹肌肉瘤患儿原发病灶及腹腔转移病灶化疗前、后影像对比图 Fig.3 Comparison of imaging before and after chemotherapy in ERMS patients showing primary lesions and abdominal metastases 注 A:化疗前腹部增强MR,肝内可见多发大小不等结节样T2信号影;B:化疗前腹部增强MR,脾门区见结节状长T2信号影;C:化疗后腹部增强MR,肝脏多发结节已不明显;D:化疗后腹部增强MR,脾门区结节较化疗前明显缩小;E:化疗前右下肢原发病灶CT,见一梭形低密度影;F:化疗后右下肢原发病灶CT,低密度影明显缩小 |
第一阶段疗程结束后在全身麻醉下行“软组织病灶切除术+筋膜组织瓣成形术”。形态学特征:肌间胶原纤维增生,其间多量小圆蓝肿瘤细胞片状分布,肿瘤细胞呈圆形或短梭形,弥漫成片分布,腺泡状结构不明显(图 2D)。肿块周围边缘及送检下切缘未见肿瘤组织。免疫表型:INI1(+)、BRG1(+)、CD56(+)、CD54(散在+)、MyoD1(+)、CD99(浆+)、Myogenin(+)、Ki-67(60%+)、Desmin(+)(图 2E、2F)。术后继续规律复查,根据影像学结果和肿瘤标志物检测评估化疗效果,再结合副作用和个体差异调整化疗方案和剂量。
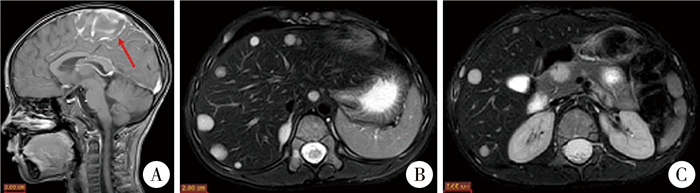
原发病灶切除术后11月余,患儿突发抽搐,MR头颅增强,提示左额顶叶转移(图 4A)。次日在全身麻醉下行神经导航辅助下显微镜下额顶叶病变切除术。形态学特征: 肿瘤细胞呈圆形或短梭形,弥漫成片分布,区域呈腺泡状结构,核分裂象多见(图 2G)。免疫组化:MyoD1(+),Ki-67(约80%+),Desmin(+)(图 2H)。病理诊断:脑转移性横纹肌肉瘤,肿瘤区域呈腺泡状结构,不排除腺泡状横纹肌肉瘤(alveolar RMS, ARMS)。患儿术后继续化疗,并对胸骨转移灶进行放疗,总剂量为20 Gy,分4次完成。脑转移病灶切除术后5月余,胆道系统增强MR示:肝内见多发大小不等结节状长T2信号影;胰腺内见多发结节状长T2信号影;脾门区及右侧肾上腺区见类圆形长T2信号影;多发肋骨、椎体及附件、双侧髂骨见多发斑块状长T2信号影; 考虑多发转移(图 4B、4C)。后患儿出现急性肠炎和消化道出血,经积极治疗后未见好转;脑转移病灶切除术后7个月死亡。
|
图 4 胚胎性横纹肌肉瘤患儿复发病灶及额顶叶转移病灶MR图 Fig.4 MR schematic diagrams showing recurrent lesions and frontal-parietal lobe metastases in ERMS patients 注 A: 左侧额顶叶见团块状肿块影;B: 肝内见多发大小不等结节状长T2信号影;C: 胰腺内见多发结节状长T2信号影 |
为明确该肿瘤基因变异情况,我们对化疗前后右下肢原发病灶以及脑转移病灶进行转录组测序。首先应用STAR软件进行比对,计算每个基因的表达量,过滤掉非蛋白质编码基因最终得到18 117个基因,并应用R 4.2.2进行热图绘制(图 5A)。既往文献报道与RMS密切相关的致病基因(如MYOD1、SOX8、PABPC1、SMARCA4、ARID1A、TP53等基因)在测序结果中都表现出“化疗前表达量较高,化疗后表达量降低,而脑转移后表达量又升高甚至高于化疗前”的现象,这也证实了本研究数据来源和分析的可靠性[1-2]。使用CTAT-mutations进行突变检测,并进行韦恩图绘制,发现ARID1B、FOXD4L3、TACC2、GOLGA8B和RIMBP3五个突变基因均在化疗前样本中存在,化疗后消失,而脑转移后再次出现(图 5B)。应用STAR-Fusion检测基因组中不同的基因融合事件得到融合基因数据,并进行韦恩图绘制,发现PMS2P9-CCDC146、RP11-342L8.3-SH3BGRL2和PTGFRN-RBFOX1三个融合基因均在化疗前样本中存在,化疗后消失,而脑转移后再次出现(图 5C)。
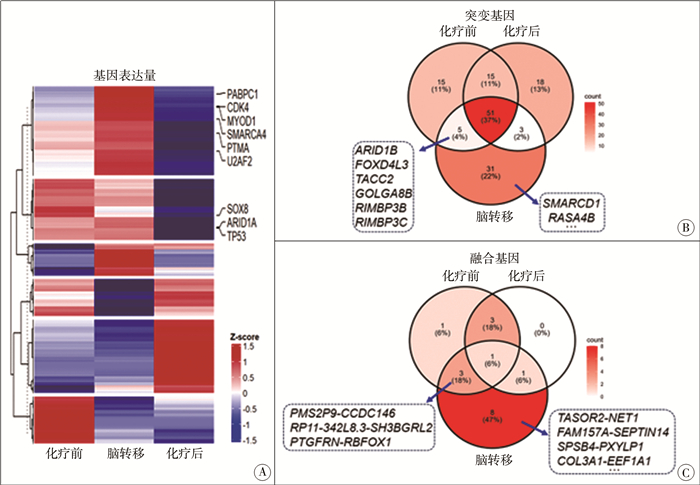
|
图 5 胚胎性横纹肌肉瘤伴额顶叶转移患儿转录组测序结果图 Fig.5 Schematic diagram of transcriptome sequencing results in ERMS patients with frontal-parietal lobe metastases 注 A: 化疗前后原发病灶及脑转移病灶的基因表达量热图;B: 化疗前后原发病灶及脑转移病灶三者之间突变基因的韦恩图;C: 化疗前后原发病灶及脑转移病灶三者之间融合基因的韦恩图 |
讨论 RMS是一种起源于原始间叶细胞的罕见恶性肿瘤,有学者首次将RMS基于临床和病理特征分为四种不同的形态变体:葡萄状、胚胎性、腺泡和多形性[3]。随着基因融合的发现和分子辅助检测技术在RMS中的广泛应用,世界卫生组织于2020年进一步完善了其分类方式,保留了2013年世界卫生组织提出的分类:ERMS、ARMS、梭形细胞/硬化性横纹肌肉瘤(spindle cell/sclerosing RMS, sRMS/scRMS)和多形性横纹肌肉瘤(pleomorphic RMS, PRMS)[4]。相比于2013年世界卫生组织RMS分类,其最大的变动是依据sRMS/scRMS分子遗传学的不同,额外提出了3种新的亚型[5]。第1种是先天性/婴儿型sRMS/scRMS伴VGLL2/NCOA2/CITED2重排,形成了SRF-NCOA2、TEAD1-NCOA2、VGLL2-NCOA2、VGLL2-CITED2等融合基因,该亚型通常缺乏转移潜力,预后相对较好[6]。第2种是MYOD1突变sRMS/scRMS,常见于年龄较大的儿童,容易出现早期远处转移及高度侵袭性病程[6]。第3种是骨内RMS(伴TFCP2/NCOA2重排),形成了EWSR/FUS-TFCP2融合基因以及罕见的MEIS1-NCOA2基因融合,好发于骨骼,具有极强的侵袭性,经常发生转移性疾病,通常预后不佳[7]。
在RMS中,ARMS预后最差,而ERMS最为常见,约占所有RMS的60% ~70%,其中5岁以下儿童是好发人群,男性比女性更常见,比例大概为1.4 ∶ 1[8-9]。在本例报告中,我们在病理组织学的基础上对病灶进行转录组测序,虽然没有检测到ARMS特有的PAX3/7-FOXO1融合基因,但发现了一些可能与RMS发生和转移相关的突变基因以及融合基因,其中包括已知与恶性肿瘤预后不良密切相关的ARID1B和SMARCD基因突变,它们编码的蛋白质均属于SWI/SNF蛋白质家族的成员[10-11]。我们还检测到了FAM157A-SEPTIN14融合基因,其中SEPTIN14基因已被证明形成肺腺癌EGFR-SEPTIN14融合基因和急性髓系白血病中的KMT2A-SEPTIN14融合基因[12-14]。这些突变基因和融合基因有可能为RMS的早期诊断及靶向治疗提供强有力的靶标。
从组织学上来看,ERMS显示出原始的椭圆形至梭形细胞,胞质很少。背景可以是松散的黏液样物质,细胞紧密排列成片状。一些区域显示出小的蓝色圆形细胞,随着这些细胞的分化,它们逐渐获得更多的胞质嗜酸性,形状变得更长,并被认为是横纹肌母细胞分化的证据[3]。ARMS则表现出高度细胞增生,由具有圆形核的原始细胞组成,伴有纤维血管隔膜将肿瘤细胞分隔成离散的团块。这些团块包含中央细胞团,周围细胞失去了凝聚力,呈现出“腺泡状”外观[3]。但是临床上已基于PAX-FOXO1的融合基因状态来管理ARMS和ERMS的诊疗。越来越多的分子遗传学证据也表明,RMS的诊断与预后不应仅依靠于组织学特征,而应该基于分子检测[15]。本例中,虽然从组织学和起源于四肢且进展迅速的临床特征上来看更符合ARMS,但从分子遗传学角度来看应诊断为ERMS。
虽然ERMS的预后远优于ARMS,但是转移性ERMS的预后较差,3年总生存率和无进展生存率分别约为42.3%和35.3%,出现脑转移者预后则更差[16]。迄今为止,较多报道RMS脑转移患者由头颈部转移而来,也有少数发生脑实质转移的ARMS病例报道[17]。本病例是极其罕见的原发于下肢,初始无神经系统症状,也无脑部结构异常,而后发生脑实质转移的ERMS病例。
由于ERMS发生脑转移的现象极少,因此临床医师很少定期进行颅部影像学检查。虽然脑转移患者会出现头痛、恶心、呕吐、视力障碍、言语困难和癫痫等症状,但这些症状特异性均相对较低,待神经或中枢系统相关症状明显时再进行检查往往为时已晚。本例尽管联合了手术、化疗和放疗,但该患儿在出现神经系统症状后7个月死亡,虽然较De等[18]统计的软脑膜或实质脑复发后的中位生存期(5个月)长,但这也提示,对那些初始就发生多发或远处转移,或转移病灶复发且进展迅速的RMS患者,定期进行头颅部影像学检查是十分必要的。对于已发生脑转移的RMS患儿,及时诊断和治疗仍然至关重要。但也有必要对术后肿瘤病灶进行高通量测序,为RMS发生及转移机制的研究提供参考。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 王金湖、陶挺、刘远梅负责研究的设计;刘双爱、胡宇翔、何子奇、闫胡晋进行病例数据收集与分析;刘双爱负责文献检索及结果撰写和讨论分析;陶挺负责把控数据分析及审阅文章知识性内容;刘远梅、王金湖对文章知识性内容进行审阅
| [1] |
Shern JF, Chen L, Chmielecki J, et al. Comprehensive genomic analysis of rhabdomyosarcoma reveals a landscape of alterations affecting a common genetic axis in fusion-positive and fusion-negative tumors[J]. Cancer Discov, 2014, 4(2): 216-231. DOI:10.1158/2159-8290.CD-13-0639 |
| [2] |
Shern JF, Selfe J, Izquierdo E, et al. Genomic classification and clinical outcome in rhabdomyosarcoma: a report from an international consortium[J]. J Clin Oncol, 2021, 39(26): 2859-2871. DOI:10.1200/JCO.20.03060 |
| [3] |
Agaram NP. Evolving classification of rhabdomyosarcoma[J]. Histopathology, 2022, 80(1): 98-108. DOI:10.1111/his.14449 |
| [4] |
Anderson WJ, Doyle LA. Updates from the 2020 World Health Organization classification of soft tissue and bone tumours[J]. Histopathology, 2021, 78(5): 644-657. DOI:10.1111/his.14265 |
| [5] |
Leiner J, Le Loarer F. The current landscape of rhabdomyosarcomas: an update[J]. Virchows Arch, 2020, 476(1): 97-108. DOI:10.1007/s00428-019-02676-9 |
| [6] |
Alaggio R, Zhang L, Sung YS, et al. A molecular study of pediatric spindle and sclerosing rhabdomyosarcoma: identification of novel and recurrent VGLL2-related fusions in infantile cases[J]. Am J Surg Pathol, 2016, 40(2): 224-235. DOI:10.1097/PAS.0000000000000538 |
| [7] |
Agaram NP, Zhang L, Sung YS, et al. Expanding the spectrum of intraosseous rhabdomyosarcoma: correlation between 2 distinct gene fusions and phenotype[J]. Am J Surg Pathol, 2019, 43(5): 695-702. DOI:10.1097/PAS.0000000000001227 |
| [8] |
Perez EA, Kassira N, Cheung MC, et al. Rhabdomyosarcoma in children: a SEER population based study[J]. J Surg Res, 2011, 170(2): e243-e251. DOI:10.1016/j.jss.2011.03.001 |
| [9] |
Sbaraglia M, Bellan E, Dei Tos AP. The 2020 WHO classification of soft tissue tumours: news and perspectives[J]. Pathologica, 2021, 113(2): 70-84. DOI:10.32074/1591-951X-213 |
| [10] |
Zhang Y, Chen MY, Huang DS, et al. Correlation between ARID1B gene mutation (p.A460, p.V215G) and prognosis of high-risk refractory neuroblastoma[J]. Cell Biol Int, 2023, 47(7): 1222-1228. DOI:10.1002/cbin.12013 |
| [11] |
Tessier-Cloutier B, Kommoss FKF, Kolin DL, et al. Dedifferentiated and undifferentiated ovarian carcinoma: an aggressive and molecularly distinct ovarian tumor characterized by frequent SWI/SNF complex inactivation[J]. Mod Pathol, 2024, 37(1): 100374. DOI:10.1016/j.modpat.2023.100374 |
| [12] |
Song JL, Xu RY, Zhang H, et al. Cell-in-cell-mediated entosis reveals a progressive mechanism in pancreatic cancer[J]. Gastroenterology, 2023, 165(6): 1505-1521. e20. DOI:10.1053/j.gastro.2023.08.035 |
| [13] |
Zhu YC, Wang WX, Li XL, et al. Identification of a novel icotinib-sensitive EGFR-SEPTIN14 fusion variant in lung adenocarcinoma by next-generation sequencing[J]. J Thorac Oncol, 2019, 14(8): e181-e183. DOI:10.1016/j.jtho.2019.03.031 |
| [14] |
Nguyen D, Haley L, Pallavajjala A, et al. Identification of a novel KMT2A-SEPT14 fusion in acute myeloid leukemia[J]. Leuk Lymphoma, 2018, 59(1): 265-267. DOI:10.1080/10428194.2017.1324163 |
| [15] |
Missiaglia E, Williamson D, Chisholm J, et al. PAX3/FOXO1 fusion gene status is the key prognostic molecular marker in rhabdomyosarcoma and significantly improves current risk stratification[J]. J Clin Oncol, 2012, 30(14): 1670-1677. DOI:10.1200/JCO.2011.38.5591 |
| [16] |
Bisogno G, Ferrari A, Prete A, et al. Sequential high-dose chemotherapy for children with metastatic rhabdomyosarcoma[J]. Eur J Cancer, 2009, 45(17): 3035-3041. DOI:10.1016/j.ejca.2009.08.019 |
| [17] |
Rodriguez-Beato F, De Jesus O, Sanchez-Ortiz J, et al. Alveolar rhabdomyosarcoma metastatic to the brain[J]. BMJ Case Rep, 2021, 14(3): e240516. DOI:10.1136/bcr-2020-240516 |
| [18] |
De B, Kinnaman MD, Wexler LH, et al. Central nervous system relapse of rhabdomyosarcoma[J]. Pediatr Blood Cancer, 2018, 65(1): 26710. DOI:10.1002/pbc.26710 |
 2024, Vol. 23
2024, Vol. 23


