血管周上皮样细胞瘤(perivascular epithelioid cell tumor, PEComa)是一种可见于多部位的间叶来源性肿瘤,儿童少见。Zamboni等[1]于1996年首次报道并命名,2013年世界卫生组织将其定义为一组来源于血管周围细胞的间叶源性肿瘤,常表达黑色素和平滑肌标志物。起源于腹壁的PEComa目前少见文献报道。苏州大学附属儿童医院普外科2022年收治1例儿童腹壁血管周上皮样细胞瘤病例,现报道如下。
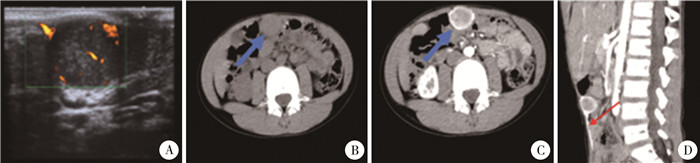
患儿,男,7岁,体重22.5 kg。2022年1月23日以“发现脐部肿块6月余”为主诉入院。患儿为家属无意间触及脐部一包块,不突出皮肤表面,无红、肿、触痛,无特殊不适,血液检查肿瘤标志物如癌胚抗原carcinoembryonic antigen, CEA)、甲胎蛋白(alpha-fetal protein, AFP)、糖类抗原125(carbohydrate antigen 125, CA125)、糖类抗原199(carbohydrate antigen 199, CA199)等指标均在正常范围,近期肿块有增大趋势。入院查体:脐部上方可触及一皮下包块,大小约2.0 cm×2.5 cm×2.0 cm,质硬,活动度一般,深压痛,无波动感。腹部彩色多普勒超声检查(图 1A)提示:中上腹实质性稍低回声团,约2.6 cm×2.4 cm×2.2 cm大小。腹部CT平扫及增强检查提示(图 1B~D):腹前壁下、中线区可见一类圆形软组织影,密度均匀,CT值约49 Hu,边界尚清楚,增强扫描提示病灶明显强化,CT值约90 Hu,前方两侧可见腹壁下供血动脉影。
|
图 1 腹壁血管周上皮样细胞瘤患儿的B超及CT平扫+增强照片 Fig.1 Images of ultrasound, plain and enhanced CT scan in children with abdominal wall perivascular epithilioid cell tumor 注 A: 腹部B超示皮下至腹腔内实质性类圆形稍低回声团,形态规划,边界清,可见包膜,内部回声不均,可见细点状高回声,内部及包膜见较多血流信号;B: 腹部CT平扫可见一类圆形软组织影,密度均匀,边界清;C:腹部增强CT横断面见病灶明显强化;D:增强CT矢状面见病灶腹壁下供血动脉影 |
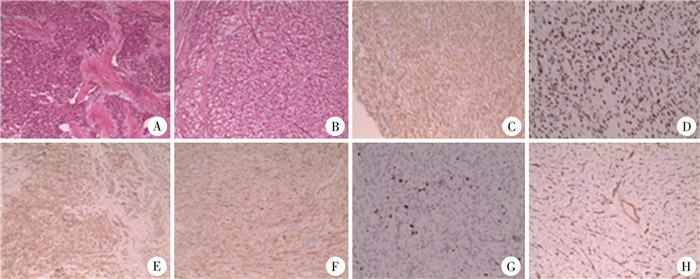
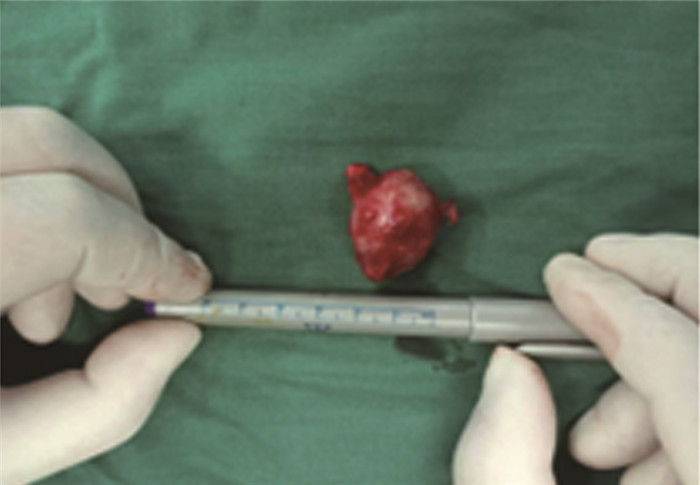
考虑肿块短期内有增大趋势,手术指征明确,遂于全身麻醉下行腹壁肿物切除术。术中取脐上方纵切口,打开皮肤及皮下组织,见肿块与周围组织界限清晰,大小约2.5 cm×2.0 cm×2.5 cm,质韧,上方可见一支供血动脉,下方见两支供血动脉(图 3),腹直肌光滑平整,局部少许腹直肌鞘有缺损,肿块基底部局部疑似起于腹膜。术中送快速病理切片考虑为纤维组织源性肿瘤,倾向中间性肿瘤。遂完整切除肿块及边缘腹膜,送常规病理及免疫组织化学检查,逐层关腹。术后病情平稳,2 d后出院。术后病理检查结果提示为腹壁血管周上皮样细胞瘤(图 2A、B),免疫组织化学检查结果(图 2C~H):HMB45(+)、INI-1(+)、TFE-3(部分+)、Melan-A(+)、S100(-)、Ki-67(2%+)、CD34(+)、SMA(+)、Desmin(-)、CK(-)。结合病理结果, 考虑肿块直径小于3 cm,边缘清晰,核分裂象少,无明显肿瘤坏死和血管侵犯,判断为良性。术后定期随访1年,复查腹部B超,未见明显异常。
|
图 2 腹壁血管周上皮样细胞瘤患儿病理检查图片(HE染色,×40)及免疫组化结果(×40) Fig.2 Pathological pictures(HE, ×40)and immunohistochemistry(×40) of the tumor 注 A、B:腹壁肿块以梭形细胞增生为主,大部分区域胞浆较空淡、核分裂少见,周围腹膜局部组织纤维增生改变;C:HMB45(+); D:INI-1(+);E:TFE-3(部分+);F:Melan-A(+); G:Ki-67(2%+); H:CD34(+) |
|
图 3 腹壁血管周上皮样细胞瘤患儿切除肿物图片 Fig.3 Intraoperative picture of the removed mass 注 肿块边缘光滑,边界清晰 |
讨论 血管周上皮样细胞瘤是一种较为少见的间叶性肿瘤。Zamboni等[1]于1996年首次报道,并根据其结构及免疫表型特点命名为PEComa。根据2020世界卫生组织对软组织肿瘤分类的调整,目前PECmoa主要包括非特殊性血管周上皮样细胞瘤(PEComa-not otherwise specified, PEComa-NOS)、肾血管平滑肌脂肪瘤(angiomyolipoma, AML)和肺淋巴管平滑肌瘤病(lymphangioleiomyomatosis, LAM)[2]。PEComa在间叶性肿瘤中发病率较低,成人患者中有明显性别差异,女性多于男性(比例约为4~6 ∶ 1),儿童未见明显差异[3]。文献报道全球范围内腹壁PEComa较少,仅由Folpe等[3]、Gan等[4]报道成人患者3例,儿童中尚未见文献报道。
PEComa可见于多个部位,子宫、膀胱、肝、肾、肺、结直肠等均有报道,肾脏为最常见原发器官[5-9]。其中,儿童PEComa主要发生在结肠[6]。眼眶、皮肤、阴道、心房等亦有散发报道[10-13]。不同部位的PEComa临床症状各异,大部分患儿无临床症状,多在体检时发现,而腹壁PEComa一般表现为间歇性腹痛、进行性增大的肿块或无症状。目前PEComa的发病机制尚不明确,近年来有文献报道,PEComa可能与结节性硬化症(tuberous sclerosis complex, TSC)相关[14]。Kenerson等[15]利用免疫组化和蛋白免疫印迹分析表明,在肾外PEComa中,存在TSC1/2失活和mTOR的过度激活。
本例患儿仅以进行性增大的脐部肿块为主要表现,腹部超声及CT均无特异性,与脐尿管囊肿、错构瘤等类似。因此该肿瘤术前诊断率极低,确诊依赖于术后病理及免疫组化标志物检查。PEComa通常由多种血管、平滑肌细胞和脂肪组织的混合物组成。镜下见肿瘤细胞呈上皮样或纺锤形,排列成带状、巢状或漩涡状,并被不同数量的脂肪组织交织,胞质明亮且丰富,呈嗜酸性,伴有不同程度的空泡变性。肿瘤细胞呈放射状分布在血管腔周围是其另一个显著特征,血管腔可因瘤体细胞的挤压而出现不规则的扩张或扭曲[14]。在免疫组织化学上,PEComa常以黑色细胞标志物(HMB-45、Melan-A)和肌源性标志物(SMA、Desmin)共表达为特征,一般S-100阴性,偶可表达细胞角蛋白。形态不同的PEComa其免疫表型略有差异,以梭形细胞为主的肿瘤多表达肌源性标志物;以上皮样细胞为主的肿瘤主要表达黑色素标志物[16]。本例属于PEComa-NOS,需与平滑肌瘤病相鉴别,后者镜下可见细胞核呈短梭形,无核分裂,无出血、坏死等,免疫组化见平滑肌细胞分化特征,SMA、Desmin等阳性,而HMB-45、D2-40和CD34呈阴性表达,可资鉴别。
在治疗上,手术是良性PEComa的首选方法。对于恶性PEComa,目前尚无明确诊断标准。Folpe等[3]通过随访分析26例患者相关信息将恶性特征归纳为:肿瘤>5cm、浸润性生长、核异型性、肿瘤坏死、血管侵犯。当肿瘤具有上述特征中两个以上时,则为恶性。由于该肿瘤发病机制尚不明确,常规化疗及放疗未显示出明确效果,手术依然是恶性PEComa的首选治疗方法。同时有研究表明,mTOR(雷帕霉素哺乳动物靶蛋白)抑制剂如依维莫司、西罗莫司对患者预后或有改善作用,但尚缺乏大规模临床试验提供支持[17-18]。
综上所述,PEComa在儿童中发病率极低,位于腹壁的儿童PEComa缺少临床特异性,术前误诊率高,诊断依赖于病理检查,尤其是免疫组化染色特定标志物的测定。治疗上以手术为首要手段,术后需密切随访。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 张宇负责论文撰写;王凡负责资料收集、文献检索;潘江、张宇负责手术实施、研究结果分析与讨论;潘江负责论文审阅
| [1] |
Zamboni G, Pea M, Martignoni G, et al. Clear cell "sugar" tumor of the pancreas.A novel member of the family of lesions characterized by the presence of perivascular epithelioid cells[J]. Am J Surg Pathol, 1996, 20(6): 722-730. DOI:10.1097/00000478-199606000-00010 |
| [2] |
宣兰兰, 魏建国, 刘红刚. 血管周上皮样细胞肿瘤的病理诊断及新进展[J]. 中华病理学杂志, 2021, 50(3): 282-287. Xuan LL, Wei JG, Liu HG. Pathological diagnoses and recent advances of perivascular epithelioid cell tumor[J]. Chin J Pathol, 2021, 50(3): 282-287. DOI:10.3760/cma.j.cn112151-20200721-00579 |
| [3] |
Folpe AL, Mentzel T, Lehr HA, et al. Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin: a clinicopathologic study of 26 cases and review of the literature[J]. Am J Surg Pathol, 2005, 29(12): 1558-1575. DOI:10.1097/01.pas.0000173232.22117.37 |
| [4] |
Gan DEY, Choy RXY, Sellappan H, et al. Malignant subcutaneous perivascular epithelioid cell tumor of anterior abdominal wall[J]. Oman Med J, 2021, 36(2): e239. DOI:10.5001/omj.2021.21 |
| [5] |
Folpe AL, Kwiatkowski DJ. Perivascular epithelioid cell neopla-sms: pathology and pathogenesis[J]. Hum Pathol, 2010, 41(1): 1-15. DOI:10.1016/j.humpath.2009.05.011 |
| [6] |
Kou L, Zheng WW, Jia L, et al. Pediatric case of colonic perivascular epithelioid cell tumor complicated with intussusception and anal incarceration: a case report[J]. World J Gastrointest Oncol, 2022, 14(7): 1348-1355. DOI:10.4251/wjgo.v14.i7.1348 |
| [7] |
de León DC, Pérez-Montiel D, Bandera A, et al. Perivascular epithelioid cell tumor of abdominal origin[J]. Ann Diagn Pathol, 2010, 14(3): 173-177. DOI:10.1016/j.anndiagpath.2010.02.007 |
| [8] |
张弓. 具有血管周上皮样细胞分化的肿瘤: 对于肾PEComa的临床诊疗分析[D]. 沈阳: 中国医科大学, 2021. DOI: 10.27652/d.cnki.gzyku.2021.001267. Zhang G. Perivascular epithelioid cell tumors: an analysis of clinical diagnosis and treatment of renal PEComa[D]. Shenyang: China Medical University, 2021. DOI: 10.27652/d.cnki.gzyku.2021.001267. |
| [9] |
Baba T, Kawano T, Saito Y, et al. Malignant perivascular epithelioid cell neoplasm in the liver: report of a pediatric case[J]. Surg Case Rep, 2021, 7(1): 212. DOI:10.1186/s40792-021-01300-w |
| [10] |
Huang P, Zhu L, Cui HJ. Perivascular epithelioid cell tumor (PEComa) of the left atrium: a pediatric case report[J]. Chin J Pediatr, 2010, 48(8): 635-637. DOI:10.3760/cma.j.issn.0578-1310.2010.08.020 |
| [11] |
Cho HJ, Lee MK, Kang BM, et al. A 6-year-old girl with vaginal spotting who was diagnosed with perivascular epithelioid cell neoplasm after vaginoscopic resection[J]. Obstet Gynecol Sci, 2014, 57(5): 409-411. DOI:10.5468/ogs.2014.57.5.409 |
| [12] |
Odoño EIG, Tan KB, Tay SY, et al. Cutaneous "fibroma-like" perivascular epithelioid cell tumor: a case report and review of literature[J]. J Cutan Pathol, 2020, 47(6): 548-553. DOI:10.1111/cup.13647 |
| [13] |
雷浪, 王意琴, 陈沙, 等. 儿童眼眶PEComa 1例[J]. 诊断病理学杂志, 2018, 25(11): 790-791. Lei L, Wang YQ, Chen S, et al. Pediatric orbital PEComa; one case report[J]. Chin J Diagn Pathol, 2018, 25(11): 790-791. DOI:10.3969/j.issn.1007-8096.2018.11.017 |
| [14] |
Martignoni G, Pea M, Reghellin D, et al. PEComas: the past, the present and the future[J]. Virchows Arch, 2008, 452(2): 119-132. DOI:10.1007/s00428-007-0509-1 |
| [15] |
Kenerson H, Folpe AL, Takayama TK, et al. Activation of the mTOR pathway in sporadic angiomyolipomas and other perivascular epithelioid cell neoplasms[J]. Hum Pathol, 2007, 38(9): 1361-1371. DOI:10.1016/j.humpath.2007.01.028 |
| [16] |
Utpatel K, Calvisi DF, Köhler G, et al. Complexity of PEComas: diagnostic approach, molecular background, clinical management[J]. Pathologe, 2020, 41(Suppl 1): 9-19. DOI:10.1007/s00292-019-0612-5 |
| [17] |
Fabbroni C, Sbaraglia M, Sanfilippo R. Medical treatment of advanced malignant perivascular epithelioid cell tumors[J]. Curr Opin Oncol, 2020, 32(4): 301-306. DOI:10.1097/CCO.0000000000000649 |
| [18] |
Wagner AJ, Ravi V, Riedel RF, et al. nab-Sirolimus for patients with malignant perivascular epithelioid cell tumors[J]. J Clin Oncol, 2021, 39(33): 3660-3670. DOI:10.1200/JCO.21.01728 |
 2024, Vol. 23
2024, Vol. 23


