腹腔淋巴管畸形罕见,仅占全身淋巴管畸形的5%左右,多为囊性淋巴管畸形,常发生于肠系膜和网膜[1-3]。网膜淋巴管畸形发病率约1/140 000,大部分起源于大网膜,极少累及小网膜[3-5]。与肠系膜淋巴管畸形一样,网膜淋巴管畸形早期多无症状,随着肿物增大,逐渐出现临床表现,但缺乏特异性,因而容易误诊[4-5]。与肠系膜淋巴管畸形的肠系膜与肠壁难以分离不同,网膜淋巴管畸形相对游离,与周围脏器粘连不严重,因而首选治疗方式为完整手术切除,预后通常较好[5-6]。既往文献报道腹腔镜手术可作为网膜淋巴管畸形切除的一种选择,但多为个案报道,缺乏大样本的临床研究[7-9]。本文旨在总结儿童网膜淋巴管畸形的临床特点以及手术治疗效果。
资料与方法 一、研究对象采用回顾性研究方法,通过首都医科大学附属北京儿童医院病案系统查询2010年1月至2022年12月出院诊断中含“网膜”的患儿信息,根据纳入与排除标准筛选出行手术治疗的网膜淋巴管畸形病例。病例纳入标准:①就诊年龄小于18岁; ②因网膜淋巴管畸形行手术治疗,术中探查囊肿起源于大网膜或小网膜; ③切除病变经术后病理检查证实为淋巴管畸形。排除标准:①重复住院病例;②非腹腔但含“网膜”二字的其他部位疾病(如视网膜母细胞瘤);③影像学检查提示为网膜肿物,但未行手术治疗;④术中探查结果为腹腔内其他部位疾病;⑤术后病理检查结果确诊为混合血管畸形,而非单纯的淋巴管畸形。本研究已通过首都医科大学附属北京儿童医院伦理委员会审核批准([2023]-E-088-R), 患儿家属均知情同意。
二、资料收集方法收集本院病案系统病例资料和随访资料。病例资料包括性别、产前资料、就诊年龄、临床表现、外院就诊信息、本院就诊时或入院后第一次实验室检查与影像学检查结果、术前并发症、手术情况、病理检查结果、术后恢复情况等。产前资料是指患儿在母亲怀孕期间是否接受产前影像学检查,并怀疑存在腹腔肿物或腹腔积液增多的现象[10]。外院就诊信息是指患儿在外院诊断为其他疾病,并接受相应保守治疗情况。由于本院病案系统于2016年进行了更新,2016年以前收治患儿入院前后实验室检查结果仅能从住院记录中获取,因而资料相对不全。本研究收集的实验室检查结果主要为血常规和C-反应蛋白,白细胞>12.0×109/L或C-反应蛋白>10 mg/L定义为炎症指标升高。影像学检查包括超声检查、CT检查和MRI检查。
本研究纳入的网膜淋巴管畸形患儿术前并发症种类包括囊内出血、囊肿感染、囊肿破裂、肠梗阻、网膜扭转或肠扭转(淋巴管畸形囊内出血和囊肿感染可同时出现,术中探查时凭囊液性质很难区分,因此分析时将二者作为一类并发症进行分析)[5, 7, 11-12]。手术情况包括手术入路、手术方式、手术时长等。术后恢复信息包括术后恢复经口进食时间和术后住院时间。
囊肿特点主要依靠手术记录和病理结果进行总结。囊肿特点包括囊肿位置、大小、病理类型以及囊液性质。根据囊肿所在位置,将网膜淋巴管畸形分为大网膜淋巴管畸形和小网膜淋巴管畸形。囊肿大小指囊肿长径,开腹手术或腹腔镜中转开腹手术患儿根据手术记录获取,腹腔镜或腹腔镜辅助等微创手术患儿则根据术前影像学检查结果获取。病理分型根据淋巴管畸形所含囊肿数量和大小,分为大囊型(单房或多房,各囊肿长径均≥1 cm)、微囊型(单房或多房,各囊肿长径均<1 cm)和混合型(多房,其中囊肿长径<1 cm和>1 cm均有)[13-14]。根据囊肿所含囊液性质的不同,分为浆液性、乳糜性和浑浊性(含血性)[15]。
随访资料包括门诊复查的超声结果及电话随访结果。患儿电话随访时间均超过6个月,均于2023年7月前完成随访。结合超声结果及电话随访结果,了解术后并发症的发生情况(包括囊肿残留或复发、粘连性肠梗阻等)。
根据术中探查所见囊液性质,将囊液性质为浑浊(含血性)的网膜淋巴管畸形视为术前存在囊内出血或囊肿感染。
网膜淋巴管畸形手术入路包括开腹手术、腹腔镜中转开腹手术、腹腔镜手术、腹腔镜辅助手术、机器人辅助手术。本研究根据手术入路将患儿分成开腹手术组(包括开腹手术和腹腔镜中转开腹手术)和腹腔镜手术组(包括腹腔镜手术、腹腔镜或机器人辅助手术),分析影响开腹手术和腹腔镜手术选择的可能因素。
三、统计学处理数据储存与整理使用Excel 2010,数据分析使用SPSS 26.0。服从正态分布的计量资料采用x±s表示,组间比较采用两独立样本t检验;不服从正态分布的计量资料采用M(Q1, Q3)表示,组间比较采用Mann-Whitney检验。计数资料采用频数(构成比)表示,组间比较采用χ2检验、Fisher精确检验或Spearman相关性检验。术者选择开腹手术或腹腔镜手术的影响因素分析采用二元Logistic回归分析。P<0.05为差异有统计学意义。
结果共76例网膜淋巴管畸形患儿纳入本研究(图 1),男46例、女30例,就诊年龄3.4(2.1,5.5)岁,最小年龄38天,最大年龄9岁7个月22天(图 2)。7例(7/76,9.2%)产前检查发现腹腔病变(腹腔囊性肿物或腹腔积液),发现时胎龄24~37周。11例(11/76,14.5%)因体检或其他疾病在本院行腹部超声检查或手术发现。腹痛(33/76,43.4%)、腹胀(27/76,35.5%)、发热(17/76,22.4%)、呕吐(14/76,18.4%)是网膜淋巴管畸形患儿常见临床表现,另有3例(3/76,3.9%)因阴囊肿物、怀疑嵌顿疝或鞘膜积液就诊。23例(23/76,30.3%)就诊本院前曾在外院考虑其他疾病而予相应保守治疗,考虑疾病包括腹腔积液(10/23,43.5%)和胃肠炎(4/23,17.4%)。
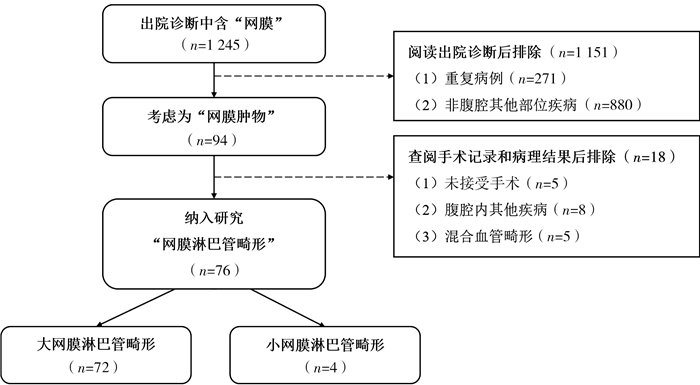
|
图 1 本研究儿童网膜淋巴管畸形病例筛选流程图 Fig.1 Flowchart of including and excluding cases |
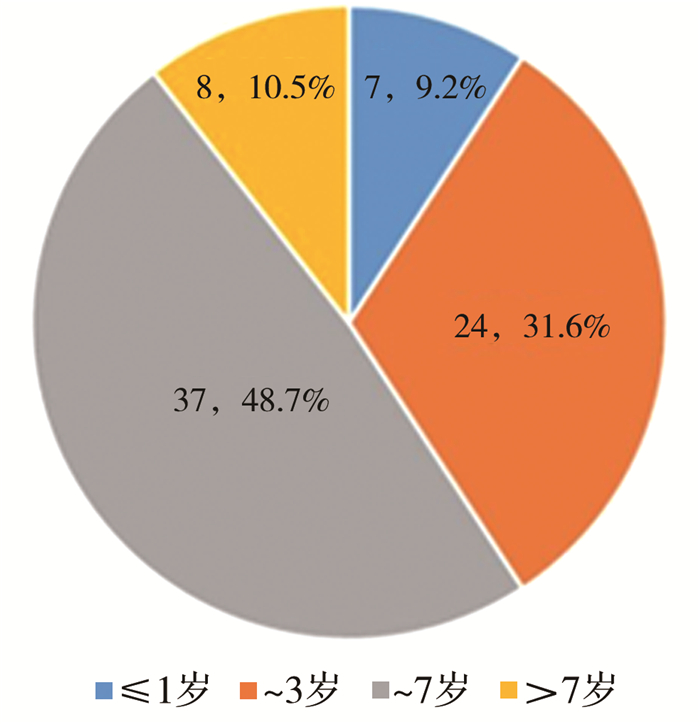
|
图 2 76例网膜淋巴管畸形患儿年龄分布情况[n(%)] Fig.2 Distribution of 76 children of omental lymphatic malformations by age groups |
43例获得就诊时或入院后第1次实验室检查结果,其中炎症指标升高19例(19/43,44.2%)。患儿均于本院行腹部超声检查,53例(53/76,69.7%)完善腹部平扫或增强CT检查,部分可辅助判断病变起源于大网膜或小网膜(图 3)。网膜淋巴管畸形长径15.0(10.0,20.0)cm。68例(68/76,89.5%)为大囊型。30例(30/71,42.3%)囊液为浑浊性(含血性),1例(1/71,1.4%)囊液为乳糜性,与周围组织粘连严重,故共有31例(31/76,40.8%)术前合并囊内出血或囊肿感染(表 1)。
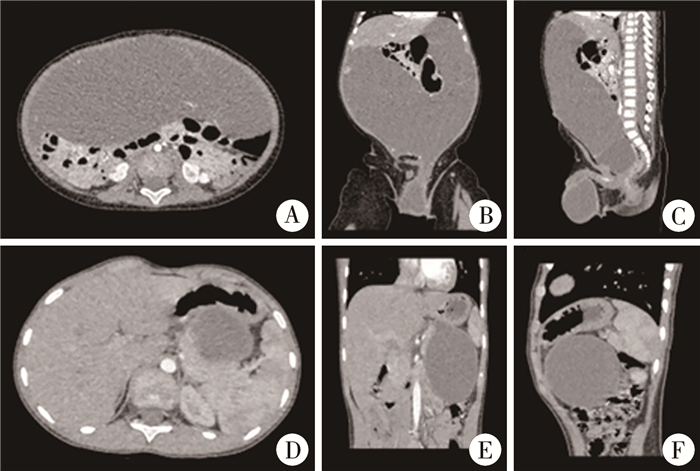
|
图 3 网膜淋巴管畸形患儿典型腹部CT图像 Fig.3 Typical abdominal computed tomography (CT) images of omental lymphatic malformations 注 A-C:典型大网膜淋巴管畸形腹部CT图像;D-F:典型小网膜淋巴管畸形腹部CT图像 |
| 表 1 76例网膜淋巴管畸形患儿临床特点 Table 1 Clinical characteristics of 76 children with omental lymphatic malformations |
|
|
比较有或无囊内出血或囊肿感染患儿的临床资料发现,合并囊内出血或囊肿感染者出现腹胀的比例更高(P=0.015),炎症指标升高人数占比更高(P=0.026);而囊肿长径≤10 cm者所占比例在合并囊内出血或囊肿感染的患儿中更低(P=0.044)。其他临床特点见表 2。
| 表 2 有或无术前囊内出血或囊肿感染的网膜淋巴管畸形患儿临床特点比较 Table 2 Clinical characteristics of omental lymphatic malformations with or without preoperative hemorrhage or infection |
|
|
两组分别有43例(43/76,56.6%)和33例(33/76,43.4%)患儿行开腹手术及腹腔镜手术,腹腔镜手术数量呈逐年增加趋势,2010—2012年开腹手术16例,腹腔镜手术1例;2013—2015年开腹手术13例,腹腔镜手术4例;2016—2018年开腹手术10例,腹腔镜手术10例;2019—2022年开腹手术4例,腹腔镜手术18例。开腹手术组和腹腔镜手术组患儿性别、就诊年龄、囊肿位置、病理类型、囊液性质以及术前并发症比较,差异均无统计学意义(P>0.05);腹腔镜手术组患儿存在腹痛表现者占比更高(19/33比14/43,P=0.029),囊肿长径更小[13.0(10.0,16.0)cm比15.0(12.8,20.0)cm,P=0.011],见表 3、表 4。多因素分析结果显示,腹痛是影响腹腔镜手术选择最主要的因素(OR:3.1,95%CI:1.1 ~9.0,P=0.032);其次是囊肿长径(OR:0.9,95%CI:0.8~1.0,P=0.049)。见表 5。
| 表 3 影响网膜淋巴管畸形治疗中开腹手术与腹腔镜手术选择相关因素分析的变量赋值 Table 3 Variables influencing the selection of laparotomy or laparoscopy for omental lymphatic malformations and its assigned values |
|
|
| 表 4 网膜淋巴管畸形治疗中开腹手术和腹腔镜手术选择影响因素的单因素分析 Table 4 Univariate analysis of influencing factors for selecting of laparotomy or laparoscopy for omental lymphatic malformations |
|
|
| 表 5 网膜淋巴管畸形治疗中开腹手术和腹腔镜手术选择影响因素的多因素分析结果 Table 5 Multivariable analysis of influencing factors for selecting of laparoscopy or open surgery for omental lymphatic malformations |
|
|
与开腹手术组相比,腹腔镜手术组患儿手术时长无明显延长,但术后恢复进食的时间更早[术后1.0(1.0,2.0)d比2.0(2.0,3.0)d,P=0.001]、住院时长更短[4.0(3.5,5.0)d比6.0(4.0,7.0)d,P=0.001],见表 6。本研究共随访到61例(61/76,80.3%)患儿,其中开腹手术32例,腹腔镜手术29例,随访5.7(3.8,9.5)年,5例(5/61,8.2%)出现术后并发症,腹腔镜手术组与开腹手术组术后并发症的发生率比较,差异无统计学意义(3/29比2/32,P=0.662)。
| 表 6 网膜淋巴管畸形患儿开腹手术和腹腔镜手术治疗效果比较 Table 6 Comparing the outcomes of omental lymphatic malformations by laparoscopy or open surgery |
|
|
网膜是腹腔内仅次于肠系膜的淋巴管畸形好发部位,占所有腹腔淋巴管畸形的6% ~21%,其病理结果常为淋巴管畸形被网膜脂肪组织包绕,一般认为与胚胎时期网膜淋巴系统发育异常有关[3-4, 16]。绝大多数网膜淋巴管畸形不与周围脏器相连,可完整切除,且预后良好[16]。
网膜淋巴管畸形由Gairdner[17]于1852年首次报道,目前文献报道已超过200例[16]。1995年,Conlon等[18]首次报道腹腔镜下完整切除网膜囊肿并获良好预后。此后,有个案或小样本病例报道腹腔镜或腹腔镜辅助下切除网膜淋巴管畸形,但缺乏大样本研究[9, 19-20]。本研究旨在系统总结儿童网膜淋巴管畸形的临床特点、术前并发症情况,并比较开腹手术和腹腔镜手术的疗效差异。
与既往研究结果一致,儿童网膜淋巴管畸形好发于男性,绝大多数在幼儿期和学龄前期被发现[4, 9, 21]。这可能与网膜淋巴管畸形患儿出生后早期无明显临床表现或仅有轻微临床表现有关。幼儿期和学龄前期患儿好动,可于摔倒、碰撞后被发现。本研究中有4例患儿于外伤后行腹部超声检查发现腹腔存在囊性病变。此外,随着孕期影像学检查的普及和超声检查水平的提升,部分网膜淋巴管畸形在孕晚期被发现,但由于影像学检查较难判断淋巴管畸形的具体位置,因此很多家长在患儿出生后选择保守观察,而非直接干预,直至出现并发症、表现出明显临床表现才接受治疗[10, 22]。网膜淋巴管畸形的临床表现与肠系膜淋巴管畸形相似,表现多样,较为典型的临床表现是腹胀随着肿物增大而加重,极少数患儿可因肿物巨大而引起肠梗阻、泌尿系梗阻甚至胆道梗阻[23-24]。本研究中腹胀是仅次于腹痛的第二常见临床表现。此外,由于网膜淋巴管畸形与消化道的关系不密切,其引起呕吐等急性临床表现的情况较少,早期症状轻微时更容易接受保守治疗[22]。急性发作的临床表现往往与囊肿并发症相关[4, 7, 23]。本研究中有1例患儿短时间内出现明显腹胀及乏力,术中探查发现囊液为血性液体,囊肿张力较高,提示并发囊内出血。文献报道当患儿合并内环口未闭时,可出现与鞘膜积液相同的临床表现,本研究中3例患儿存在此临床表现[25-26]。
与肠系膜淋巴管畸形容易出现肠扭转不同,囊内出血或囊肿感染是网膜淋巴管畸形最常见的术前并发症[22]。这可能与网膜淋巴管畸形的囊肿位置较肠系膜淋巴管畸形更加表浅有关,患儿发生轻微碰撞或剧烈运动后更容易出现囊内出血。发生囊内出血后,更容易继发囊肿感染。本研究发现术前合并囊内出血或囊肿感染的患儿出现腹胀表现者占比更高,囊肿平均长径也较长。此外,入院后实验室检查提示这些患儿炎症指标升高的可能性更大,表明无论是出现囊内出血还是囊肿感染,都会激活人体免疫系统,导致炎症指标升高[27-28]。因此,当怀疑患儿腹腔淋巴管畸形,存在腹胀表现和炎性指标升高时,应考虑囊内出血或囊肿感染的可能,积极给予保守治疗,症状无法缓解时应尽快手术治疗。
除了囊肿液体不会出现在肠系膜间和肝脏周围这一可能提示存在网膜淋巴管畸形的影像学特征以外,术前影像学检查(包括超声检查和CT检查)均较难区分腹腔内淋巴管畸形的具体位置,因而最终明确诊断仍需通过手术探查[21, 26]。与肠系膜淋巴管畸形不同,网膜淋巴管畸形的手术治疗几乎不涉及消化道的切除和吻合,因而手术操作更加简单,能够通过大网膜切除而尽量减少囊肿残留和复发的可能[16, 21]。考虑到其他治疗方式均存在复发和感染的可能,因此仍推荐以手术治疗为主。随着家长对良性疾病治疗更多微创、美观的要求,腹腔镜或腹腔镜辅助网膜淋巴管畸形切除手术已逐渐代替开腹手术,成为首选的手术方式[9]。此外,腹腔镜也是明确腹腔淋巴管畸形来源和范围的一种方式,可根据镜下所见(包括与周围组织的粘连程度、有无严重并发症等),进一步选择合适的手术方式。既往报道的腹腔镜手术主要包括两种术式:一种是完全腹腔镜下切除淋巴管畸形;一种是腹腔镜辅助切除淋巴管畸形,先经腹腔镜探查,对淋巴管畸形进行定位、减压,再扩大脐部切口将肿物提出腹腔加以切除[29-31]。第一种方式在成人患者中应用广泛,因为成人腹腔较大;而儿童患者由于腹腔相对较小,常用的是腹腔镜辅助淋巴管畸形切除术[31]。本研究主要采用腹腔镜辅助术式,该手术入路操作过程中应尽可能避免囊肿破裂、囊液污染腹腔,包括切开腹膜后再放置Trocar、通过吸引器充分减压后再将囊肿提出腹腔等。
本研究还发现腹腔镜手术组患儿腹痛的发生率更高,囊肿长径更小。囊肿长径较小,有利于腹腔镜手术的开展,但并非长径大的囊肿就无法行腹腔镜手术[31]。此外,腹痛是儿童急腹症的临床表现之一,可能导致术者选择开腹手术,这与本研究结果不相符。因此,关于网膜淋巴管畸形究竟选择何种手术入路,主要与术者手术理念和经验相关,这也是可能导致本研究结果出现偏倚的主要原因。本研究虽然不是由同一手术团队进行手术,但后期绝大多数患儿均采用腹腔镜手术,因而可能导致多因素分析结果存在偏差。
此外本研究证实,与开腹手术相比,腹腔镜手术治疗网膜淋巴管畸形术后恢复更快,表现为术后进食更早、住院时间更短[9]。此外,通过门诊复查超声结果和电话随访发现,腹腔镜手术并未显著增加患儿术后并发症的发生率。因此我们认为,腹腔镜手术可以作为网膜淋巴管畸形患儿的首选手术方式。
综上,本中心13年手术治疗网膜淋巴管畸形的经验显示,儿童网膜淋巴管畸形术前较难诊断,容易出现并发症,建议对怀疑腹腔存在网膜淋巴管畸形的患儿尽快手术治疗。当患儿出现腹胀、炎症指标升高和囊肿增大时,需要考虑出现囊内出血或囊肿感染。腹腔镜手术可作为儿童网膜淋巴管畸形的首选手术方式。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 严佳虞负责论文设计、数据收集、研究结果分析与讨论、论文撰写;庞文博、张丹负责研究结果分析与讨论,并对全文知识性内容进行审读与修正;陈亚军负责论文设计,并对全文知识性内容进行审读与修正
| [1] |
Wohlgemuth WA, Brill R, Dendl LM, et al. Abdominal lymphatic malformations[J]. Radiologe, 2018, 58(Suppl 1): 29-33. DOI:10.1007/s00117-017-0337-5 |
| [2] |
Lal A, Gupta P, Singhal M, et al. Abdominal lymphatic malformation: spectrum of imaging findings[J]. Indian J Radiol Imaging, 2016, 26(4): 423-428. DOI:10.4103/0971-3026.195777 |
| [3] |
Mede A, Chotai PN, Huh WJ, et al. Intra-abdominal cystic lymphangiomas: the Vanderbilt experience[J]. J Surg Res, 2023, 285: 197-204. DOI:10.1016/j.jss.2022.12.026 |
| [4] |
Egozi EI, Ricketts RR. Mesenteric and omental cysts in children[J]. Am Surg, 1997, 63(3): 287-290. |
| [5] |
Robbins KJ, Antiel RM, Shakhsheer BA. Omental cyst: a case report and review of the literature[J]. Ann Pediatr Surg, 2021, 17(1): 62. DOI:10.1186/s43159-021-00129-0 |
| [6] |
Namikawa T, Shimizu S, Yokota K, et al. Cystic lymphangioma of the greater omentum treated by laparoscopic resection[J]. Clin J Gastroenterol, 2021, 14(4): 1004-1007. DOI:10.1007/s12328-021-01404-8 |
| [7] |
Ishii S, Hayashida M, Nakatani K, et al. Omental lymphangioma presenting with acute abdomen due to hemorrhage[J]. Pediatr Int, 2018, 60(9): 896-898. DOI:10.1111/ped.13640 |
| [8] |
Deshpande AA, Dalvi AN. Laparoscopic excision of a giant mesothelial omental cyst[J]. J Minim Access Surg, 2012, 8(2): 57-58. DOI:10.4103/0972-9941.95538 |
| [9] |
李小松, 任松林, 刘璐, 等. 小儿大网膜囊肿诊疗分析[J]. 临床小儿外科杂志, 2013, 12(3): 232-233. Li XS, Ren SL, Liu L, et al. Diagnosis and treatment of omental cysts in children[J]. J Clin Ped Sur, 2013, 12(3): 232-233. DOI:10.3969/j.issn.1671-6353.2013.03.022 |
| [10] |
Liu YP, Huang YL, Tsai PS, et al. Prenatal diagnosis of abdominal lymphatic malformations[J]. Taiwan J Obstet Gynecol, 2021, 60(1): 13-19. DOI:10.1016/j.tjog.2020.11.003 |
| [11] |
Fitoz S, Atasoy C, Ekim M, et al. Torsion of a giant omental cyst mimicking ascites[J]. J Clin Ultrasound, 2007, 35(2): 85-87. DOI:10.1002/jcu.20248 |
| [12] |
Yan JY, Wang L, Xie CP, et al. Preoperative complications in children with mesenteric lymphatic malformations: incidence, risk factors and outcomes[J]. Front Pediatr, 2022, 10: 1033897. DOI:10.3389/fped.2022.1033897 |
| [13] |
Wassef M, Blei F, Adams D, et al. Vascular anomalies classification: recommendations from the international society for the study of vascular anomalies[J]. Pediatrics, 2015, 136(1): e203--e2014. DOI:10.1542/peds.2014-3673 |
| [14] |
McCormack L, Jones K, Huang JT. Micro-and macrocystic lymphatic malformation[J]. J Pediatr, 2020, 219: 275-276. DOI:10.1016/j.jpeds.2019.12.004 |
| [15] |
Losanoff JE, Richman BW, El-Sherif A, et al. Mesenteric cystic lymphangioma[J]. J Am Coll Surg, 2003, 196(4): 598-603. DOI:10.1016/S1072-7515(02)01755-6 |
| [16] |
Conzo G, Vacca R, Grazia Esposito M, et al. Laparoscopic treatment of an omental cyst: a case report and review of the literature[J]. Surg Laparosc Endosc Percutan Tech, 2005, 15(1): 33-35. DOI:10.1097/01.sle.0000148472.97417.ca |
| [17] |
Gairdner WT. A remarkable cyst in the omentum[J]. Trans Pathol Soc Lond, 1852, 3: 374-375. |
| [18] |
Conlon KC, Dougherty EC, Klimstra DS. Laparoscopic resection of a giant omental cyst[J]. Surg Endosc, 1995, 9(10): 1130-1132. DOI:10.1007/BF00189004 |
| [19] |
Kuriansky J, Bar-Dayan A, Shabtai M, et al. Laparoscopic resection of huge omental cyst[J]. J Laparoendosc Adv Surg Tech A, 2000, 10(5): 283-285. DOI:10.1089/lap.2000.10.283 |
| [20] |
Yao CC, Wu TL, Wong HH, et al. Laparoscopic resection of an omental cyst with pedicle torsion[J]. Surg Laparosc Endosc Percutan Tech, 1999, 9(5): 372-374. |
| [21] |
汤永辉, 姜斌, 陈吉, 等. 儿童大网膜囊肿26例临床病例资料分析[J]. 东南国防医药, 2020, 22(4): 381-384. Tang YH, Jiang B, Chen J, et al. Analysis of case records for 26 children of omental cysts[J]. Mil Med J Southeast China, 2020, 22(4): 381-384. DOI:10.3969/j.issn.1672-271X.2020.04.010 |
| [22] |
Yan JY, Xie CP, Chen YJ. Surgical treatment of mesenteric lymphatic malformations in children: an observational cohort study[J]. J Pediatr Surg, 2023, 58(9): 1762-1769. DOI:10.1016/j.jpedsurg.2023.02.041 |
| [23] |
Kokhanovsky N, Nachtigal A, Reindorp N, et al. Giant omental hemorrhagic cyst presenting as acute hemorrhagic anemia in a 21-month-old infant[J]. Pediatr Emerg Care, 2014, 30(3): 188-190. DOI:10.1097/PEC.0000000000000092 |
| [24] |
Ravindranath A, Wadhwa RP, Sandeep BS, et al. Infant with "ascites"[J]. J Pediatr, 2021, 237: 314-315. DOI:10.1016/j.jpeds.2021.05.065 |
| [25] |
Tsuchiya T, Inoue M, Yasui T, et al. Inguinal herniation of omental lymphatic malformation mimicking hydrocele[J]. Pediatr Int, 2022, 64(1): e15307. DOI:10.1111/ped.15307 |
| [26] |
Nett MH, Vo NJ, Chapman T. Large omental cyst[J]. Radiol Case Rep, 2015, 5(2): 388. DOI:10.2484/rcr.v5i2.388 |
| [27] |
Müller M, Tapia-Perez JH, Yildiz C, et al. Alterations in inflammatory markers and clinical outcome after spontaneous intracerebral hemorrhage-preliminary results[J]. J Stroke Cerebrovasc Dis, 2020, 29(8): 104861. DOI:10.1016/j.jstrokecerebrovasdis.2020.104861 |
| [28] |
Illanes S, Liesz A, Sun L, et al. Hematoma size as major modulator of the cellular immune system after experimental intracerebral hemorrhage[J]. Neurosci Lett, 2011, 490(3): 170-174. DOI:10.1016/j.neulet.2010.11.065 |
| [29] |
Pampal A, Yagmurlu A. Successful laparoscopic removal of mesenteric and omental cysts in toddlers: 3 cases with a literature review[J]. J Pediatr Surg, 2012, 47(8): e5-e8. DOI:10.1016/j.jpedsurg.2012.03.080 |
| [30] |
Tran NS, Nguyen TL. Laparoscopic management of abdominal lymphatic cyst in children[J]. J Laparoendosc Adv Surg Tech A, 2012, 22(5): 505-507. DOI:10.1089/lap.2012.0003 |
| [31] |
Al-Zaiem MM. Assisted laparoscopic excision of huge abdominal cysts in newborns and infants using the umbilical laparoscopic port incision[J]. J Pediatr Surg, 2011, 46(7): 1459-1463. DOI:10.1016/j.jpedsurg.2011.03.004 |
 2024, Vol. 23
2024, Vol. 23


