2. 苏州大学附属儿童医院儿科临床研究院, 苏州 215025;
3. 山东大学齐鲁医院儿外科, 青岛 266035
2. Institute of Pediatric Researches, Affiliated Children's Hospital, Soochow University, Suzhou 215025, China;
3. Department of Pediatric Surgery, Qilu Hospital, Cheeloo College of Medicine, Shandong University, Qingdao 266035, China
先天性巨结肠相关性小肠结肠炎(Hirschsprung-associated enterocolitis, HAEC)是并发于先天性巨结肠(Hirschsprung's disease, HD)的一种肠道炎症疾病,发病机制复杂[1]。目前研究表明,黏膜屏障改变、肠道运动障碍、肠免疫功能异常及肠道菌群改变,都可能导致HAEC的发生、发展。HAEC作为先天性巨结肠最常见和最严重的并发症,目前仍没有特异性治疗方法,严重影响患儿后续生存质量,增加治疗的经济负担[2]。进一步探究HAEC的发病机制对优化治疗方案有着重要的意义, 稳定而可靠的动物模型将有利于研究者针对HAEC的发病机制进行更深入的研究。目前用于HAEC研究的常用动物模型包括苯扎氯铵诱导的大鼠模型和EdnrB-/-小鼠模型,尽管二者在一定程度上揭示了HAEC的潜在发病机制,但仍存在不足之处[3]。用苯扎氯铵诱导的巨结肠模型能够模拟肠神经缺失导致的肠道运动功能障碍,但肠神经丧失的机制和时机与临床上先天性巨结肠不同[4]。EdnrB-/-小鼠模型模拟了遗传因素在HD和HAEC发病中的作用,但HD和HAEC的发生涉及多个基因和环境因素,EdnrB-/-小鼠模型的病理特征与HAEC患儿可能不同[5]。因此,对比目前常用的HAEC动物模型与HAEC患儿的临床表现及肠道病理变化,不仅有利于指导今后研究中选择与HAEC发生、发展过程更为相似的动物模型,也为开发更全面模拟临床HAEC发病过程的动物模型提供了基础。
资料与方法 一、实验试剂及仪器苯扎氯铵(美国Sigma公司),UCHL1/PGP9.5(武汉三鹰生物技术有限公司),Claudin 3抗体(武汉赛维尔生物科技有限公司),E-Cadherin抗体(美国CST公司),Occludin抗体(英国Abcam公司),GAPDH(美国CST公司),β-actin抗体(美国CST公司),RIPA裂解液(上海碧云天生物技术公司),Protein Ladder (美国赛默飞公司),6% ~15% SDS-PAGE分离胶(上海雅酶公司),One Step Mouse Genotyping Kit(南京诺唯赞生物科技股份有限公司),超声破碎机(德国Bandelin公司),蛋白电泳及转膜系统(瑞典罗氏公司),PCR扩增仪(美国Bio-Rad公司)。
二、人类组织标本收集于2021年7月至2023年7月在苏州大学附属儿童医院接受手术治疗的HD患儿肠道组织,根据肠道大体形态将结肠组织分为狭窄段和扩张段进行保存。将留取的标本分为两份,一份用4%多聚甲醛固定送至病理科进行H&E染色,另一份做好标识后放置于-80°冰箱保存以备后续使用。采用文献报道的标准对HD患儿的肠道组织标本进行炎症病理评分[6]。评分等级等于或高于Ⅲ级的HAEC患儿纳入本研究。选取的对照组为先天性肛门闭锁患儿造瘘处附近结肠。
三、实验动物选择21日龄健康斯泼累格·多雷(Sprague Dawley, SD)大鼠24只(购于杭州子源实验动物科技有限公司),随机分为实验组与对照组,每组12只。EdnrB基因敲除杂合子小鼠(C57BL/6J-Ednrbem1Cya)购于苏州赛业生物科技公司,根据基因鉴定结果将21日龄EdnrB-/-小鼠纳入实验组,将同日龄野生型小鼠纳入对照组,每组5只,统一饲养于苏州大学附属儿童医院动物实验中心,提供光照、温度、湿度均适宜的饲养环境。
四、EdnrB基因敲除鼠的基因分型通过成熟EdnrB+/-小鼠自交产生EdnrB-/-纯合子小鼠,待新生小鼠3周龄时剪取2 cm鼠尾置于1.5 mL无酶EP管中,提取鼠尾脱氧核糖核酸,通过特定引物组判定基因型。根据赛业生物科技公司提供信息,野生型小鼠只有野生型等位基因(540 bp),EdnrB+/-小鼠既有野生型等位基因(540 bp),也有突变型等位基因(470 bp),而EdnrB-/-小鼠只有突变型等位基因(470 bp)。
五、造模方法将实验组与对照组SD大鼠用戊巴比妥钠麻醉后用胶带固定,腹部消毒备皮,于腹中线处作纵向切口(长度约1 cm),暴露远端结肠,将远端结肠游离提出后用浸泡过0.5%苯扎氯铵的灭菌纱布包裹40 min,随时观察并用注射器滴加0.5%的苯扎氯铵以保持纱布湿润,将纱布放置于橡胶条上,以保护其他组织不与苯扎氯铵接触。40 min后,用温热生理盐水彻底冲洗掉苯扎氯铵,将肠道复位后将伤口缝合。待大鼠完全苏醒后放回鼠笼继续喂养,观察大鼠一般情况及排便情况。在造模后第3周使用大肠杆菌按照每日1×109 CFU的剂量灌胃,造模后第4周经戊巴比妥钠麻醉后脱颈处死,留取所需组织标本。
六、肠道大体观察与标本留取将模型鼠用戊巴比妥钠麻醉后处死,沿腹正中线切开,观察实验组与对照组大鼠肠道大体形态,并按狭窄段和扩张段留取标本,留取的标本分为两份,一份用4%多聚甲醛固定后行H&E染色,另一份放置于-80°冰箱保存备用。
七、蛋白印迹法检测称取肠道组织20~50 mg,加入适量含有蛋白酶抑制剂的细胞组织快速裂解液进行低温研磨,研磨后于冰上裂解30 min,于冰水上超声裂解5 min后12 000 rpm离心15 min,吸取上清液,参照BCA试剂盒说明书进行蛋白定量,再加入适量蛋白上样缓冲液,金属浴100℃下加热10 min使蛋白充分变性。得到蛋白样本后进行电泳、转膜、封闭、洗膜、一抗孵育、洗膜、二抗孵育、再次洗膜后加入ECL显影液后在成像系统曝光,最后使用Image J软件分析条带灰度值,计算蛋白相对表达量。
八、统计学处理Western Blot灰度值分析使用Image J_v1.8.0,进行定量处理,实验数据采用Graphpad Prism 8.0进行统计学分析。服从正态分布和方差齐性的计量资料以x±s表示,多组间比较采用单因素方差分析,整体差异有统计学意义的基础上两两比较采用LSD-t检验;非正态分布的计量资料以M(Q1, Q3)表示,多组间比较采用Kruskal-Wallis H检验,整体差异有统计学意义的基础上两两比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
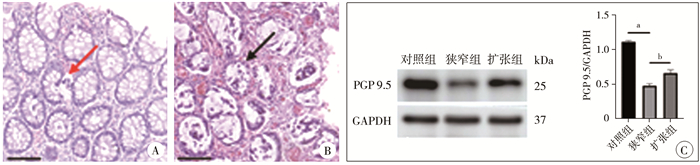
结果 一、HD患儿大体形态与病理变化HD患儿H&E染色可见中性粒细胞浸润隐窝上皮,少数患儿见隐窝炎形成(图 1A),患儿结肠段同一视野可见多个隐窝脓肿(图 1B)。与对照组比较,HAEC患儿狭窄肠段的神经元特异性蛋白标志物蛋白基因产物9.5(PGP 9.5)表达水平明显下降,差异有统计学意义(P<0.05,图 1C)。
|
图 1 先天性巨结肠患儿肠道特征 Fig.1 Intestinal characteristics of HD children 注 A:HD患儿结肠段组织H&E染色结果,红色箭头所示为隐窝炎(标尺为100 μm);B:HAEC患儿结肠段组织H&E染色结果,黑色箭头所示为多个隐窝脓肿(标尺为100 μm);C:蛋白印迹法检测神经元特异性标志蛋白PGP9.5表达水平及相对灰度值比较,a 表示P<0.001,b表示P<0.01 |
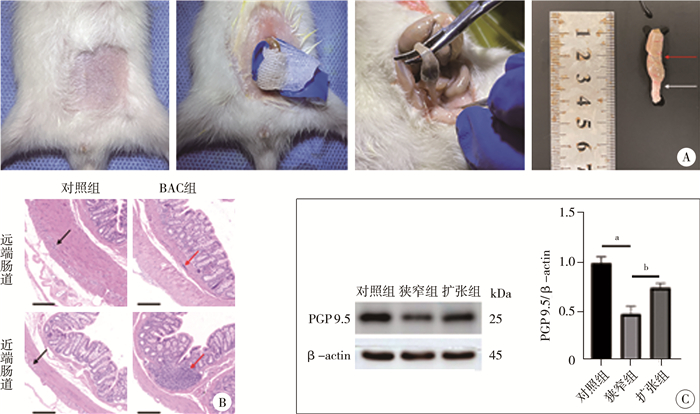
0.5 %苯扎氯铵(benzalkonium chloride,BAC)包裹后用大肠杆菌灌胃的实验组(BAC组)与温热生理盐水包裹后用温热生理盐水灌胃的对照组各12只,造模后3周可见实验组大鼠出现轻微腹胀,对照组大鼠无明显异常;两组大鼠食欲及精神状况均无明显改变。造模后第4周实验组大鼠腹部膨隆,活动减慢,精神状态有所改变,其中4只肛门处甚至可见粪便瘀滞,对照组大鼠无明显改变。取造模后4周大鼠肠道组织观察发现,经BAC处理者远端结肠狭窄明显,近端结肠明显扩张(图 2A)。对两组肠段分别行H&E染色显示,对照组肠段黏膜下及肌间神经丛内可见发育良好的神经节细胞团,而实验组大鼠狭窄段神经节细胞团明显缺如,实验组大鼠扩张肠段还可见大量炎症细胞浸润(图 2B)。与对照组大鼠相比,神经元特异性蛋白标志物PGP 9.5在实验组大鼠狭窄段的表达显著下降,差异有统计学意义(P<0.05,图 2C)。
|
图 2 苯扎氯铵包裹诱导大鼠模型的建立与鉴定 Fig.2 Establishment and identification of benzalkonium chloride enema-induced model 注 A:苯扎氯铵包裹手术过程及术后肠道的解剖观,白色箭头所示为动物模型肠道的狭窄段,红色箭头所示为动物模型肠道的扩张段;B:两组大鼠术后4周肠道组织H&E染色结果(标尺为200 μm),黑色箭头所示为对照组神经节细胞团,红色箭头所示为BAC组炎症细胞聚集;C:蛋白印迹法检测神经元特异性标志蛋白PGP 9.5表达水平及相对灰度值比较,a 表示P<0.01,b 表示P<0.05,n=12;BAC:苯扎氯铵包裹诱导大鼠 |
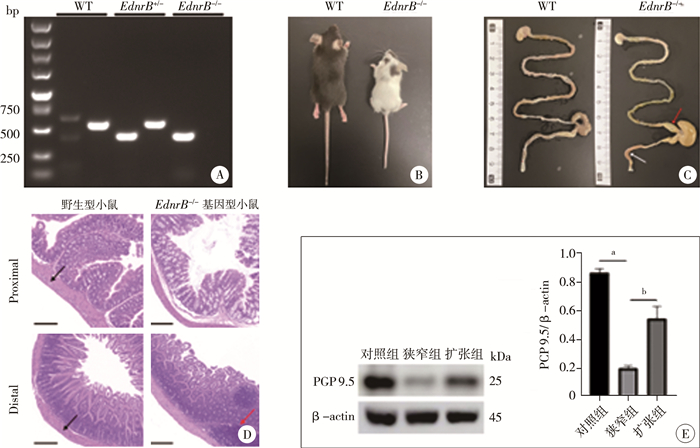
通过基因型和表型将EdnrB-/-小鼠与同窝野生型小鼠区分,野生型小鼠和EdnrB杂合子小鼠以及EdnrB纯合子小鼠的基因型鉴定结果如图 3A所示。随机选取5只EdnrB纯合子小鼠作为实验组,5只同日龄野生型小鼠作为对照组。肉眼观EdnrB-/-小鼠全身毛色为白色,可见少量散在黑色斑点(图 3B)。EdnrB-/-小鼠生长发育较迟缓,精神状态变差,行动缓慢,腹部日益膨隆。同窝EdnrB+/-小鼠或EdnrB+/+小鼠则与无基因背景的C57BL/6J小鼠无异。
|
图 3 EdnrB-/-小鼠的成模鉴定 Fig.3 Model-forming identification of EdnrB-/- mice 注 A:小鼠基因型鉴定结果;B:EdnrB-/-基因型小鼠肉眼观特征;C:EdnrB-/-基因型小鼠的解剖观特征,白色箭头所示为肠道狭窄段,红色箭头所示为肠道扩张段;D:EdnrB-/-基因型小鼠和WT小鼠肠道组织H&E染色结果(标尺为200 μm);黑色箭头所示为对照组神经节细胞团,红色箭头所示为实验组炎症细胞聚集;E:蛋白印迹法检测神经元特异性标志蛋白PGP 9.5表达水平及相对灰度值比较,a 表示P<0.001,b 表示P<0.01 |
解剖可见远端结肠和直肠段狭窄,大量干结粪便淤积,回肠段以及盲肠段明显扩张,还可见肠腔少量积气(图 3C)。H&E染色发现,与21日龄野生型小鼠肠道相比,21日龄EdnrB-/-小鼠狭窄段神经节细胞团明显缺如,扩张段可见大量炎症细胞浸润(图 3D)。与同日龄野生型小鼠相比,神经元特异性蛋白标志物PGP 9.5在21日龄EdnrB-/-小鼠狭窄段的表达明显下降,差异有统计学意义(P<0.05,图 3E)。
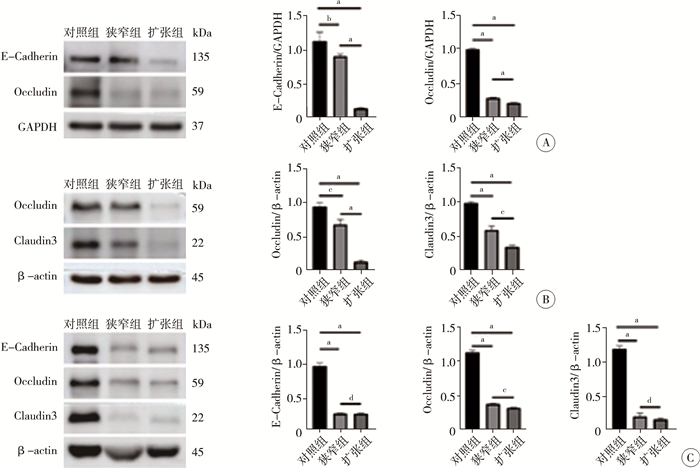
四、肠道屏障功能破坏Western blot检测各组肠道屏障相关蛋白显示,HAEC患儿扩张肠段E-Cadherin蛋白相对表达量为0.15±0.01,低于对照组肠段的1.13±0.08(t=12.940,P<0.001);Occludin蛋白相对表达量为0.21±0.01,低于对照组肠段的0.99±0.01(t=95.030,P<0.001)(图 4A)。苯扎氯铵包裹诱导模型扩张肠段Occludin蛋白相对表达量为0.14±0.01,低于对照组肠段的0.94±0.04(t=12.020,P<0.001);Claudin3蛋白相对表达量为0.34±0.01,低于对照组肠段的0.99±0.01(t=38.240,P<0.001)(图 4B)。EdnrB-/-小鼠模型扩张肠段E-Cadherin蛋白相对表达量为0.28±0.01,低于对照组肠段的0.97±0.03(t=25.360,P<0.001);Occludin蛋白相对表达量为0.32±0.01,低于对照组肠段的1.13±0.02(t=43.710,P<0.001),Claudin3蛋白相对表达量为0.17±0.01,低于对照组肠段的1.19±0.03(t=36.960,P<0.001)(图 4C);以上差异均有统计学意义。
|
图 4 各组模型鼠肠道屏障功能障碍情况 Fig.4 Intestinal barrier dysfunction status in each group 注 A:蛋白印迹法检测先天性巨结肠相关小肠结肠炎患儿肠道屏障标志蛋白E-Cadherin和Occludin表达及相对灰度值的比较(对照组n= 9,狭窄组/扩张组n=16);B:蛋白印迹法检测苯扎氯铵包裹诱导法模型大鼠肠道屏障标志蛋白Occludin和Claudin3表达及相对灰度值的比较(n=12);C:蛋白印迹法检测EdnrB-/-小鼠肠道屏障标志蛋白E-Cadherin、Occludin和Claudin3表达及相对灰度值的比较(n=5),a 表示P<0.001,b 表示P<0.05,c 表示P<0.01,d 表示差异无统计学意义 |
目前已有多种可靠的HD动物模型用于先天性巨结肠的研究,但关于HAEC动物模型的建立方法尚未统一,较为常见的是苯扎氯铵包裹外加大肠杆菌灌胃的化学诱导动物模型或EdnrB基因敲除后的自发性动物模型[7-8]。本研究将两种动物模型与HD患儿的肠道形态以及病理变化进行比较,两种动物模型均出现了精神萎靡、食欲下降、腹部日益膨隆等表现,与HAEC患儿的临床表现相符。解剖后可见远端肠段狭窄,近端肠段明显扩张,H&E染色可见大量炎症细胞浸润。相较而言,EdnrB基因敲除后自发性动物模型的狭窄肠段和扩张肠段形态变化较为典型,扩张肠段可见少量积气,与HAEC患儿肠道形态变化更为贴近。
HD的主要病理变化是神经嵴细胞迁移、增殖或分化异常,导致远端消化道神经节细胞缺如,蛋白基因产物9.5(PGP 9.5)是神经元特异性标志物,可用于特异性标记神经元细胞及神经纤维,是研究肠道神经节细胞发育的可靠指标之一[9-10]。本研究结果显示,与对照组相比,神经元特异性标志物PGP 9.5在两种动物模型的狭窄肠段中均明显下调,与临床HD患儿狭窄肠段PGP 9.5蛋白表达变化趋势一致。H&E染色也发现两种造模方法狭窄肠段神经节细胞明显缺如,与对照组相比,扩张段还可见大量炎症细胞浸润,两种动物模型的病理及神经元特异性标志蛋白变化均与HAEC患儿一致。
目前研究表明,肠道屏障功能改变与HAEC的发病密切相关[11]。肠道上皮层的紧密连接蛋白表达减少,导致肠黏膜通透性增加,使得细菌和毒素更容易穿过肠壁进入血液,引发局部或全身炎症反应[4]。HD患儿肠道蠕动功能缺失,肠内微生物过度生长、炎症因子浓度增加,导致结肠上皮通透性增加,同时损害肠蠕动功能[12]。由肠道屏障功能缺陷引发的炎症反应不仅加重肠道损伤,还可能触发或加剧HAEC的病理进程[3]。对短节段HD新生儿肠道样本的研究发现,术后出现HAEC的患儿较未出现HAEC的患儿肠上皮屏障通透性明显增加,进一步表明肠道屏障功能异常与HAEC密切相关[13]。本研究中,肠道屏障相关蛋白表达水平在两种常用动物模型的狭窄肠段和扩张肠段均明显下降,且扩张段肠道屏障相关蛋白表达水平下降更为显著,提示HAEC患儿扩张段肠管屏障功能受损更严重。这一模式与HAEC患儿扩张段和狭窄段肠道屏障相关蛋白的变化一致,说明两种动物模型较好地模仿了肠道屏障缺陷在HAEC发病中的作用。
肠道菌群失调在HAEC的发生和发展中起到重要作用。保护性菌群数量减少和致病菌数量增加,都会导致肠道屏障功能受损,增加肠道黏膜的通透性,使细菌及其代谢产物更易穿透肠壁进入血液,触发局部和全身的炎症反应[14-15]。本研究用苯扎氯铵包裹肠道后用大肠杆菌灌胃,成功构建HAEC的大鼠模型,提示大肠杆菌诱导或加速了HAEC的病理过程,也间接证实了肠道菌群失调在HAEC发病中的作用。
综上所述,苯扎氯铵包裹后采用大肠杆菌灌胃的化学诱导模型或EdnrB基因敲除后的自发性动物模型都能作为HAEC的动物模型应用于HAEC病因与发病机制的相关研究[7-8]。但苯扎氯铵包裹后采用大肠杆菌灌胃的化学诱导模型,不能很好地模拟HAEC的自然发生过程;EdnrB基因敲除后的自发性动物模型成本较高,喂养较为困难,前期无法获得大批量小鼠用于实验[16];而EdnrB-/-小鼠作为与先天性巨结肠发病机制相关的基因敲除小鼠,其自然发生的小肠结肠炎更符合HAEC患儿的发病过程,后期大量繁殖后可解决饲养困难的问题,用于HAEC病因与发病机制的研究结论将更具有说服力。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 王婷婷、徐铃琪、龚元、李娜、杨献、周慧婷负责文献检索、论文设计、数据收集、论文的撰写以及研究结果的分析与讨论;黄顺根负责论文设计、论文的审核与校对
| [1] |
Tam PKH, Chung PHY, St Peter SD, et al. Advances in paediatric gastroenterology[J]. Lancet, 2017, 390(10099): 1072-1082. DOI:10.1016/S0140-6736(17)32284-5 |
| [2] |
Sergi C. Hirschsprung's disease: historical notes and pathological diagnosis on the occasion of the 100th anniversary of Dr. Harald Hirschsprung's death[J]. World J Clin Pediatr, 2015, 4(4): 120-125. DOI:10.5409/wjcp.v4.i4.120 |
| [3] |
Li S, Zhang YC, Li K, et al. Update on the pathogenesis of the Hirschsprung-associated enterocolitis[J]. Int J Mol Sci, 2023, 24(5): 4602. DOI:10.3390/ijms24054602 |
| [4] |
Arnaud AP, Hascoet J, Berneau P, et al. A piglet model of iatrogenic rectosigmoid hypoganglionosis reveals the impact of the enteric nervous system on gut barrier function and microbiota postnatal development[J]. J Pediatr Surg, 2021, 56(2): 337-345. DOI:10.1016/j.jpedsurg.2020.06.018 |
| [5] |
傅润熹, 王阳, 蔡威. DLL3基因遗传多态性与先天性巨结肠易感性的相关性分析[J]. 临床小儿外科杂志, 2023, 22(4): 351-355. Fu RX, Wang Y, Cai W. Association study of delta-ligand 3(DLL3) gene polymorphism with Hirschsprung's disease susceptibility[J]. J Clin Ped Sur, 2023, 22(4): 351-355. DOI:10.3760/cma.j.cn101785-202203030-010 |
| [6] |
Teitelbaum DH, Caniano DA, Qualman SJ. The pathophysiology of Hirschsprung's-associated enterocolitis: importance of histologic correlates[J]. J Pediatr Surg, 1989, 24(12): 1271-1277. DOI:10.1016/s0022-3468(89)80566-4 |
| [7] |
郑泽兵, 高明娟, 汤成艳, 等. 先天性巨结肠小肠结肠炎模型的建立及鉴定[J]. 中华小儿外科杂志, 2019, 40(7): 644-649. Zheng ZB, Gao MJ, Tang CY, et al. Identification and establishment of Sprague-Dawlay rat model with experimental Hirschsprung's-associated enterocolitis[J]. Chin J Pediatr Surg, 2019, 40(7): 644-649. DOI:10.3760/cma.j.issn.0253-3006.2019.07.014 |
| [8] |
Chen XY, Meng XY, Zhang HY, et al. Intestinal proinflammatory macrophages induce a phenotypic switch in interstitial cells of Cajal[J]. J Clin Invest, 2020, 130(12): 6443-6456. DOI:10.1172/JCI126584 |
| [9] |
Jiao CL, Chen XY, Feng JX. Novel insights into the pathogenesis of Hirschsprung's-associated enterocolitis[J]. Chin Med J (Engl), 2016, 129(12): 1491-1497. DOI:10.4103/0366-6999.183433 |
| [10] |
Chi SQ, Fang MJ, Li K, et al. Diagnosis of Hirschsprung's disease by immunostaining rectal suction biopsies for calretinin, S100 protein and protein gene product 9.5[J]. J Vis Exp, 2019, 146: e58799. DOI:10.3791/58799 |
| [11] |
Nakamura H, Tomuschat C, Coyle D, et al. Altered goblet cell function in Hirschsprung's disease[J]. Pediatr Surg Int, 2018, 34(2): 121-128. DOI:10.1007/s00383-017-4178-0 |
| [12] |
王建峰, 朱慧, 陈杰. 肠道间质细胞参与调控结肠动力的研究进展[J]. 临床小儿外科杂志, 2022, 21(12): 1191-1196. Wang JF, Zhu H, Chen J. Recent research advances in gastrointestinal interstitial cells regulating colonic motility[J]. J Clin Ped Sur, 2022, 21(12): 1191-1196. DOI:10.3760/cma.j.cn101785-202010023-017 |
| [13] |
Dariel A, Grynberg L, Auger M, et al. Analysis of enteric nervous system and intestinal epithelial barrier to predict complications in Hirschsprung's disease[J]. Sci Rep, 2020, 10(1): 21725. DOI:10.1038/s41598-020-78340-z |
| [14] |
Li YQ, Poroyko V, Yan ZL, et al. Characterization of intestinal microbiomes of Hirschsprung's disease patients with or without enterocolitis using Illumina-MiSeq high-throughput sequencing[J]. PLoS One, 2016, 11(9): e0162079. DOI:10.1371/journal.pone.0162079 |
| [15] |
Pierre JF, Barlow-Anacker AJ, Erickson CS, et al. Intestinal dysbiosis and bacterial enteroinvasion in a murine model of Hirschsprung's disease[J]. J Pediatr Surg, 2014, 49(8): 1242-1251. DOI:10.1016/j.jpedsurg.2014.01.060 |
| [16] |
Bondurand N, Southard-Smith EM. Mouse models of Hirschsprung disease and other developmental disorders of the enteric nervous system: old and new players[J]. Dev Biol, 2016, 417(2): 139-157. DOI:10.1016/j.ydbio.2016.06.042 |
 2024, Vol. 23
2024, Vol. 23


