肝母细胞瘤(hepatoblastoma, HB)是儿童最常见的肝脏恶性肿瘤,多见于5岁以下儿童,占3岁以下肝脏原发恶性肿瘤的85%~90%[1]。外科手术切除是HB治疗中不可或缺的一部分,肿瘤病灶是否完全切除,是影响患儿预后的关键因素。HB患儿的总体生存率已由20世纪70年代的30%提高至目前的80%左右[2]。但合并远处转移、血清甲胎蛋白(alpha fetoprotein, AFP)低水平表达以及肝内多发瘤灶等,会显著降低HB患儿的生存率[3]。其中多灶性HB作为一种特殊类型,在手术时机及手术方式的选择上存在一定争议,且缺乏大样本病例报道,具有深入研究的价值[4-5]。本研究回顾性分析首都医科大学附属北京儿童医院收治的21例多灶性HB患儿临床资料、治疗及预后情况,结合相关文献复习,探究手术切除治疗多灶性HB的可行性与有效性。
材料与方法 一、临床资料本研究中多灶性HB患儿纳入标准:①满足国际儿童肝脏肿瘤合作组(International Society of Pediatric Oncology Epithelial Liver Tumor Study Group, SIOPEL)关于多灶性HB的定义,即:病理诊断证实为HB,且初次诊断时经影像学评估,肝内有两个以上瘤灶,瘤灶间有正常肝组织分隔[6];②在本院完成初次手术治疗。排除标准:未在本院接受初次手术治疗。根据上述标准,本研究共纳入2014年4月至2022年12月笔者收治的21例多灶性HB患儿,其中男14例,女7例;中位发病年龄28.0(19.0, 27.5)个月;初诊时腹部增强CT检查结果均符合多灶性HB定义。
为了对多灶性HB的治疗效果进行对比评估,本研究纳入同时期于本院手术治疗的58例中高危单灶性HB患儿,与多灶性HB患儿进行分组对比。本研究经首都医科大学附属北京儿童医院医学伦理委员会审核批准(2023-E-134-R),患儿家属均知情并签署知情同意书。
二、研究方法 (一) 肿瘤危险度分层与分组对比依据参照欧洲国际儿童肝脏肿瘤合作组(International Society of Pediatric Oncology Epithelial Liver Tumor Study Group, SIOPEL)制定的PRETEXT (PRE-Treatment EXTent of tumour)分期系统及POSTTEXT(POST-Treatment EXTent of tumour)分期系统对入组患儿进行治疗前后分期评估。根据儿童肝脏肿瘤国际合作组(Children’s Hepatic Tumors International Collaboration, CHIC)危险度分层标准,多灶性HB均划分至中危及高危组[3]。为了评估其治疗效果,保证研究的可靠性,本次回顾性研究将多灶性HB与中高危单灶性HB患儿进行分组对比。
(二) 多灶性HB综合治疗策略术前根据多灶性HB患儿的危险度分组,参考SIOPEL或北美儿童肿瘤协作组(Children’s Oncology Group, COG)推荐的化疗方案实施新辅助化疗。基于实体瘤治疗评估标准(response evaluation criteria in solid tumors, RECIST)1.1版本,对本研究患儿术前化疗效果进行评价,具体见表 1[7]。在患儿经过新辅助化疗具备手术切除指征后,根据肿瘤位置及临近肝组织情况选取以下手术方式:肿瘤病灶局限在一个或者多个相邻近的肝叶或肝段内,且肝叶(段)内残余正常肝脏组织较少,或者保留后无法保证良好血供时,选择实施解剖性肝切除;当肿瘤病灶分散在不同肝叶或肝段,中间隔有正常肝叶(段),同时瘤灶所在肝段内有较多可以保留的肝组织时,考虑实施不规则肝切除或肿瘤剜除术。本组1例患儿(病例14)因瘤灶范围广泛,术前评估切除后残余肝组织体积过少,肝功能储备不足,经多学科讨论后为患儿实施了联合肝脏离断及门静脉结扎的分次肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)。手术切除后共有20例患儿接受了辅助化疗,疗程数5(4,6)个。
| 表 1 21例多灶性HB患儿临床特征及手术情况 Table 1 Clinical characteristics and surgical findings of 21 multifocal hepatoblastoma children |
|
|
对于纳入本研究的多灶性HB及单灶性中高危HB患儿,分别观察其临床特征、影像学相关危险因素、手术中情况,远期预后等指标,并进行分组对比。
(四) 随访方法本研究根据儿童HB多学科诊疗专家共识(CCCG-HB-2016)推荐方案[8],通过门诊、电话和网络的形式对患儿进行随访,随访日期截至2023年3月1日。
(五) 观察指标对于本研究中患者,分别观察无事件生存率(event-free survival, EFS)、总生存率(overall survival, OS)和局部进展累积发生率(cumulative incidence of local progression, CILP)。上述指标开始时间定义为诊断时间,EFS事件定义为肿瘤进展、复发或发生治疗相关并发症导致死亡,OS事件定义为任何原因导致的死亡,CILP事件定义为局部复发和(或)进展的发生。我们同时观察了围手术期并发症发生情况,依据Clavien-Dindo标准对并发症进行分级,具体定义见表 3[9]。
| 表 3 Clavien-Dindo手术并发症评价标准 Table 3 Clavien-Dindo classification of surgical complications |
|
|
文献检索方法:利用PubMed、Cochrane Library数据库,设置检索词为“multifocal hepatoblastoma”,检索截至2022年12月所有关于多灶性HB的英文文献。删除重复报告及重要信息缺失的文献,共获得14篇相关文献,其中涉及肝移植方式治疗多灶性HB的文献3篇。
三、统计学处理采用SPSS 26.0和R 4.1.3版本对数据进行分析和处理,P<0.05为差异具有统计学意义。使用具有95%置信区间(confidence interval, CI)的Kaplan-Meier曲线估计OS和EFS,组间差异检验采用Log-Rank法,使用反向Kaplan-Meier法估计中位随访时间。使用Gray-Fine检验和Gray模型,将CILP与死亡作为竞争事件进行评估。
结果 一、多灶性HB患儿临床特征、新辅助化疗效果及预后情况本组21例多灶性HB患儿初诊时AFP均升高,中位数为77 226.44 ng/mL,范围为537.4~1 383 896 ng/mL。PRETEXT分期Ⅱ期11例,Ⅲ期5例,Ⅳ期5例。5例在诊断时出现远处转移,转移部位均为肺部。其余临床特征见表 1。在术前接受新辅助化疗的19例患儿中,10例化疗后瘤灶数量较前减少,其中5例初诊时瘤灶全肝散发、无法计数的患儿,在新辅助化疗后瘤灶数量较化疗前显著减少。接受新辅助化疗患儿的POSTTEXT分期与PRETEXT分期比较,5例在新辅助化疗后降期。本研究中位随访时间为57个月(95%CI:48~72)。21例患儿中有8例(8/21,38.1%)术后复发,其中5例(5/8,62.5%)复发部位在残肝,1例(1/8,12.5%)复发部位在肺部,1例(1/8,12.5%)复发部位在残肝及骨。截至本研究末次随访日期,18例无瘤生存,3例因肿瘤复发死亡。21例多灶性HB患儿3年EFS为57.58%(95%CI:39.00%~84.99%),3年OS为82.00%(95%CI:66.00%~100.00%),3年CILP为38.00%(95%CI:12.00%~56.00%),见图 1。
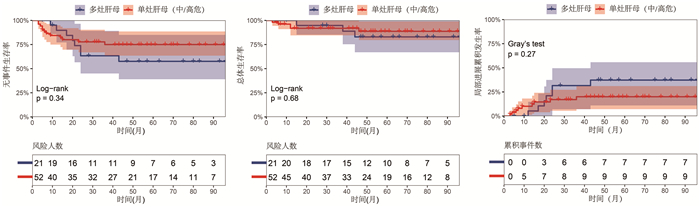
|
图 1 多灶性肝母细胞瘤与中高危单灶性肝母细胞瘤患儿生存曲线图及总体生存率、无事件生存率和局部进展累积发生率比较 Fig.1 Comparison of survival curves, overall survival rates, event-free survival rates and cumulative incidence of local progression between children with multifocal hepatoblastoma and those with unifocal hepatoblastoma at intermediate-to-high risk |
21例患儿具体手术情况见表 1。术后均出现谷丙转氨酶及谷草转氨酶一过性升高,19例术后白蛋白降低,予保肝、补充血浆及白蛋白等处理后,于术后3~7 d内均恢复至正常水平。行ALPPS手术患儿于第一、二期手术之间出现白蛋白降低合并大量腹水,每日约1 100 mL,予补液、成分输血、白蛋白输注等治疗后缓解,二期手术切除肿瘤后,病情平稳,恢复顺利。1例术后出现肠套叠,行开腹探查+手法复位;1例术后出现胆漏,经保守治疗19 d后痊愈;1例术后出现胆漏合并肠套叠,予开腹手法及漏口缝合修补。并发症分级为Ⅱ级19例(90.48%),Ⅲ级2例(9.52%),无一例Ⅰ、Ⅳ、Ⅴ级患儿(表 1)。
三、多灶性HB与中高危单灶性HB患儿临床特点与治疗效果对比将多灶性HB患儿的临床特点、治疗方式及预后与本中心同期中高危单灶性HB患儿比较发现,多灶性HB患儿更易出现血管侵犯(66.67%比26.92%,P=0.001),手术所需时间也显著增加(300 min比257 min,P=0.002)。但在远期预后方面,两组EFS、OS和CILP无显著差异,多灶性肝母细胞瘤患儿可以获得与中高危单灶性肝母细胞瘤相近的长期治疗效果,见表 2。
| 表 2 多灶性HB与中高危单灶性HB患儿临床特征及手术情况对比 Table 2 Comparison of clinical characteristics and surgical findings between children with multifocal HB and median-to-high-risk unifocal HB |
|
|
多灶性HB作为一种特殊类型的HB,被认为是HB患儿预后的一个危险因素,但截止目前,国内外尚缺乏大宗病例报道,对其手术治疗方式仍未完全统一。本研究中,多灶性HB占同时期收治病例总数的15.1%,低于既往文献报道的20%[10],其原因可能是本中心为三级转诊单位,且尚未开展肝移植手术所致。完全切除和联合化疗能够提高HB患儿的生存率。采用以顺铂为基础的新辅助化疗方案能够明显缩小肿瘤灶的体积,使部分初诊时不具备手术条件的病例获得手术机会[11-12]。本研究中约有68.4%的多灶性HB患儿经新辅助化疗后瘤灶数量减少,尤其是5例初诊时瘤灶分散弥漫的患儿在新辅助化疗后瘤灶数量减少至1个或2个,而部分瘤灶数量未减少的病例,其肿瘤体积也显著缩小,这些新辅助化疗后的有效反应都为后续实施肿瘤切除手术创造了有利条件。
对于多灶性HB的手术治疗方式是选择肝移植还是肝切除术,目前仍存在不同看法。既往有文献报道由于多灶性HB的弥漫浸润生长方式可能带来潜在的肝内微小病灶残留风险,手术切除后残肝复发率高,且挽救性肝移植(即初始行部分肝切除术后复发的肝移植)的生存率较差,主张对多灶性HB患儿行全肝切除及肝移植[13-14]。根据美国器官共享系统(United Network for Organ Sharing, UNOS)数据显示:接受肝移植的肝脏恶性肿瘤患儿5年生存率达75%左右[15]。然而,利用肝移植方式治疗HB同样存在风险,包括器官可用性有限、远处复发风险以及终身免疫抑制剂的需求和伴随疾病的风险[16]。本研究显示,多灶性HB在术前实施规范新辅助化疗,手术尽可能做到切缘阴性的前提下,5年OS可达到82.00%。同时,近年来陆续有文献报道,在接受新辅助化疗的患儿中,即使术后切缘存在镜下残留,也不会对患儿的整体预后产生不利影响,体现了术后化疗对于可能残存的微小病灶的清除作用[17]。由此,我们认为,基于新辅助化疗的肝脏切除术,可以改善多灶性HB患儿的长期预后。由于本中心尚未开展肝移植工作,对于PRETEXT Ⅳ期、化疗后仍未能有效降低分期,或仍侵犯主要大血管,不具备手术切除可能的患儿,我们通常推荐其至已开展儿童肝移植的医疗机构就诊并评估肝移植指征。故有关肝移植治疗多灶性HB的效果,我们主要依据相关文献检索得到。在所检索到的3篇报道采用化疗及肝移植方式治疗多灶性HB的文献中,Neto等[18]报道了1例患儿接受化疗及肝移植后,随访9个月无瘤生存;Héry等[19]报道了12例多灶性HB患儿,其3年OS约66.7%;Otte等[20]报道了6例多灶性HB患儿,10年OS约为85%。本中心通过手术及化疗等多学科联合治疗多灶性HB的5年EFS、OS分别为57.58%和82.00%,与上述文献报道比较并无明显差异。
此外,本研究结果显示,多灶性HB更易侵犯肝内主要血管,且由于数量较多,需要术者在手术过程中正确选择术式, 并需要根据瘤灶与肝内血管、胆道等重要结构的实际关系,将解剖性肝切除与不规则肝切除或肿瘤剜除术有机结合,这些因素都造成肿瘤切除手术的难度增加,以及对术者技巧与经验的要求提高。术中需要根据肿瘤所累及位置,沿门静脉、肝静脉等重要解剖标志性结构游离分割,注意并处理与切除肝段相对应的门静脉、肝静脉、肝动脉主要分支血管,完整切除全部瘤灶所在的一个或多个肝段。当需要实施不规则肝切除时,应采用由浅入深的方法,沿瘤灶与肝组织之间界限切除。对于供应瘤灶的细小血管,我们使用微波刀等辅助设备,烧灼固化后,直接切断;对于直径5 mm以上的血管,采取切断后结扎或缝扎处理。手术过程总体遵循肿瘤切除与创面止血同时进行的原则,将出血量控制在最小限度,逐一将肝脏内多个肿瘤病灶完全切除,保留临近正常肝组织。当遇到多发瘤灶侵犯左右肝交界部或尾状叶区域时,要求术者首先对手术切除范围有清晰规划,明确实施手术方式,如肝叶不规则切除、中肝叶切除、扩大半肝切除等。其次在手术过程中精细操作,避免损伤拟保留肝叶(段)主要血管或胆道而导致残肝血运或胆汁引流出现问题。对于肝中静脉的三条分支以及引流入腔静脉的肝短静脉,应当予以识别,尽量避免误伤造成大出血甚至肝脏组织不必要的过度切除。本研究对部分病例术中采用了多普勒超声或ICG荧光导航的辅助手段识别瘤灶边界及与周围重要结构的毗邻关系等,这些病例手术后病理报告均为R0切除,肝内未见残留,随访至今未见复发,也验证了上述辅助技术对多灶性HB手术切除安全性及准确性的保障作用[21]。关于本组多灶性HB的术后并发症,可以从研究结果中看到,其原因主要为手术打击以及切除部分肝组织后一过性肝功能不全,导致相应症状。出现肠套叠、胆漏的患儿,可能为病灶分布较为广泛,侵犯多个肝叶,甚至跨越左右半肝,手术复杂,术中打击大等因素所致。
既往相关研究机构的报道显示,多灶性HB患儿在病情完全缓解、治疗结束后会出现疾病复发,复发部位以残留的肝脏和肺部为多见。复发患儿可通过化疗和第二次手术切除实现完全缓解[4, 22]。由于多灶性HB属于中高危HB,预后风险较高,且其手术与单灶性HB相比,治疗过程往往更复杂,但根据本研究中与两组患者的对比结果,在手术完整切除及规范化综合治疗的前提下,多灶性HB在局部复发和远期生存方面,均与单灶性HB无明显差异。这一研究结果也为探究多灶性HB患儿除肝移植以外的其他有效治疗方式,提供了参考与借鉴。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 杨维、刘珊、杨深、冯俊、韩建宇负责文献检索;王焕民、杨维负责论文设计;杨维、刘珊、任清华、秦红、成海燕、常晓峰、朱志云负责数据收集与分析;杨维负责论文结果撰写和讨论分析;王焕民负责对文章知识性内容进行审阅
| [1] |
Lim ⅡP, Bondoc AJ, Geller JI, et al. Hepatoblastoma-the evolution of biology, surgery, and transplantation[J]. Children (Basel), 2018, 6(1): 1. DOI:10.3390/children6010001 |
| [2] |
Feng JC, Polychronidis G, Heger U, et al. Incidence trends and survival prediction of hepatoblastoma in children: a population-based study[J]. Cancer Commun (Lond), 2019, 39(1): 62. DOI:10.1186/s40880-019-0411-7 |
| [3] |
Czauderna P, Haeberle B, Hiyama E, et al. The children's hepatic tumors international collaboration (CHIC): novel global rare tumor database yields new prognostic factors in hepatoblastoma and becomes a research model[J]. Eur J Cancer, 2016, 52: 92-101. DOI:10.1016/j.ejca.2015.09.023 |
| [4] |
Semeraro M, Branchereau S, Maibach R, et al. Relapses in hepatoblastoma patients: clinical characteristics and outcome-experience of the International Childhood Liver Tumour Strategy Group (SIOPEL)[J]. Eur J Cancer, 2013, 49(4): 915-922. DOI:10.1016/j.ejca.2012.10.003 |
| [5] |
Fonseca A, Gupta A, Shaikh F, et al. Extreme hepatic resections for the treatment of advanced hepatoblastoma: Are planned close margins an acceptable approach?[J]. Pediatr Blood Cancer, 2018, 65(2): 26820. DOI:10.1002/pbc.26820 |
| [6] |
Dall'Igna P, Cecchetto G, Toffolutti T, et al. Multifocal hepatoblastoma: is there a place for partial hepatectomy?[J]. Med Pediatr Oncol, 2003, 40(2): 113-117. DOI:10.1002/mpo.10107 |
| [7] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [8] |
中国抗癌协会小儿肿瘤专业委员会, 中华医学会小儿外科分会肿瘤专业组. 儿童肝母细胞瘤多学科诊疗专家共识(CCCG-HB-2016)[J]. 中华小儿外科杂志, 2017, 38(10): 733-739. Pediatric Oncology Specialty Committee of Chinese Anti-Cancer Association, Pediatric Oncology Specialty Group, Branch of Pediatric Surgery, Chinese Medical Association. Expert Consensus on Multidisciplinary Management of Hepatoblastoma (CCCG-HB-2016)[J]. Chin J Pediatr Surg, 2017, 38(10): 733-739. DOI:10.3760/cma.j.issn.0253-3006.2017.10.003 |
| [9] |
Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg, 2004, 240(2): 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [10] |
Wiederkehr JC, Avilla SG, Mattos E, et al. Associating liver partition with portal vein ligation and staged hepatectomy (ALPPS) for the treatment of liver tumors in children[J]. J Pediatr Surg, 2015, 50(7): 1227-1231. DOI:10.1016/j.jpedsurg.2014.10.019 |
| [11] |
Czauderna P, Lopez-Terrada D, Hiyama E, et al. Hepatoblastoma state of the art: pathology, genetics, risk stratification, and chemotherapy[J]. Curr Opin Pediatr, 2014, 26(1): 19-28. DOI:10.1097/MOP.0000000000000046 |
| [12] |
杨维, 任清华, 秦红, 等. 儿童肝母细胞瘤精准肝切除手术效果评价[J]. 临床小儿外科杂志, 2020, 19(5): 392-397. Yang W, Ren QH, Qin H, et al. Evaluations of precise hepatectomy for pediatric hepatoblastoma[J]. J Clin Ped Sur, 2020, 19(5): 392-397. DOI:10.3969/j.issn.1671-6353.2020.05.004 |
| [13] |
Otte JB, Pritchard J, Aronson DC, et al. Liver transplantation for hepatoblastoma: results from the International Society of Pediatric Oncology (SIOP) study SIOPEL-1 and review of the world experience[J]. Pediatr Blood Cancer, 2004, 42(1): 74-83. DOI:10.1002/pbc.10376 |
| [14] |
Hou JY, Yeh TC, Huang TH, et al. A retrospective study of clinical features and outcome in patients with refractory or recurrent hepatoblastoma: a single institution experience[J]. Pediatr Neonatol, 2021, 62(4): 400-405. DOI:10.1016/j.pedneo.2021.03.018 |
| [15] |
Hamilton EC, Balogh J, Nguyen DT, et al. Liver transplantation for primary hepatic malignancies of childhood: the UNOS experience[J]. J Pediatr Surg, 2018, 53(1): 163-168. DOI:10.1016/j.jpedsurg.2017.10.035 |
| [16] |
Workman JK, Myrick CW, Meyers RL, et al. Pediatric organ donation and transplantation[J]. Pediatrics, 2013, 131(6): e1723-e1730. DOI:10.1542/peds.2012-3992 |
| [17] |
Younes A, Elgendy A, Fadel S, et al. Surgical resection of hepatoblastoma: factors affecting local recurrence[J]. Eur J Pediatr Surg, 2021, 31(5): 432-438. DOI:10.1055/s-0040-1717087 |
| [18] |
Neto JS, Fonseca EA, Cândido HL, et al. Alternatives for vascular reconstruction in pediatric living donor liver transplantation[J]. Pediatr Transplant, 2016, 20(5): 717-722. DOI:10.1111/petr.12720 |
| [19] |
Héry G, Franchi-Abella S, Habes D, et al. Initial liver transplantation for unresectable hepatoblastoma after chemotherapy[J]. Pediatr Blood Cancer, 2011, 57(7): 1270-1275. DOI:10.1002/pbc.23301 |
| [20] |
Otte JB, de Ville de Goyet J, Reding R. Liver transplantation for hepatoblastoma: indications and contraindications in the modern era[J]. Pediatr Transplant, 2005, 9(5): 557-565. DOI:10.1111/j.1399-3046.2005.00354.x |
| [21] |
施佳, 程千千, 武志祥, 等. 吲哚菁绿近红外荧光显像在儿童肝母细胞瘤手术中的应用初探[J]. 临床小儿外科杂志, 2021, 20(10): 916-920. Shi J, Cheng QQ, Wu ZX, et al. Application of near-infrared indocyanine green fluorescent imaging during surgery of childhood hepatoblastoma[J]. J Clin Ped Sur, 2021, 20(10): 916-920. DOI:10.12260/lcxewkzz.2021.10.004 |
| [22] |
Angelico R, Grimaldi C, Gazia C, et al. How do synchronous lung metastases influence the surgical management of children with hepatoblastoma? An update and systematic review of the literature[J]. Cancers (Basel), 2019, 11(11): 1693. DOI:10.3390/cancers11111693 |
 2024, Vol. 23
2024, Vol. 23


