小儿肾积水多由先天性肾盂输尿管连接处梗阻引起,病变常位于左侧,是儿童泌尿生殖系统常见疾病,通常以患侧肾脏分肾功能(differential renal function, DRF)的变化作为肾脏损害的指标[1-2]。目前肾积水以影像学检查、尿常规检查及肾功能检查为主。多数情况下肾积水患儿无明显症状,但长时间肾积水可导致肾内压增加,肾盂和肾盏进行性扩张,甚至肾实质萎缩[3]。因此,寻找与DRF相关的生物标志物尤为重要。富亮氨酸α2-糖蛋白1(leucine-rich α2 glycoprotein 1, LRG1)是一种多功能致病信号因子,在感染、心血管与肾脏疾病以及自身免疫性疾病中高度表达,由促炎细胞因子合成,是一种急性期蛋白,在受到微生物感染和其他炎症刺激后,血清中LRG1水平迅速增加[4]。而中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin, NGAL)是中性粒细胞的一种分泌蛋白,由肾脏大量表达并释放到尿液和血液中,肾小管上皮受损后2 h内NGAL水平明显升高,是肾损伤的早期敏感生物标志物[5]。过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α, PGC-1α)是线粒体生物合成的主要调节因子,可通过翻译后修饰或转录增加来激活,也可与其他核因子相互作用,从而调节线粒体内外参与细胞能量代谢的多种途径,在慢性肾脏疾病中低表达,与肾小球滤过率呈正相关,与纤维化程度呈负相关[6]。目前关于LRG1、NGAL、PGC-1α与术后DRF关系的研究鲜有报道,本研究通过小儿肾积水术后血清LRG1、NGAL、PGC-1α水平检测,分析其与DRF的相关性,为小儿肾积水的临床诊治提供新的参考。
资料与方法 一、研究对象本研究为回顾性研究。选取邯郸市中心医院2019年3月至2022年6月期间行肾盂输尿管成形术的124例肾积水患儿作为研究对象,男92例,女32例,年龄7~32(18.65±5.32)个月。将45%≤DRF≤55%定义为肾功能正常[7]。根据术后18个月DRF将患儿分为DRF≥45%组(n=72)和DRF<45%组(n=52)。DRF≥45%组中,男58例,女14例,年龄5~27(18.60±4.78)个月;DRF<45%组中,男34例,女18例,年龄9~32(18.72±5.23)个月,两组患儿性别、年龄比较,差异无统计学意义(P>0.05)。本研究经邯郸市中心医院伦理委员会审核批准(2022-07102),患儿家长均知情并签署知情同意书。
二、病例纳入与排除标准纳入标准:①经手术证实为肾积水;②单侧肾积水;③临床资料完整。排除标准:①泌尿系统重复畸形;②合并其他肾脏疾病;③双侧肾积水;④存在膀胱输尿管反流;⑤有凝血功能障碍;⑥肾发育不全;⑦有泌尿系统炎症或其他全身系统炎症。
三、主要试剂与仪器仪器:多功能酶标仪(杭州奥盛仪器有限公司,型号:Feyond-A300);LRG1(上海晶杭生物工程有限公司,货号:JLC-5703)、NGAL(上海江莱生物科技有限公司,货号:JL20063)、PGC-1α(上海江莱生物科技有限公司,货号:JL19450)试剂盒。
四、研究方法采集肾积水患儿术后第2天清晨空腹静脉血3 mL,室温下静置30 min,于4℃下5 000 r/min离心10 min后取血清,置于-80℃保存待检测。收集肾积水患儿临床资料,包括性别、年龄、术前患侧DRF、术后DRF、术前患侧肾皮质厚度、术前肾脏长径比、术前肾脏横径比、术前肾盂前后径、术前患侧肾盏大小、手术部位(左或右)及肾功能指标[血清肌酐(serum creatinine,Scr)、内生肌酐清除率(endogenous creatinine clearance rate, Ccr)、血尿素氮(blood urea nitrogen, BUN)、肾小球滤过率(estimated glomerular filtration rate, GFR)、β2-微球蛋白(β2-microglobulin, β2-MG)等]。血清LRG1、NGAL、PGC-1α水平检测采用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测。通过肾核素显像检查患儿手术前后DRF。
五、统计学处理采用SPSS 25.0进行统计学处理。计数资料以例数(n)表示,组间比较采取χ2检验;服从正态分布的计量资料以x±s表示,组间比较采取两独立样本t检验。采用Pearson相关性分析血清LRG1、NGAL、PGC-1α水平与肾功能的相关性;采用二元Logistic回归分析肾积水患儿术后DRF<45%的影响因素。通过受试者工作特征(receiver operating characteristic, ROC)曲线分析血清LRG1、NGAL、PGC-1α对肾积水患儿术后DRF<45%的预测价值,R OC曲线下面积(area under the curve, AUC)的比较采用Z检验。P<0.05为差异具有统计学意义。
结果与DRF≥45%组相比,DRF<45%组患儿血清LRG1、NGAL水平升高,PGC-1α水平降低,差异均具有统计学意义(P<0.05)。见表 1。
| 表 1 两组肾积水患儿血清LRG1、NGAL、PGC-1α水平的比较(ng/mL, x±s) Table 1 Comparison of serum levels of LRG1, NGAL and PGC-1α between two groups of children with hydronephrosis (ng/mL, x±s) |
|
|
与DRF≥45%组相比,DRF<45%组患儿术前患侧DRF、术后DRF较低,Scr、BUN及β2-MG水平较高,差异均有统计学意义(P<0.05),其余指标(性别、年龄、术前患侧肾皮质厚度、术前长径比、术前横径比、术前肾盂前后径、术前患侧肾盏大小、手术部位、Ccr、GFR)比较,差异均无统计学意义(P>0.05)。见表 2。
| 表 2 两组肾积水患儿临床资料比较 Table 2 Comparison of general profiles of children with hydronephrosis in two groups |
|
|
经Pearson相关性分析显示,LRG1、NGAL水平与β2-MG、Scr、BUN水平呈正相关(P<0.05);PGC-1α水平与β2-MG、Scr、BUN水平呈负相关(P<0.05)。见表 3。
| 表 3 肾积水患儿血清LRG1、NGAL、PGC-1α水平与肾功能的相关性 Table 3 Correlation between serum levels of LRG1, NGAL and PGC-1α and renal function in children with hydronephrosis |
|
|
以肾积水患儿DRF值作为因变量,将血清LRG1、NGAL、PGC-1α、Scr、术前患侧DRF、BUN及β2-MG(实测值)作为自变量进行Logistic回归分析,结果显示,血清LRG1、NGAL、Scr、BUN、β2-MG、PGC-1α、术前患侧DRF是术后DRF<45%的影响因素(P<0.05)。见表 4。
| 表 4 肾积水患儿术后DRF<45%的影响因素Logistic回归分析 Table 4 Multifactorial Logistic regression analysis affecting postoperative DRF < 45% in children with hydronephrosis |
|
|
以DRF情况作为因变量,以血清LRG1、NGAL、PGC-1α水平(实测值)作为检验变量,并采用二元Logistic回归模型将三项指标预测概率转化得到联合预测概率,同时将预测概率也作为检验变量绘制ROC曲线。血清LRG1评估肾积水患儿术后DRF<45%的AUC为0.899(95%CI:0.831~0.945),灵敏度和特异度分别为76.92%、95.83%,最佳截断值为246.72 ng/mL;血清NGAL评估肾积水患儿术后DRF<45%的AUC为0.872(95%CI:0.800~0.925),灵敏度和特异度分别为63.46%、94.44%,最佳截断值为247.25 ng/mL;血清PGC-1α评估肾积水患儿术后DRF<45%的AUC为0.878(95%CI:0.807~0.930),灵敏度和特异度分别为67.31%、94.44%,最佳截断值为3.37 ng/mL;血清LRG1、NGAL、PGC-1α联合预测肾积水患儿术后DRF<45%的AUC为0.982(95%CI:0.940~0.997),灵敏度和特异度分别为96.15%、93.06%,三者联合评估肾积水患儿术后DRF<45%的AUC显著高于血清LRG1、NGAL、PGC-1α单独评估,差异均有统计学意义(Z三者联合-LRG1=3.148、Z三者联合-NGAL=3.937、Z三者联合-PGC-1α=3.125,均P<0.05)。见图 1。
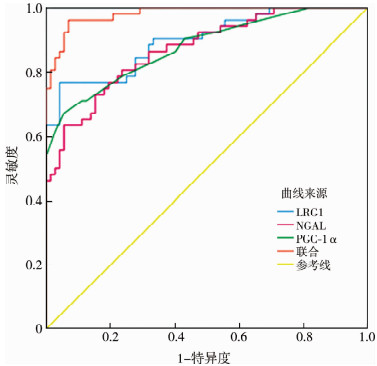
|
图 1 血清LRG1、NGAL、PGC-1α水平对肾积水患儿术后DRF<45%预测价值的ROC曲线 Fig.1 Values of serum levels of LRG1, NGAL and PGC-1α in assessing postoperative DRF in children with hydronephrosis 注 LRG1:血清富亮氨酸α2-糖蛋白1;NGAL:中性粒细胞明胶酶相关载脂蛋白;PGC-1α为过氧化物酶体增殖物激活受体γ辅助激活因子-1α;ROC:受试者工作特征 |
随着产前检查技术的提高,肾积水的诊断率逐年升高。由于早期或轻度积水时无明显症状,大部分患儿被诊断时已处于晚期,主要表现为腹痛、泌尿系统感染及血尿等症状,严重影响患儿预后[8]。目前手术是治疗肾积水和防止肾功能进行性恶化的有效措施,而术后客观、准确地分析血清标志物与DRF的关系,对于评估DRF尤为重要。本研究中,DRF≥45%组和DRF<45%组患儿术前患侧肾皮质厚度、术前长径比、术前横径比、术前肾盂前后径、术前患侧肾盏大小差异无统计学意义,可能是因为上述因素不是影响患儿术后DRF的因素。有研究发现,当一侧肾脏受损或发生积水时,健康的对侧肾脏可初步通过增加滤过率和调整肾小管功能来弥补受损肾脏的功能,从而保持整体的肾功能[10]。本研究发现,与DRF≥45%组相比,DRF<45%组患儿术前患侧Scr、BUN水平升高,可能是由于DRF的不同,患侧肾脏功能和代偿功能差异较明显,因而导致Scr、BUN水平有差异。
相关研究表明,LRG1对内皮细胞有促有丝分裂的作用,还可促进血管生成,在慢性肾病患者肾组织和血清中表达显著上调,其水平随炎症因子刺激而升高,提示LRG1可能通过促进炎症和血管生成及促进促纤维化细胞因子的分泌来加剧肾纤维化[9]。本研究结果显示,DRF<45%组患儿血清LRG1水平升高,提示LRG1水平升高可能与术后DRF相关。经Pearson相关性分析发现,LRG1水平与β2-MG、Scr、BUN呈正相关,这与Popova等[11]的研究结果一致,高水平的血清LRG1与肾损伤和肾功能恶化相关,可作为肾移植患者肾小管功能障碍的生物标志物。此外,本研究Logistic回归分析显示,LRG1是影响患儿术后DRF<45%的因素,提示LRG1与DRF密切相关,与Hong等[12]研究结果相符。LRG1主要定位于肾小球内皮细胞,其表达在糖尿病肾病中明显升高,与肾功能恶化相关,是糖尿病肾小球血管形成的一种潜在的新的致病因素,也是导致糖尿病肾病进展的一个危险因素。另外,ROC曲线结果显示,LRG1对肾积水患儿术后DRF<45%的评估具有一定价值。
Gavrilovici等[13]研究表明,NGAL在膀胱输尿管反流患儿血清中明显升高,并与疾病严重程度相关,可以作为反流性肾病及其进展为慢性肾病的准确、可靠的生物标志物。本研究结果显示,DRF<45%组患儿血清NGAL水平升高,表明NGAL影响DRF。经Pearson相关性研究发现,NGAL与β2-MG、Scr、BUN呈正相关,提示血清NGAL水平异常升高可能通过影响β2-MG、Scr、BUN而参与DRF<45%的发生。有研究报道,在尿路梗阻患者血清和尿液中NGAL水平显著升高,且较Scr更敏感、更及时,提示NGAL可以检测尿梗阻的复发或进展,可作为评价肾功能的潜在生物标志物[14]。Logistic回归分析结果显示,NGAL是影响术后DRF<45%的因素。同时,ROC曲线分析发现,NGAL评估肾积水患儿术后DRF<45%的AUC为0.872,表明NGAL可以作为评估DRF的辅助指标。
PGC-1α是一种转录辅激活因子,在调节线粒体生物合成、过氧化物酶体生物合成以及葡萄糖和脂质代谢中起主要作用,该系统的激活可以预防各种肾脏疾病所致的肾功能障碍[15]。本研究结果显示,DRF<45%组患儿血清PGC-1α水平降低,表明PGC-1α与DRF有关。经Pearson相关性分析发现,PGC-1α与β2-MG、Scr、BUN呈负相关,与李晶等[16]研究结果相符,提示PGC-1α水平与肾积水患儿肾功能相关性较高。Logistic回归分析结果显示,PGC-1α是DRF<45%的影响因素,提示血清PGC-1α水平异常降低,可能促进DRF<45%的发生。当临床中检测到患儿术后血清LRG1大于246.72 ng/mL、NGAL大于247.25 ng/mL、PGC-1α小于3.37 ng/mL时,需密切关注患儿肾功能情况,及时调整治疗方案,改善患儿预后。
综上所述,术后DRF<45%的肾积水患儿血清LRG1、NGAL水平升高,且与β2-MG、Scr、BUN水平呈正相关;PGC-1α水平降低,与β2-MG、Scr、BUN水平呈负相关,三者均是影响DRF<45%的因素,联合三者进行评估对于肾积水患儿术后DRF的预测价值较高。但本研究尚有不足之处,尚未分析LRG1、NGAL、PGC-1α影响DRF的机制,后续我们将继续增加样本量,收集患者术前血清及术后动态血清,进一步探讨三种指标与术后DRF的关系,并深入分析三者联合影响DRF的机制,为LRG1、NGAL、PGC-1α作为评估DRF的生物学指标提供更充分的理论依据。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 李静涛负责文献检索,荣雪静负责论文设计,魏建新负责数据收集,高宇光负责研究结果分析与讨论,马新生、李静涛负责论文撰写,李静涛、荣雪静负责全文知识性内容的审读与修正
| [1] |
Zhang LL, Xu HY, Feng YK, et al. Outcome of renal function after laparoscopic pyeloplasty in children with high-grade hydronephrosis[J]. Urol Int, 2023, 107(7): 666-671. DOI:10.1159/000529032 |
| [2] |
李小瑜, 郭云飞, 黄立渠. 分肾功能低于10%肾积水的治疗决策及影响因素研究进展[J]. 临床小儿外科杂志, 2021, 20(12): 1183-1188. Li XY, Guo YF, Huang LQ. Treatment strategies and influencing factors of hydronephrosis with split renal function < 10%[J]. J Clin Ped Sur, 2021, 20(12): 1183-1188. DOI:10.12260/lcxewkzz.2021.12.016 |
| [3] |
Mao WP, Liu SH, Wang KY, et al. Cystatin C in evaluating renal function in ureteral calculi hydronephrosis in adults[J]. Kidney Blood Press Res, 2020, 45(1): 109-121. DOI:10.1159/000504441 |
| [4] |
Camilli C, Hoeh AE, De Rossi G, et al. LRG1:an emerging player in disease pathogenesis[J]. J Biomed Sci, 2022, 29(1): 6. DOI:10.1186/s12929-022-00790-6 |
| [5] |
Marakala V. Neutrophil gelatinase-associated lipocalin (NGAL) in kidney injury-a systematic review[J]. Clin Chim Acta, 2022, 536: 135-141. DOI:10.1016/j.cca.2022.08.029 |
| [6] |
Fontecha-Barriuso M, Martin-Sanchez D, Martinez-Moreno JM, et al. The role of PGC-1α and mitochondrial biogenesis in kidney diseases[J]. Biomolecules, 2020, 10(2): 347-354. DOI:10.3390/biom10020347 |
| [7] |
Aktaş GE, Sarıkaya A. Correction of differential renal function for asymmetric renal area ratio in unilateral hydronephrosis[J]. Ann Nucl Med, 2015, 29(9): 816-824. DOI:10.1007/s12149-015-1009-z |
| [8] |
Väelä S, Omling E, Börjesson A, et al. Resolution of hydronephrosis after pyeloplasty in children[J]. J Pediatr Urol, 2021, 17(1): 102.e1-102.e7. DOI:10.1016/j.jpurol.2020.10.031 |
| [9] |
Liu TT, Luo R, Yang Y, et al. LRG1 mitigates renal interstitial fibrosis through alleviating capillary rarefaction and inhibiting inflammatory and pro-fibrotic cytokines[J]. Am J Nephrol, 2021, 52(3): 228-238. DOI:10.1159/000514167 |
| [10] |
李亚男, 张遵城, 董华. 99Tcm-DTPA肾动态显像对单侧肾积水患者健侧肾代偿功能的研究[J]. 国际放射医学核医学杂志, 2020, 44(11): 691-696. Li YN, Zhang ZC, Dong H. Study of 99Tcm-DTPA renal dynamic imaging on the compensatory capacity of contralateral kidney in patients with unilateral hydronephrosis[J]. Int J Radiat Med Nucl Med, 2020, 44(11): 691-696. |
| [11] |
Popova A, Vasilvolfa A, Rācenis K, et al. Leucine-rich alpha-2-glycoprotein (LRG-1) as a potential kidney injury marker in kidney transplant recipients[J]. Ann Transplant, 2022, 27(1): 936751-936762. DOI:10.12659/AOT.936751 |
| [12] |
Hong Q, Zhang L, Fu J, et al. LRG1 promotes diabetic kidney disease progression by enhancing TGF-β-Induced angiogenesis[J]. J Am Soc Nephrol, 2019, 30(4): 546-562. DOI:10.1681/ASN.2018060599 |
| [13] |
Gavrilovici C, Dusa CP, Iliescu Halitchi C, et al. The role of urinary NGAL in the management of primary vesicoureteral reflux in children[J]. Int J Mol Sci, 2023, 24(9): 7904. DOI:10.3390/ijms24097904 |
| [14] |
Brewin A, Sriprasad S, Somani B. The use of neutrophil gelatinase-associated lipocalin (NGAL) as a diagnostic and prognostic biomarker in urinary tract obstruction: a systematic review[J]. Curr Urol Rep, 2022, 23(8): 155-163. DOI:10.1007/s11934-022-01098-6 |
| [15] |
Lee G, Uddin MJ, Kim Y, et al. PGC-1α, a potential therapeutic target against kidney aging[J]. Aging Cell, 2019, 18(5): e12994. DOI:10.1111/acel.12994 |
| [16] |
李晶, 陆芹芹, 崔艳飞. 血清PGC-1α水平在脓毒症致急性肾损伤诊断中的价值[J]. 实用医学杂志, 2023, 39(4): 471-475. Li J, Lu QQ, Cui YF. Early diagnostic value of serum level of PGC-1α for secondary acute kidney injury in septic patients[J]. J Pract Med, 2023, 39(4): 471-475. DOI:10.3969/j.issn.1006-5725.2023.04.015 |
 2024, Vol. 23
2024, Vol. 23


