2. 中南大学湘雅医学院附属儿童医院 湖南省儿童医院麻醉手术科,长沙 410007
2. Department of Anesthesiology, Affiliated Children's Hospital, Xiangya School of Medicine, Central South University (Hunan Children's Hospital), Changsha 410007, China
肺组织损伤在临床中很常见,根据疾病的发生发展可大致分为慢性肺损伤和急性肺损伤。肺与许多肺外器官之间具有复杂的相互串扰作用,而炎症相关因素在慢性和急性肺损伤的发生发展中扮演着重要角色[1-2]。多项研究显示核苷酸结合寡聚结构域(nucleotide binding oligomerization domain,NOD)样受体蛋白3(NOD-like receptor pyrin domain-containing protein 3,NLRP3)炎性小体在肺组织损伤中起重要作用[3]。NLRP3炎性小体是一种由NLRP3、接头蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、半胱天冬酶-1前体(pro-cysteinyl aspartate specific proteinase-1, PRO-CASPASE-1)组成的高分子蛋白复合物。组成的细胞内高分子蛋白复合物被激活可导致细胞焦亡,引起炎症因子白细胞介素-1β(interleukin-1 beta,IL-1β)、白细胞介素-18(interleukin-18, IL-18)的释放以及其他炎症介质的释放,在肺部炎症反应中发挥重要作用[4]。虽然适当的激活NLRP3炎性小体对肺损伤有一定的好处,但过度的激活则会增加肺部炎症反应、氧化应激和细胞焦亡的发生,诱发肺部炎症级联反应,最终可能加重肺组织损伤和肺功能障碍。通过靶向NLRP3炎性小体或其上下游信号分子,对肺组织炎症性损伤具有治疗潜力。本综述旨在全面回顾近年来有关NLRP3炎性小体在慢性肺损伤以及急性肺损伤中的研究进展,通过对这些研究进展的综合分析,为临床治疗肺组织损伤提供更有效的治疗策略。
一、NLRP3炎性小体NLRP3炎性小体是一种位于细胞内的高分子蛋白复合物,能响应内源性危险信号和损伤刺激因子,是呼吸道免疫系统的重要组成部分,由NLRP3、ASC和PRO-CASPASE-1组成[5-6]。NLRP3是一种胞质蛋白,具有吡喃结构域(pyrin domain,PYD)、核苷酸结合寡聚化结构域(nucleotide binding and oligomerization domain,NACHT)以及富含亮氨酸重复结构域(leucine-rich repeat,LRR),其中PYD结构域可以与ASC的PYD结构域同源结合,促进其自身组装[7]。此外,ASC的半胱天冬酶募集结构域(caspase activation and recruitment domain,CARD)能与PRO-CASPASE-1的CARD结构域结合,形成类似桥梁的相互作用。在正常生理条件下,NLRP3的表达水平不足以激活NLRP3炎性小体。然而,当机体受到感染、组织损伤、代谢紊乱或细胞应激等刺激时,NLRP3炎性小体被激活,引发炎症反应[8]。NLRP3炎性小体的激活包括两个步骤(图 1):第一步是模式识别受体对病原相关分子模式(pathogen-associated molecular patterns, PAMPs)或危险相关分子模式(danger-associated molecular patterns, DAMPs)(如细菌、病毒等)的识别,从而激活核转录因子-κB(nuclear factor kappa-B,NF-κB)信号通路,推动NLRP3、ASC和PRO-IL-1β的转录和翻译,进而诱导NLRP3炎性小体的组装。第二步是通过细胞应激,如细胞损伤、氧化应激、离子通道紊乱和病原体感染等多种刺激,诱导NLRP3的寡聚化和ASC的招募,以形成NLRP3炎性小体复合物。上述复合物能够激活PRO-CASPASE-1,使其裂解为具有活性的CASPASE-1,转而切割Gasdermin D(GSDMD),使N端GSDMD(GSDMD-N)在细胞膜上形成孔道(GSDMD pore),导致细胞肿胀、破裂以及IL-1β和IL-18的成熟和释放,从而引发炎症反应[9]。炎症因子的活化在炎症过程起着关键作用,会促进炎症介质的产生与释放以及炎症细胞的聚集,进一步加剧炎症反应。
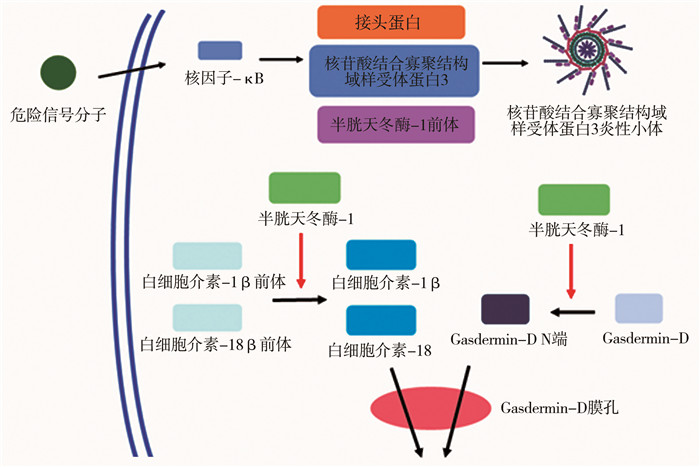
|
图 1 NLRP3炎性小体信号通路示意图 Fig.1 Schematic diagram of NLRP3 inflammasome signaling pathway 注 NLRP3:核苷酸结合寡聚结构域样受体蛋白3 |
常见的慢性肺损伤包括慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)、哮喘、支气管肺发育不良以及肺纤维化等。慢性肺损伤是一种长期存在并逐渐发展的肺部疾病,其特点是肺组织的结构和功能持续性损伤,导致呼吸功能受限和氧合能力下降。慢性肺损伤患者不仅增加了医疗资源的压力,对家庭造成负担,甚至影响了患者自身的生存质量以及心理健康[10]。慢性肺损伤的发生和发展与长期存在的肺部炎症密切相关,其中由NLRP3炎性小体调节的多种细胞因子在肺部炎症调节中起重要作用[11]。肺部炎症会过度激活NLRP3炎性小体,从而加剧肺组织的氧化应激和细胞损伤。同时,NLRP3炎性小体也会反过来促进炎症反应和组织损伤,形成恶性循环。
(一) NLRP3炎性小体与COPDCOPD为一种常见的慢性炎症性肺部疾病,其特征为不可逆呼吸道气流持续性受限和慢性炎症[12]。目前,COPD仍然是一种无法治愈的慢性肺部疾病,COPD的加重会影响患者的生活质量以及心理健康。目前研究显示,炎症相关因素在COPD的疾病进展中起重要作用,而NLRP3炎性小体与COPD慢性气道炎症密切相关[13]。虽然适当激活NLRP3不仅可以通过调节炎症介质的平衡和炎症细胞的功能来减轻炎症反应,而且还能促进细胞增殖、基质合成和血管新生等修复机制,但NLRP3的过度激活则会加重COPD的疾病进展。
持续性气道炎症可使黏液分泌过多和胶原异常沉积,导致气道重塑的发生[14]。在临床中发现稳定期COPD患者的肺组织和呼吸道上皮细胞中IL-1β、NLRP3和CASPASE-1基因表达增加[15]。Wu等[16]研究发现,通过调节COPD模型小鼠NLRP3炎性小体抑制细胞焦亡,可以改善COPD模型小鼠的肺组织炎症性损伤以及肺功能。通过阻断或抑制NLRP3炎性小体可观察到COPD的肺损伤明显改善,提示NLRP3可作为COPD治疗的潜在靶点。
(二) NLRP3炎性小体与哮喘哮喘是一种慢性气道炎症性疾病,其特征为可逆性气道阻塞和反复发作的呼吸困难。哮喘是儿童最常见的慢性疾病,且发病率持续上升。哮喘患者的气道呈现慢性炎症反应,其中包括炎症细胞聚集和炎症介质释放[10]。这些炎症细胞和介质导致气道壁肿胀、黏液分泌过多和气道平滑肌收缩,从而导致气道狭窄和阻塞[17]。炎性小体活化可以调节细胞增殖和组织修复,然而过度激活会导致过度炎症、组织损伤,并导致慢性炎症。NLRP3炎性小体的过度活化会使caspase-1切割Pro-IL-1β和Pro-IL-18为活化的IL-1β和IL-18,进一步加剧气道炎症、气道高反应性以及气道重塑。Ma等[18]发现在哮喘动物模型中NLRP3炎性小体被激活,并进一步促进肺部炎症和病理损伤。利用NLRP3炎性小体抑制剂可以缓解气道中嗜酸性粒细胞、中性粒细胞和淋巴细胞浸润,缓解杯状细胞增生,使小鼠血清IgE降低,支气管肺泡灌洗液中炎症因子水平降低,证实了抑制NLRP3炎性小体可以缓解哮喘的炎症反应。Xu等[19]研究发现哮喘小鼠肺组织中NLRP3炎性小体相关蛋白的表达上调,黏液分泌增加,气道阻力增加;而抑制NLRP3炎性小体的激活可以抑制气道炎症并减少炎性细胞因子的产生[19]。这表明通过阻断或抑制NLRP3炎性小体激活可以减轻哮喘的气道炎症以及临床症状。因此,NLRP3炎性小体可能成为临床治疗哮喘的潜在靶点。
(三) NLRP3炎性小体与支气管肺发育不良支气管肺发育不良(bronchopulmonary dysplasia, BPD)是早产儿的一种慢性肺部疾病。23周龄出生的婴儿中,BPD的总体发病率约为78%,其肺部发育明显受损,造成持续性气道和肺血管疾病,导致患者肺功能障碍[20]。根据既往研究报道,BPD的发生发展与高浓度氧气、机械通气、感染、氧化应激损伤和肺部炎症等因素有关[21]。其中,NLRP3炎性小体的过度激活在BPD疾病的发生发展过程中的作用值得关注。NLRP3炎性小体可以引起细胞焦亡以及炎性因子的大量释放,诱发下游炎症级联反应。Wang等[22]发现,在暴露于85%氧气的BPD模型中,NLRP3炎性小体可以被激活,并在肺组织炎症和肺泡形成中起关键作用,因此推测NLRP3炎性小体参与了BPD的发病过程。Wang等[23]发现,在BPD小鼠模型中激活核因子红细胞系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)可以抑制NLRP3炎症小体,显著减少了BPD小鼠肺组织中的异常细胞死亡,并恢复了肺泡的数量和正常结构。因此,NLRP3炎性小体有望成为未来治疗BPD的新靶点。
(四) NLRP3炎性小体与肺纤维化肺纤维化是一种慢性、进行性的肺损伤疾病,其特征是肺组织中纤维结缔组织的异常增生和沉积,导致肺功能受损和组织结构的破坏[24]。在肺纤维化中,正常的肺组织逐渐被疤痕组织所取代,导致肺部弹性减低以及呼吸功能下降。研究表明, NLRP3炎性小体的过度激活在肺纤维化的发展过程中起重要作用,NLRP3炎性小体可以引起细胞焦亡以及炎性细胞因子的大量释放,从而引发过度炎症反应和组织损伤[25]。NLRP3炎性小体激活导致炎症因子IL-1β的释放,导致肺间质的炎症细胞浸润和肺泡上皮细胞损伤,并且IL-1β会刺激转化生长因子-β(transforming growth factor-β,TGF-β1)的合成,促进成纤维细胞的增殖和胶原沉积[25]。在博来霉素诱导的小鼠肺纤维化模型中,肺组织中大量炎症细胞浸润,肺组织结构紊乱并伴随严重的胶原沉积,肺组织中NLRP3炎性小体相关蛋白以及炎症因子的表达显著增高,然而阻断NLRP3炎性小体后,肺组织胶原沉积减少,肺泡结构恢复,支气管肺泡灌洗液中炎症因子水平降低,炎症细胞明显减少,有效改善小鼠肺组织的炎症反应以及纤维化程度[26]。在二氧化硅诱导肺损伤模型中,发现二氧化硅可以激活肺上皮细胞中NLRP3炎性小体诱导焦亡的发生,使炎症因子大量释放,并且可以导致气道上皮表面纤毛塌陷、粘液分泌过多、肺上皮细胞损伤以及肺纤维化,通过抑制NLRP3炎性小体,炎症因子的分泌明显减少,纤维化相关因子的沉积明显减少,证实了通过抑制NLRP3炎性小体可以缓解二氧化硅诱导的炎症反应以及肺纤维化[27]。因此,针对NLRP3炎性小体进行干预可以缓解肺组织的炎症反应以及胶原沉积,进而减轻肺纤维化程度。
三、NLRP3炎性小体与急性肺损伤急性肺损伤是一种由多种损伤因素引起,以肺内皮和上皮屏障功能障碍、弥漫性肺间质和肺泡水肿,通气/血流比例失调和低氧血症为主要表现的临床综合征[28]。急性肺损伤通常由直接或间接的感染、组织器官损伤等刺激引起肺组织过度炎症性损伤,其死亡率极高[29]。尽管目前有很多关于治疗急性肺损伤的研究,但临床中仍以适当抗菌、机械通气、皮质类固醇等治疗为主,尚无有效的策略来应对急性肺损伤[30]。急性肺损伤的发生发展与炎症密切相关[31]。肺内或肺外的感染会引发炎症反应来应对机体的损伤,然而中性粒细胞过度活化可导致肺泡-毛细血管屏障的通透性增加,炎症因子和炎症细胞在肺组织蓄积,触发机体炎症级联反应,导致肺组织损伤,甚至多器官功能障碍[32]。多种刺激因子(如细菌感染、病毒感染)都可以激活NLRP3炎性小体,虽然短时间内适当激活NLRP3炎性小体可以增强机体免疫应答和病原体清除能力,有助于应对急性肺损伤中感染和炎症的短期挑战,但是NLRP3炎性小体过度激活则可能触发机体炎症级联反应,导致炎症细胞增多、炎症因子释放以及血管通透性增加,导致肺组织的损伤[33]。目前冠状病毒相关急性肺损伤(coronavirus associated acute respiratory distress syndrome, CARDS)的有效治疗方法有限,而靶向NLRP3炎性小体被认为是CARDS治疗的潜在策略[34]。在一项临床随机对照研究中,通过使用NLRP3炎性小体抑制剂治疗CARDS的患者,发现患者的临床状态和院内结局得到改善[35]。
术后肺损伤是特殊类型的急性肺损伤,即外科手术后出现的一系列与肺功能异常相关的并发症,涉及肺组织的结构和功能受损,包括氧合能力下降、肺容积减少、肺水肿等。术后肺损伤会直接影响患者的住院时间以及远期预后,其呼吸系统功能至少需要6周才可能恢复到术前状态。而婴幼儿的肺组织发育不全且肺功能低下,外科手术后更易诱发术后肺组织损伤,且病情通常较成人更为严重。围术期的多种因素都可能导致患者出现术后肺损伤,如手术操作、体外循环、单肺通气等[36]。手术部位、手术操作、手术时长以及患者体位都可能导致患者术后肺组织损伤;在体外循环期间,可能引起全身炎症反应综合征以及肺缺血-再灌注损伤,导致术后肺组织损伤;单肺通气时,肺组织塌陷-复张的过程可能诱发缺血再灌注损伤,进而导致术后肺部炎症。Luo等[37]研究中,发现肝移植大鼠模型的肺组织损伤严重,其肺组织IL-1β的水平以及肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)和白细胞介素-6(interleukin-6, IL-6)的水平明显增加,因此推测肝移植手术可以通过上调NLRP3炎性小体来增加肺组织炎症因子IL-1β的释放,进而导致术后肺组织损伤。Hou等[38]研究发现在体外循环大鼠模型中,其肺泡巨噬细胞NLRP3炎性小体相关蛋白的表达增加,高迁移率族蛋白B1(high mobility group box-1 protein, HMGB1)的释放增加,大鼠的肺组织病理学检查以及肺损伤评分提示体外循环大鼠诱发了术后肺组织损伤,然而通过抑制NLRP3炎性小体可以明显减弱肺泡巨噬细胞焦亡以及HMGB1的释放,并减轻大鼠的术后肺组织损伤。由此推测在大鼠体外循环期间,NLRP3炎性小体相关通路的激活会导致肺巨噬细胞焦亡以及HMGB1释放增加,进而引起炎症反应导致术后肺组织损伤。Sugasawa等[39]研究显示,单肺通气会引起炎症因子IL-1β水平的升高,进而导致术后肺组织炎症反应以及肺损伤,因此,推测NLRP3炎性小体在单肺通气-术后肺损伤中发挥重要作用,但需要进一步研究来证明。
综上所述,NLPR3炎性小体在许多急性肺损伤和慢性肺损伤疾病的发生发展中具有重要作用,其过度激活会导致肺部炎症级联反应,进而加重肺组织的损伤和功能障碍。目前,较多的研究报道了NLRP3炎性小体与多种呼吸系统疾病发生发展之间的关系。NLRP3炎性小体的激活与氧化应激、炎症介质释放以及炎症细胞的招募与活化密切相关;通过抑制或干预NLRP3炎性小体或其上下游信号分子可以减轻研究对象肺组织的炎症反应与组织损伤,对肺组织具有保护作用。因此,通过抑制NLRP3炎性小体的激活及其上下游信号分子,有望减轻临床中慢性与急性肺损伤的严重程度,改善患者预后,为制定更有效的临床治疗策略提供研究思路。
利益冲突 所有作者声明不存在利益冲突
| [1] |
Herrlich A. Interorgan crosstalk mechanisms in disease: the case of acute kidney injury-induced remote lung injury[J]. FEBS Lett, 2022, 596(5): 620-637. DOI:10.1002/1873-3468.14262 |
| [2] |
Wang ZH, Pu QQ, Huang CH, et al. Crosstalk between lung and extrapulmonary organs in infection and inflammation[J]. Adv Exp Med Biol, 2021, 1303: 333-350. DOI:10.1007/978-3-030-63046-1_18 |
| [3] |
Zhong WJ, Liu T, Yang HH, et al. TREM-1 governs NLRP3 inflammasome activation of macrophages by firing up glycolysis in acute lung injury[J]. Int J Biol Sci, 2023, 19(1): 242-257. DOI:10.7150/ijbs.77304 |
| [4] |
Coll RC, Schroder K, Pelegrín P. NLRP3 and pyroptosis blockers for treating inflammatory diseases[J]. Trends Pharmacol Sci, 2022, 43(8): 653-668. DOI:10.1016/j.tips.2022.04.003 |
| [5] |
Seoane PI, Lee B, Hoyle C, et al. The NLRP3-inflammasome as a sensor of organelle dysfunction[J]. J Cell Biol, 2020, 219(12): e202006194. DOI:10.1083/jcb.202006194 |
| [6] |
Swanson KV, Deng M, Ting JPY. The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nat Rev Immunol, 2019, 19(8): 477-489. DOI:10.1038/s41577-019-0165-0 |
| [7] |
Lee S, Suh GY, Ryter SW, et al. Regulation and function of the nucleotide binding domain leucine-rich repeat-containing receptor, pyrin domain-containing-3 inflammasome in lung disease[J]. Am J Respir Cell Mol Biol, 2016, 54(2): 151-160. DOI:10.1165/rcmb.2015-0231TR |
| [8] |
Zheng DP, Liwinski T, Elinav E. Inflammasome activation and regulation: toward a better understanding of complex mechanisms[J]. Cell Discov, 2020, 6(1): 36. DOI:10.1038/s41421-020-0167-x |
| [9] |
Lu FF, Lan ZX, Xin ZQ, et al. Emerging insights into molecular mechanisms underlying pyroptosis and functions of inflammasomes in diseases[J]. J Cell Physiol, 2020, 235(4): 3207-3221. DOI:10.1002/jcp.29268 |
| [10] |
Hoffman KW, Visoki E, Argabright ST, et al. Association between asthma and suicidality in 9-12-year-old youths[J]. Brain Sci, 2022, 12(12): 1602. DOI:10.3390/brainsci12121602 |
| [11] |
Leszczyńska K, Jakubczyk D, Górska S. The NLRP3 inflammasome as a new target in respiratory disorders treatment[J]. Front Immunol, 2022, 13: 1006654. DOI:10.3389/fimmu.2022.1006654 |
| [12] |
Hikichi M, Mizumura K, Maruoka S, et al. Pathogenesis of chronic obstructive pulmonary disease (COPD) induced by cigarette smoke[J]. J Thorac Dis, 2019, 11(Suppl 17): S2129-S2140. DOI:10.21037/jtd.2019.10.43 |
| [13] |
Guo P, Li R, Piao TH, et al. Pathological mechanism and targeted drugs of COPD[J]. Int J Chron Obstruct Pulmon Dis, 2022, 17: 1565-1575. DOI:10.2147/COPD.S366126 |
| [14] |
Liu G, Philp AM, Corte T, et al. Therapeutic targets in lung tissue remodelling and fibrosis[J]. Pharmacol Ther, 2021, 225: 107839. DOI:10.1016/j.pharmthera.2021.107839 |
| [15] |
Markelić I, Hlapčić I, Čeri A, et al. Activation of NLRP3 inflammasome in stable chronic obstructive pulmonary disease[J]. Sci Rep, 2022, 12(1): 7544. DOI:10.1038/s41598-022-11164-1 |
| [16] |
Wu D, Wang X, Gao Y, et al. Shenqi Wenfei Formula alleviates chronic obstructive pulmonary disease in rats with pulmonary qi deficiency syndrome by regulating NLRP3/GSDMD pyroptosis pathway[J]. J South Med Univ, 2023, 43(9): 1500-1508. DOI:10.12122/j.issn.1673-4254.2023.09.07 |
| [17] |
Wu YX, Di X, Zhao M, et al. The role of the NLRP3 inflammasome in chronic inflammation in asthma and chronic obstructive pulmonary disease[J]. Immun Inflamm Dis, 2022, 10(12): e750. DOI:10.1002/iid3.750 |
| [18] |
Ma M, Li GY, Qi MH, et al. Inhibition of the inflammasome activity of NLRP3 attenuates HDM-Induced allergic asthma[J]. Front Immunol, 2021, 12: 718779. DOI:10.3389/fimmu.2021.718779 |
| [19] |
Xu WJ, Wang YM, Ma Y, et al. MiR-223 plays a protecting role in neutrophilic asthmatic mice through the inhibition of NLRP3 inflammasome[J]. Respir Res, 2020, 21(1): 116. DOI:10.1186/s12931-020-01374-4 |
| [20] |
Kalikkot Thekkeveedu R, Guaman MC, Shivanna B. Bronchopulmonary dysplasia: a review of pathogenesis and pathophysiology[J]. Respir Med, 2017, 132: 170-177. DOI:10.1016/j.rmed.2017.10.014 |
| [21] |
Shukla VV, Ambalavanan N. Recent advances in bronchopulmonary dysplasia[J]. Indian J Pediatr, 2021, 88(7): 690-695. DOI:10.1007/s12098-021-03766-w |
| [22] |
Wang XY, Huo R, Liang ZJ, et al. Simvastatin inhibits NLRP3 inflammasome activation and ameliorates lung injury in hyperoxia-induced bronchopulmonary dysplasia via the KLF2-mediated mechanism[J]. Oxid Med Cell Longev, 2022, 2022: 8336070. DOI:10.1155/2022/8336070 |
| [23] |
Wang MR, Zhang F, Ning XM, et al. Regulating NLRP3 inflammasome-induced pyroptosis via Nrf2:TBHQ limits hyperoxia-induced lung injury in a mouse model of bronchopulmonary dysplasia[J]. Inflammation, 2023, 46(6): 2386-2401. DOI:10.1007/s10753-023-01885-4 |
| [24] |
Savin IA, Zenkova MA, Sen'kova AV. Pulmonary fibrosis as a result of acute lung inflammation: molecular mechanisms, relevant in vivo models, prognostic and therapeutic approaches[J]. Int J Mol Sci, 2022, 23(23): 14959. DOI:10.3390/ijms232314959 |
| [25] |
Cao W, Wang X, Li JL, et al. NLRP3 inflammasome activation determines the fibrogenic potential of PM2air pollution particles in the lung[J]. J Environ Sci (China), 2022, 111: 429-441. DOI:10.1016/j.jes.2021.04.021 |
| [26] |
Liu JJ, Fan GQ, Tao NN, et al. Ginsenoside Rb1 alleviates bleomycin-induced pulmonary inflammation and fibrosis by suppressing central nucleotide-binding oligomerization-, leucine-rich repeat-, and pyrin domains-containing protein three inflammasome activation and the NF-κB pathway[J]. Drug Des Devel Ther, 2022, 16: 1793-1809. DOI:10.2147/DDDT.S361748 |
| [27] |
Zhou H, Zhang Q, Huang W, et al. NLRP3 inflammasome mediates silica-induced lung epithelial injury and aberrant regeneration in lung stem/progenitor cell-derived organotypic models[J]. Int J Biol Sci, 2023, 19(6): 1875-1893. DOI:10.7150/ijbs.80605 |
| [28] |
Mokrá D. Acute lung injury-from pathophysiology to treatment[J]. Physiol Res, 2020, 69(Suppl 3): S353-S366. DOI:10.33549/physiolres.934602 |
| [29] |
Santa Cruz R, Villarejo F, Irrazabal C, et al. High versus low positive end-expiratory pressure (PEEP) levels for mechanically ventilated adult patients with acute lung injury and acute respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2021, 3(3): CD009098. DOI:10.1002/14651858.CD009098.pub3 |
| [30] |
Tomazini BM, Maia IS, Cavalcanti AB, et al. Effect of dexamethasone on days alive and ventilator-free in patients with moderate or severe acute respiratory distress syndrome and COVID-19:the CoDEX randomized clinical trial[J]. JAMA, 2020, 324(13): 1307-1316. DOI:10.1001/jama.2020.17021 |
| [31] |
Liu T, Zhou Y, Li P, et al. Blocking triggering receptor expressed on myeloid cells-1 attenuates lipopolysaccharide-induced acute lung injury via inhibiting NLRP3 inflammasome activation[J]. Sci Rep, 2016, 6: 39473. DOI:10.1038/srep39473 |
| [32] |
He YQ, Zhou CC, Yu LY, et al. Natural product derived phytochemicals in managing acute lung injury by multiple mechanisms[J]. Pharmacol Res, 2021, 163: 105224. DOI:10.1016/j.phrs.2020.105224 |
| [33] |
Cai DS, Zhao Y, Yu F. Puerarin ameliorates acute lung injury by modulating NLRP3 inflammasome-induced pyroptosis[J]. Cell Death Discov, 2022, 8(1): 368. DOI:10.1038/s41420-022-01137-8 |
| [34] |
He Q, Hu D, Zheng FQ, et al. Investigating the nexus of NLRP3 inflammasomes and COVID-19 pathogenesis: unraveling molecular triggers and therapeutic strategies[J]. Viruses, 2024, 16(2): 213. DOI:10.3390/v16020213 |
| [35] |
Madurka I, Vishnevsky A, Soriano JB, et al. DFV890:a new oral NLRP3 inhibitor-tested in an early phase 2a randomised clinical trial in patients with COVID-19 pneumonia and impaired respiratory function[J]. Infection, 2023, 51(3): 641-654. DOI:10.1007/s15010-022-01904-w |
| [36] |
上官雪娟, 屈双权. 儿童单肺通气研究进展[J]. 临床小儿外科杂志, 2023, 22(2): 188-191. Shangguan XJ, Qu SQ. Research advances of one-lung ventilation in children[J]. J Clin Ped Sur, 2023, 22(2): 188-191. DOI:10.3760/cma.j.cn101785-202206049-017 |
| [37] |
Luo GJ, Yao WF, He Y, et al. Ulinastatin prevents acute lung injury led by liver transplantation[J]. J Surg Res, 2015, 193(2): 841-848. DOI:10.1016/j.jss.2014.08.051 |
| [38] |
Hou L, Yang ZW, Wang ZK, et al. NLRP3/ASC-mediated alveolar macrophage pyroptosis enhances HMGB1 secretion in acute lung injury induced by cardiopulmonary bypass[J]. Lab Invest, 2018, 98(8): 1052-1064. DOI:10.1038/s41374-018-0073-0 |
| [39] |
Sugasawa Y, Yamaguchi K, Kumakura S, et al. The effect of one-lung ventilation upon pulmonary inflammatory responses during lung resection[J]. J Anesth, 2011, 25(2): 170-177. DOI:10.1007/s00540-011-1100-0 |
 2024, Vol. 23
2024, Vol. 23


