发育性髋关节脱位(developmental dislocation of the hip, DDH)是出生时就存在或生后继续发育才表现出来的一系列髋关节异常的总称,包括髋臼发育不良、髋关节半脱位和髋关节脱位,是小儿骨科常见的严重危害儿童健康的四肢畸形之一,发病率为3‰ ~5‰[1-2]。若延误诊治则可能导致跛行和疼痛,是成年人退行性骨性关节炎和髋关节置换术的主要原因之一[3]。治疗目标是早日实现髋臼内股骨头的同心圆复位,患儿年龄越小,骨骼重塑的潜力越大,闭合复位的效果越好,18个月以后患儿保守治疗通常效果较差,大部分需开放复位,行股骨截骨和髋臼成形等外科手术治疗,从而导致剧烈的术后疼痛[1]。研究表明区域阻滞能够提供良好的术中及术后镇痛,对促进患儿术后早期康复具有重要意义[4]。传统上骶管阻滞是该类手术患儿常用的区域阻滞技术,但其持续镇痛时间短,不能满足DDH患儿术后长期镇痛的需求。最近研究表明超声引导下PENG阻滞能为成人髋关节手术提供足够的镇痛作用[5]。但目前关于超声引导下PENG阻滞应用于小儿髋关节手术后镇痛的随机对照研究较少,本研究拟通过比较超声引导下PENG阻滞与传统骶管阻滞在小儿髋关节手术中的临床应用效果,初步探讨超声引导下PENG阻滞用于小儿髋关节手术的有效性及安全性。
资料与方法 一、一般资料本研究为前瞻性研究,经兰州大学第二医院伦理委员会批准(2022A-040),患儿家属签署知情同意书后,选择2022年1月至2023年1月在兰州大学第二医院择期拟行单侧髋关节矫形术的患儿为研究对象,性别不限,年龄1~5岁,体重10~21 kg,ASA Ⅰ~Ⅱ级。排除标准包括穿刺部位感染,凝血功能异常,对本研究相关药品如非甾体类抗炎药、局部麻醉药等过敏,合并身体其他部位畸形者。
二、麻醉方法术前1 d对患儿进行访视,并对患儿家属进行术后镇痛宣教及疼痛评估培训。患儿术前常规禁食禁饮,并于手术麻醉前2 h口服医用12.5%碳水化合物饮料(商品名:西沁)3 mL/kg[6]。患儿于病房建立静脉通路,入手术室前静脉给予咪达唑仑0.05~0.1 mg/kg,待患儿安静后接入手术室,常规监测心电图(electrocardiogram, ECG)、无创动脉血压(noninvasive arterial blood pressure, NIBP)、血氧饱和度(pulse oxygen saturation, SpO2)和心率(heart rate, HR),依次予以舒芬太尼0.5 μg/kg、丙泊酚2~3 mg/kg、顺式阿曲库铵0.1~0.15 mg/kg,面罩辅助通气,待下颌松弛后插入适当型号气管导管行机械通气,50%氧浓度1.5 L/min,维持呼气末二氧化碳分压(end-tidal carbon dioxide, PETCO2)35~45 mmHg(1 mmHg=0.133 kPa),气道压10~15 cmH2O(1 cmH2O=0.098 kPa)。患儿均于全身麻醉诱导后、手术切皮前行超声引导下区域阻滞。完成区域阻滞后,患儿保持平卧,记录此时的血压、心率为基础值,如果术中血压、心率变化较基础值增加10%,则定义为镇痛不足,间断予以舒芬太尼0.1 μg/kg作为补救镇痛措施,根据需要可重复给药,术中以七氟醚维持麻醉,维持脑电双频指数(bispectral index, BIS)在45~60[7]。手术结束石膏固定时停止七氟醚吸入,待患儿自主呼吸恢复,潮气量大于5 mL/kg,呼吸频率大于15次/分,PETCO2波形规律时拔管,观察3~5 min,患儿生命体征平稳送恢复室继续观察30 min以上,待患儿完全清醒且呼吸循环平稳后送至病房。
三、髋关节囊周神经阻滞方法 (一) 超声引导下骶管阻滞患儿取左侧卧位,屈髋屈膝,皮肤消毒后用高频线阵探头(6~13 MHz)从尾侧沿骶骨中线(探头长轴垂直于脊柱中线)向头侧移动,确定骶管裂孔后,使用22 G穿刺针垂直刺入皮肤,然后将针体向尾侧方向倾斜,与皮肤呈30° ~45°角,顺势推进1~2 cm,由骶管裂孔穿刺进入骶管腔,当刺到骶尾韧带时有弹韧感并且穿刺针较为固定,进入骶管腔有阻力消失感,证明针尖在骶管腔内。然后将探头长轴放置平行于脊柱中线,调节探头与皮肤的角度使骶管腔清晰成像,注入局部麻醉药物(0.2%罗哌卡因1 mL/kg,最大不超过20 mL)的同时,可看到骶尾韧带上抬的征象,注药前注意回抽针芯防止血管内和鞘内注射(图 1)。
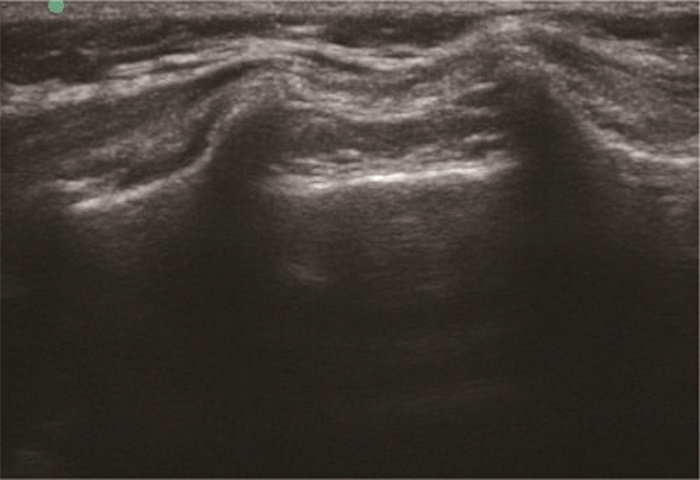
|
图 1 超声引导下骶管阻滞 Fig.1 Ultrasound-guided caudal block |
患儿取仰卧位,将高频线阵探头(6~13 MHz)放置于髂前上棘与耻骨联合连线,然后稍向尾侧滑动至超声下出现股骨头影像,再稍向头侧滑动至股骨头影像消失,出现连续的高回声骨性结构即为髂耻隆起,其内侧为耻骨支,外侧为髂前下棘,辨认出股动脉、髂腰肌腱等结构后,采用平面内技术进针,将针尖置于髂腰肌腱前方和耻骨支后方之间的肌筋膜平面,回抽无血后在观察到药物充分扩散的同时缓慢注入局麻药[8](0.2%罗哌卡因1 mL/kg,最大不超过20 mL)(图 2)。
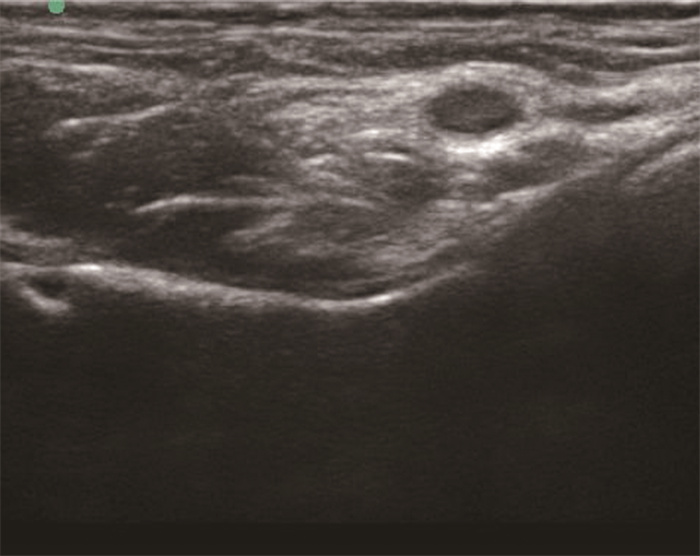
|
图 2 超声引导下髋关节囊周神经阻滞 Fig.2 Ultrasound-guided pericapsular nerve group block |
记录术中舒芬太尼和七氟醚的消耗量(七氟醚消耗量采用公式计算:挥发罐刻度×新鲜气流量×吸入时间/180)[9]。记录术后1 h、2 h、4 h、8 h、12 h、18 h、24 h、36 h、48 h的FLACC评分(总分0~10分,0分:放松、舒适;1~3分:轻度疼痛;4~6:中度疼痛;7~10分:严重疼痛。如评分大于3分,给予布洛芬混悬液补救镇痛,规格100 mL:2 g。用量:体重10~15 kg,一次4 mL;16~21 kg,一次5 mL;可间隔4~6 h重复用药1次,24 h不超过4次)。记录术后48 h内首次补救镇痛时间及补救镇痛总量。记录患儿家长满意度(1分=差,2分=一般,3分=好,4分=非常好)。记录术中低血压、术后尿潴留、恶心、呕吐、穿刺部位血肿、感染、局麻药中毒等并发症发生情况。低血压定义为收缩压较基础值降低超过20%,如术中出现低血压则给予麻黄碱0.1 mg/kg。尿潴留定义为术后超过8 h未排尿需留置导尿,所有患儿术中均未进行导尿。
五、统计学处理本研究主要结局指标为术后48 h内患儿首次补救镇痛时间,根据预实验结果,骶管阻滞组(C组)为(5.0±2.0)h,髋关节囊周神经阻滞组(P组)为(8.0±3.2)h,设置检验水准α=0.05,检验效能(1-β)=0.9,采用PASS 15软件计算出每组至少需要18例,考虑到可能失访,最终拟纳入患儿共40例。采用SPSS 25.0软件进行统计分析,对服从正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验;非正态分布计量资料用M(Q1,Q3)表示,组间比较采用秩和检验,组内不同时点比较采用重复测量的广义估计方程。计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法。术后首次补救镇痛时间使用生存分析(Kaplan-Meier法),组间比较采用Log Rank检验。P<0.05为差异有统计学意义。
结果两组患儿性别、年龄、体重等一般资料比较,差异无统计学意义(P>0.05), 术后1 h、2 h、4 h、8 h、12 h、18 h、24 h、36 h、48 h的FLACC评分差异无统计学意义。见表 1、表 2。
| 表 1 两组发育性髋关节脱位患儿一般资料比较 Table 1 Inter-group comparison of general profiles |
|
|
| 表 2 两组发育性髋关节脱位患儿术后各时点FLACC评分比较[M(Q1, Q3),分] Table 2 Inter-group comparison of postoperative FLACC pain scores at different timepoints[M(Q1, Q3), point] |
|
|
C组、P组患儿术后首次补救镇痛时间分别为4 h(95%CI=3.463~4.537,标准误=0.274)和12 h(95%CI=6.186~17.814,标准误=2.966);与C组比较,P组患儿术后首次补救镇痛中位时间明显延长(P<0.05)。见图 3。

|
图 3 术后48 h首次补救镇痛时间的生存分析图 Fig.3 Survival analysis of time to initial rescue analgesia within 48 h post-operation 注 C组:骶管阻滞组;P组:髋关节囊周神经阻滞组; C、P组患儿术后首次补救镇痛时间的中位数分别为4 h、12h(P<0.05,Log Rank检验) |
与C组比较,P组术后48 h补救镇痛布洛芬总量明显减少(P<0.05),家长满意度评分明显增高(P<0.05),两组患儿术中七氟烷、舒芬太尼用量及术后住院时间差异无统计学意义(P>0.05)。两组患儿术后均未出现穿刺部位血肿、感染及局麻药中毒等情况。两组术中低血压和术后尿潴留、恶心、呕吐发生率差异无统计学意义(P>0.05)。见表 3、表 4。
| 表 3 两组发育性髋关节脱位患儿术中麻醉药物用量及术后情况比较(x±s) Table 3 Inter-group comparison of intraoperative anesthetic consumption and postoperative status(x±s) |
|
|
| 表 4 两组发育性髋关节脱位患儿围手术期不良反应发生率比较[例(%)] Table 4 Inter-group comparison of incidence of perioperative adverse events[n(%)] |
|
|
目前小儿骨科矫形手术麻醉多采用全身麻醉与神经阻滞相结合的方式。在本研究中,我们采用一种新型髋关节囊周神经阻滞技术,并将其与骶管阻滞对比应用于小儿髋关节矫形术的镇痛,取得了较为满意的镇痛效果。本研究骨盆截骨术式限定为Salter截骨,且均由同一手术团队完成。所有患儿在全身麻醉后、手术切皮前完成神经阻滞。骶管阻滞通过将局麻药注入骶管腔以广泛阻滞骶脊神经,是硬膜外麻醉的一种方法;而PENG阻滞通过将局麻药注入髂前下棘和髂耻隆起之间、髂腰肌腱前方和耻骨后支之间的肌筋膜平面,阻滞了在髋关节神经支配中起主要作用的股神经和副闭孔神经,从而使骨盆截骨和股骨转子下截骨这两部分手术区域的大部分痛觉消失[5]。本研究结果显示,两种阻滞技术均可用于小儿髋关节手术的镇痛,术中仅辅以少量阿片类药物即可满足手术需要,两组患儿术中七氟烷和舒芬太尼使用量差异无统计学意义(P>0.05)。
目前PENG阻滞用于成人的常用局麻药浓度为0.25% ~0.5%布比卡因或罗哌卡因10~30 mL,但在小儿中的应用研究较少[5, 8, 10]。国内小儿术后镇痛专家共识推荐罗哌卡因用于区域阻滞的浓度范围为0.15% ~0.25%,且单次注射最大量不超过2.5 mg/kg[11]。欧洲儿科麻醉学会疼痛委员会推荐0.2%罗哌卡因用于超声引导下小儿骶管阻滞的剂量多为1 mL/kg,最高可达1.5 mL/kg[12]。为了便于设置对照,本研究两种阻滞局麻药用量确定为0.2%罗哌卡因1 mL/kg,最大不超过20 mL。
在本研究中,我们通过患儿术后首次补救镇痛时间来观察神经阻滞的持续作用时间,结果显示,C组患儿术后首次补救镇痛的中位时间为4 h,这与许多既往研究结果相似,而P组患儿首次补救镇痛的中位时间为12 h,证明PENG阻滞可显著延长髋关节手术患儿的术后镇痛时间。在相关研究中,Aksu等[13]用0.25%布比卡因10 mL为1例8岁接受髋关节开放复位术的患儿行PENG阻滞,术后首次补救镇痛时间可达10 h。Gürkan等[14]用0.25%布比卡因1 mL/kg行腰丛阻滞用于同类手术患儿,术后首次镇痛的平均时间为(10±3)h。我们的研究表明PENG阻滞同样可为小儿髋关节手术提供较为持久的术后镇痛时间,这可能也是P组患儿术后48 h布洛芬总用量明显少于C组,以及P组患儿家长满意度评分高于C组的原因。与腰丛阻滞相比,理论上PENG阻滞的安全性更高,操作难度小,易于初学者学习和掌握,且无需变换体位,更容易在临床实施。
本研究中两组患儿术后各时点的FLACC疼痛评分差异均无统计学意义(P>0.05),在一定程度上证明PENG阻滞也可为DDH患儿提供有效的术后镇痛效果。有研究报道PENG阻滞联合其他阻滞方式,如股神经阻滞、股外侧皮神经阻滞和竖脊肌平面阻滞等可取得更好的镇痛效果[15-17]。尤其在行PENG阻滞的同时,大多数患儿可同时扫描到支配大腿外侧皮肤感觉的股外侧皮神经,因此可实现单次注射达到两种阻滞的目的[17]。值得注意的是,由于穿刺路径靠近股神经,进针前须先定位股神经以防误伤,另外股外侧皮神经也位于髂前上棘靠近穿刺点的位置,因此阻滞成功的关键是要准确定位图像[18]。目前PENG阻滞用于围手术期镇痛的并发症尚未见文献报道。
由于PENG阻滞只针对髋关节前囊的感觉分支,较少对股四头肌产生影响,因此,对促进髋关节置换术后患者的早期物理锻炼有一定益处[19]。有研究表明PENG阻滞能缩短老年全髋关节置换术患者的术后首次下床行走时间,并改善髋关节活动度,从而促进患者术后功能恢复[20]。但在本研究中,患儿术后均需长时间佩戴双下肢外展支具,因此我们无法评估PENG阻滞是否更有利于DDH患儿的术后功能恢复,两组在术后住院时间方面差异无统计学意义。尽管既往文献报道骶管阻滞会导致低血压、尿潴留等并发症,但本研究中两组在低血压、尿潴留等并发症的发生率方面并无统计学差异,可能是由于本研究的样本量较小。因此,需要进一步扩大样本量以探索PENG阻滞是否较骶管阻滞减少围术期不良反应。
本研究的局限性:①由于儿童属于特殊群体,本研究区域阻滞均在全身麻醉下进行,因此无法通过感觉消退与运动检查评估其阻滞效率;②目前临床用于小儿髋关节矫形术的骨盆截骨术式众多,在本研究中我们将骨盆截骨的术式限定为Salter截骨,因此我们不能确定本研究得出的结论是否同样适用于其他术式;③本研究样本量较小,对于本研究的其他结局指标,如术后疼痛评分及与PENG阻滞相关的并发症等,还需要更大样本量的多中心研究进一步探讨。
综上所述,与传统骶管阻滞相比,超声引导下PENG阻滞可明显延长DDH患儿术后48 h内首次补救镇痛时间,降低患儿术后镇痛需求,镇痛满意度更高,值得临床进一步探索及应用。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为王亚琴、石翊飒,论文调查设计为王亚琴、石翊飒、陈培章,数据收集与分析为王亚琴、陈培章、张凯、罗炜、石翊飒,论文结果撰写为王亚琴、石翊飒,论文讨论分析为王亚琴、石翊飒、黄生辉
| [1] |
雷霆, 朱光辉, 刘昆, 等. 髋臼坐骨切迹周围截骨与Pemberton截骨治疗儿童发育性髋关节脱位的中期随访对比研究[J]. 临床小儿外科杂志, 2022, 21(8): 731-737. Lei T, Zhu GH, Liu K, et al. Comparative study of periacetabular sciatic notch osteotomy versus Pemberton osteotomy for developmental hip dislocation in children[J]. J Clin Ped Sur, 2022, 21(8): 731-737. DOI:10.3760/cma.j.cn101785-202204045-006 |
| [2] |
Ahiskalioglu A, Yayik AM, Alici HA, et al. Ultrasound guided transmuscular quadratus lumborum block for congenital hip dislocation surgery: report of two pediatric cases[J]. J Clin Anesth, 2018, 49: 15-16. DOI:10.1016/j.jclinane.2018.05.018 |
| [3] |
Yang S, Zusman N, Lieberman E, et al. Developmental dysplasia of the hip[J]. Pediatrics, 2019, 143(1): e20181147. DOI:10.1542/peds.2018-1147 |
| [4] |
Frizzell KH, Cavanaugh PK, Herman MJ. Pediatric perioperative pain management[J]. Orthop Clin North Am, 2017, 48(4): 467-480. DOI:10.1016/j.ocl.2017.06.007 |
| [5] |
Girón-Arango L, Peng PWH, Chin KJ, et al. Pericapsular nerve group (PENG) block for hip fracture[J]. Reg Anesth Pain Med, 2018, 43(8): 859-863. DOI:10.1097/AAP.0000000000000847 |
| [6] |
Fawcett WJ, Thomas M. Pre-operative fasting in adults and children: clinical practice and guidelines[J]. Anaesthesia, 2019, 74(1): 83-88. DOI:10.1111/anae.14500 |
| [7] |
Omar AM, Mansour MA, Kamal AS. Psoas compartment block for acute postoperative pain management after hip surgery in pediatrics: a comparative study with caudal analgesia[J]. Reg Anesth Pain Med, 2011, 36(2): 121-124. DOI:10.1097/AAP.0b013e31820d41f3 |
| [8] |
杨曙光, 陶红, 陈超, 等. 超声引导髋关节囊周围神经阻滞在老年髋部骨折病人术前镇痛中的应用[J]. 骨科, 2020, 11(2): 140-142. Yang SG, Tao H, Chen C, et al. Ultrasound-guided pericapsular nerve group block for preoperative analgesia in elders with hip fractures[J]. Orthopaedics, 2020, 11(2): 140-142. DOI:10.3969/j.issn.1674-8573.2020.02.009 |
| [9] |
Watson KR, Shah MV. Clinical comparison of 'single agent' anaesthesia with sevoflurane versus target controlled infusion of propofol[J]. Br J Anaesth, 2000, 85(4): 541-546. DOI:10.1093/bja/85.4.541 |
| [10] |
Morrison C, Brown B, Lin DY, et al. Analgesia and anesthesia using the pericapsular nerve group block in hip surgery and hip fracture: a scoping review[J]. Reg Anesth Pain Med, 2021, 46(2): 169-175. DOI:10.1136/rapm-2020-101826 |
| [11] |
左云霞, 冯春, 刘飞, 等. 小儿术后镇痛专家共识[M]//中华医学会麻醉学分会. 2017版中国麻醉学指南与专家共识. 北京: 人民卫生出版社, 2017: 295-311. Zuo YX, Feng C, Liu F, et al. Expert Consensus on Postoperative Analgesia in Children[M]//Anesthesiology Branch of Chinese Medical Association 2017: Chinese Anesthesiology Guidelines and Expert Consensus. Beijing: People's Medical Publishing House, 2017: 295-311. |
| [12] |
Vittinghoff M, Lönnqvist PA, Mossetti V, et al. Postoperative pain management in children: guidance from the pain committee of the European Society for Paediatric Anaesthesiology (ESPA Pain Management Ladder Initiative)[J]. Paediatr Anaesth, 2018, 28(6): 493-506. DOI:10.1111/pan.13373 |
| [13] |
Aksu C, Cesur S, Kuș A. Pericapsular nerve group (PENG) block for postoperative analgesia after open reduction of pediatric congenital dysplasia of the hip[J]. J Clin Anesth, 2020, 61: 109675. DOI:10.1016/j.jclinane.2019.109675 |
| [14] |
Gürkan Y, Aksu C, Kuș A, et al. One operator's experience of ultrasound guided lumbar plexus block for paediatric hip surgery[J]. J Clin Monit Comput, 2017, 31(2): 331-336. DOI:10.1007/s10877-016-9869-x |
| [15] |
Orozco S, Muñoz D, Jaramillo S, et al. Pediatric use of pericapsular nerve group (PENG) block for hip surgical procedures[J]. J Clin Anesth, 2019, 57: 143-144. DOI:10.1016/j.jclinane.2019.04.010 |
| [16] |
Ince I, Kilicaslan A, Kutlu E, et al. Combined pericapsular nerve block (PENG) and lumbar erector spinae plane (ESP) block for congenital hip dislocation surgery[J]. J Clin Anesth, 2020, 61: 109671. DOI:10.1016/j.jclinane.2019.109671 |
| [17] |
Aksu C, Cesur S, Kuș A. Pericapsular nerve group block and lateral femoral cutaneous block with single needle entry are possible in pediatric patients[J]. J Clin Anesth, 2021, 71: 110215. DOI:10.1016/j.jclinane.2021.110215 |
| [18] |
Black ND, Chin KJ. Pericapsular nerve group (PENG) block: comments and practical considerations[J]. J Clin Anesth, 2019, 56: 143-144. DOI:10.1016/j.jclinane.2019.02.010 |
| [19] |
Gerhardt M, Johnson K, Atkinson R, et al. Characterization and classification of the neural anatomy in the human hip joint[J]. Hip Int, 2012, 22(1): 75-81. DOI:10.5301/HIP.2012.9042 |
| [20] |
Pascarella G, Costa F, Del Buono R, et al. Impact of the pericapsular nerve group (PENG) block on postoperative analgesia and functional recovery following total hip arthroplasty: a randomized, observer-masked, controlled trial[J]. Anaesthesia, 2021, 76(11): 1492-1498. DOI:10.1111/anae.15536 |
 2024, Vol. 23
2024, Vol. 23


