胰胆管合流异常(pancreaticobiliary maljunction, PBM)是指胰管、胆管在十二指肠壁外汇合,形成较长共同管,Oddi括约肌失去调控而导致胰液和胆汁流体力学紊乱的一种先天性发育异常,1916年由日本学者Kozumi等[1]首次报道。PBM为胆管癌的危险因素,其癌变率为一般人群的167~419倍。胆管未扩张型PBM起病隐匿,合并胆囊癌的风险更高[2]。2012年《日本PBM临床实践指南》及2019年我国发布的《儿童胰胆管合流异常临床实践专家共识》均推荐胆管未扩张型PBM一经确诊,需行预防性手术治疗[3-4]。日本的指南建议行预防性胆囊切除,国内对有症状患儿多采用腹腔镜下肝外胆管切除和肝管空肠Roux-en-Y吻合术(根治术)[4]。2017年起有学者报道十二指镜治疗PBM的方法,发现乳头括约肌切开术可有效缩短胆胰流出道,减轻流出道压力,促进胆汁及胰液排出,总体治疗有效率为60.7% ~87.0%[5-9]。复旦大学附属儿科医院的临床经验显示,部分胆总管直径≤10 mm的PBM患儿经内镜治疗后无需行根治手术,但是内镜治疗PBM的具体效果仍不清楚。本研究旨在初步探讨内镜治疗无明显胆管扩张型胰胆管合流异常(pancreaticobiliary maljunction without obvious biliary dilatation, PBM-nonOBD)患儿的疗效和安全性,为该型患儿治疗方法的选择提供参考。
资料与方法 一、一般资料回顾性分析复旦大学附属儿科医院普外科2020年1月至2022年12月收治的内镜治疗无明显胆管扩张型PBM患儿临床资料。纳入标准:①磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)显示胆总管最宽直径≤10 mm合并胰胆共同管长度>5 mm(图 1);②存在反复腹部症状;③在本院接受十二指肠镜治疗。排除标准:①仅接受十二指肠镜逆行性胆胰管造影(endoscopic retrograde cholangiopancreatography, ERCP);②此前接受过针对PBM的手术治疗;③临床资料缺失或影像学上无法对合流段进行测量。最终共44例患儿纳入本研究,其中男性16例、女性28例,年龄1岁6个月至12岁6个月(中位年龄5.8岁),平均病程8个月。根据内镜治疗有效与否进一步分为治疗有效组及治疗无效组,分析影响患儿预后的因素。本研究获得复旦大学附属儿科医院伦理委员会批准(复旦儿伦审[2022]—263号),患儿家属均知情同意。
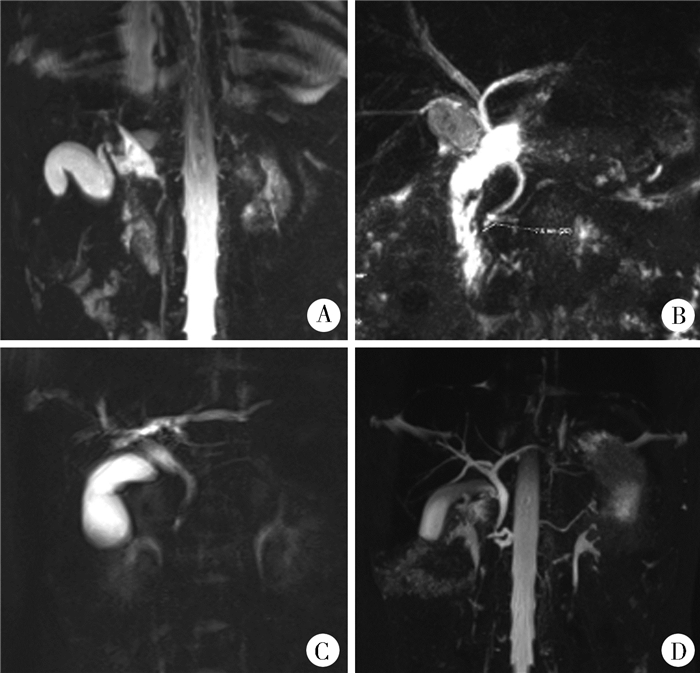
|
图 1 磁共振胰胆管造影显示胰胆管合流异常的四种分型 Fig.1 Four types of pancreaticobiliary maljunction on magnetic resonance cholangiopancreatography 注 A:30月龄女性患儿的狭窄型(A型)共同管;B:11岁男性患儿的非狭窄型(B型)共同管;C:8岁女性患儿的扩张型(C型)共同管;D:9岁男性患儿的复杂型(D型)胰胆管合流异常 |
患儿术前均行血常规、肝功能、血淀粉酶、超声及MRCP检查。术前禁食,予三代头孢类抗生素预防感染。手术采取气管插管,静脉吸入复合全身麻醉。患儿取俯卧位,十二指肠镜(Olympus JF260)乳头插管造影显示胆管形态、胰管胆管汇合关系、胆胰管有无结石或蛋白栓等。胰胆合流段行乳头括约肌切开(endosopic sphincterotomy, EST),以乳头中切开为主(至第一、二缠头皱襞之间),部分缠头皱襞不清晰患儿予切开乳头长度一半左右,至切开刀刀弓拉开能顺利进出胆道为止(图 2)。切开断面采用氩气止血,断面较大者予止血夹夹闭;存在充盈缺损者行球囊取石;导丝反复插入胰管(>3次)者胰管内放置短支架引流;胆管内结石较多者留置鼻胆管引流3~5 d;年龄1岁左右、鼻胆管较难保留固定者可胆管放置塑料支架引流;胆道出口狭窄者予6 mm球囊扩张。本组44例患儿内镜下操作包括:44例(100%) EST,36例(81.8%)球囊取石,22例(50.5%)胰管支架引流,21例(47.7%)鼻胆管引流,15例(34.1%)球囊扩张,2例(4.5%)胆管支架引流。ERCP术后3 d予抗感染、抑酸等对症治疗,并监测血清淀粉酶,放置鼻胆管引流者需观察引流液性质及量。

|
图 2 无明显胆管扩张型胰胆管合流异常患儿十二指肠镜下所见及操作 Fig.2 Endoscopic retrograde cholangiopancreatography showed pancreaticobiliary maljunction without obvious biliary dilatation and intraoperative procedures 注 A: 造影显示狭窄型(A型)胰胆管合流异常;B: 内镜下插管行括约肌切开;C:切开后予6 mm球囊扩张;D:括约肌切开后状态 |
通过电话或微信联系患儿家属进行随访。术后1个月、3个月、6个月、1年及之后每年收集患儿术后症状(包括腹痛、呕吐、发热等)、实验室检查结果(包括血淀粉酶、血常规、肝功能等)、B超检查结果及再手术情况;如患儿接受根治手术则认为其提前达到随访终点。
四、相关定义ERCP术后胰腺炎(post-ERCP pancreatitis, PEP):指ERCP术后24~72 h血清淀粉酶水平超过正常值上限3倍且伴有腹痛症状。
治疗有效:患儿术后无反复腹部症状,未出现严重并发症;随访期间无再发胆囊炎、胆管炎、胰腺炎及胰胆管结石;十二指肠镜术后未行根治手术治疗。
五、统计学处理采用GraphPad Prism 8.0.1进行统计学分析。分类资料采用卡方检验进行组间比较;定量资料采用中位数或平均值描述,采用两独立样本t检验分析和Mann-Whitney U检验进行组间比较。采用单因素分析影响PBM-nonOBD患儿内镜治疗预后的危险因素,将单因素分析中P<0.05的变量纳入多因素Logistic回归分析,筛选PBM-nonOBD患儿内镜治疗后短期预后不良的危险因素,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,分析相关危险因素的预测价值。P<0.05为差异有统计学意义。
结果本组患儿临床症状以腹痛(41/44, 93.2%)、呕吐(21/44,47.7%)为主,并发症以急性胰腺炎(18/44,40.9%)、肝酶异常(14/44,31.8%)及胆总管结石(11/44,25.0%)常见。按日本胰胆管合流异常研究学会2015年PBM分型,并基于MRCP结果可将患儿分为4型:A型(狭窄型)8例(18.2%),B型(非狭窄型)13例(29.5%),C型(共同管扩张型)9例(20.4%),D型(复杂型)14例(31.8%)。MRCP所示胰胆共同管长度为(9.9±3.5)mm,胆总管最宽直径为(6.1±2.4)mm;18例(40.9%)患儿存在胰管扩张。B超显示18例(40.9%)患儿存在胆囊壁增厚。
本组患儿随访时间为(19.7±8.6)个月,总体治疗有效率为54.5%(24/44)。术后并发症以PEP最为常见(7/44, 15.9%), 其次是消化道出血(2/44, 4.5%)。12例(27.3%)于术后2~29个月接受根治手术,手术原因:ERCP显示胆总管宽度>1 cm 4例,进行性胆管扩张5例,复发性急性胰腺炎4例和肝功能持续异常1例。再次内镜治疗7例(15.9%),手术原因:胆总管结石3例、胰腺炎复发2例、胰管扩张1例和胰管狭窄1例。除上述再手术患者外,随访期间出现腹痛、呕吐症状经抗感染或生长抑素治疗后好转3例(3/44,6.8%)。
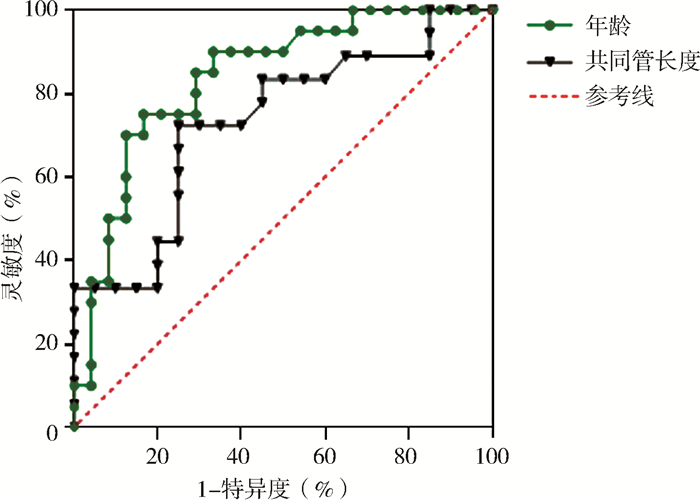
单因素分析显示,年龄小、胆总管直径大、胰胆共同管长度长是内镜治疗PBM-nonOBD患儿预后不良的相关因素(表 1)。治疗有效组患儿PBM分型以B型和D型为主,占比分别为41.7%(10/24)和37.5%(9/24);两组PBM分型差异无统计学意义(P>0.05)。Logistic回归分析显示,年龄小以及胰胆共同管长度长是内镜治疗PBM-nonOBD患儿预后不良的危险因素(表 2)。年龄和共同管长度预测内镜治疗PBM-nonOBD患儿疗效的ROC曲线如图 3所示,曲线下面积(area under the ROC curve, AUC)分别为0.838 (95%CI:0.719, 0.958)和0.731(95%CI:0.567, 0.894),最佳截断值分别为4.9岁和8.8 mm,预测灵敏度分别为75.0%和72.2%,特异度分别为83.3%和75.0%(表 3)。
| 表 1 内镜治疗无明显胆管扩张型胰胆管合流异常患儿疗效的单因素分析结果 Table 1 Univariate analysis of factors influencing the efficacy of ERCP in children of PBM-nonOBD |
|
|
| 表 2 内镜治疗无明显胆管扩张型胰胆管合流异常患儿疗效的多因素分析结果 Table 2 Multivariate analysis of factors influencing the efficacy of ERCP in children of PBM-nonOBD |
|
|
|
图 3 年龄和胰胆共同管长度预测内镜治疗无明显胆管扩张型胰胆管合流异常患儿不良预后的ROC曲线 Fig.3 ROC curve of age and common channel length for predicting adverse outcomes after endoscopy in PBM-nonOBD children |
| 表 3 年龄及胰胆共同管长度预测内镜治疗无明显胆管扩张型胰胆管合流异常患儿不良预后的ROC曲线参数 Table 3 ROC curve parameters of age and common channel length for predicting adverse outcomes after endoscopy in PBM-nonOBD children |
|
|
胰胆管合流异常是胆管癌变的危险因素,伴随患儿年龄增长,其恶变率显著提高[2, 10-11]。胰胆管流体力学紊乱在PBM疾病发展中起到关键作用,并受到胰胆管汇合形态、共同管长度、胰管和胆管之间压力差、Oddi括约肌功能以及有无胆道梗阻的共同影响[11]。胰胆分流、解除梗阻是PBM患儿手术治疗的目的,内镜下EST可缩短胰胆共同管,取石、放置支架等操作可使胰液和胆汁顺利排出。
与既往研究报道ERCP治疗PBM的有效率相比,本研究ERCP治疗PBM的有效率偏低(60.7% ~87.0%比54.5%), 主要原因可能在于我们对内镜治疗有效的定义更为严格。Jin等[6]的研究中将经ERCP治疗后接受了根治手术,但症状改善定义为ERCP治疗有效。此外,本研究纳入的主要是胆管无明显扩张的PBM患者,而未合并胆管扩张的PBM患者总体预后可能比合并胆管扩张的PBM患者差[2, 12-13]。本研究中部分患儿需要反复ERCP或者接受根治手术,可能原因包括:①共同管过长,可能无法完全切开消除合流;②远端狭窄,再发胆管、胰管结石;③伴发胰腺病变;④十二指肠压力过高,在乳头括约肌功能受损的情况下存在反流。胰胆合流长度可能是决定手术效果的关键因素,但具体截断值尚需更多数据积累。
对于PBM不同分型患儿,ERCP治疗效果及成功率可能存在差异,Terui等[14]研究发现,共同管扩张型患儿的内镜治疗效果相对较好,而Jin等[6]研究发现共同管扩张与否不影响ERCP手术预后。我们进一步分析了不同分型PBM对预后的影响,发现B型和D型PBM内镜治疗效果较好。这可能是由于B型胰胆管顺应性较好,行EST后可解除胰胆管流体力学紊乱;D型存在副胰管引流,总体预后较好;这与Yoshimoto等[15]报道一致。A型患者多数存在进行性胆管扩张,而C型患者在内镜手术后易出现反复胰胆管结石,因此我们建议这两型患者接受根治手术治疗。本研究受限于样本量较小,不同分型间预后无显著差异,后续应扩大样本量进一步深入探索胰胆管测压方式以及胰液和胆汁流体力学以指导细致的PBM分型,或许有助于医师合理选择手术方式。
本研究根据MRCP胆总管直径选择病例,实际工作中,不同方法判断胆总管直径常存在一定差异,且部分患儿胆总管直径存在顿挫变化。经ERCP测量的胆总管宽度常因注射压力,直径常大于超声和MRCP的测量结果。本研究中有患儿ERCP显示胆总管宽度>1 cm,但后续接受了根治手术[16]。在胰胆共同管远端切开长度方面,目前文献均未提供统一标准,理论上应尽量缩短共同管。本组病例EST以乳头中切开为主,部分缠头皱襞不清晰患儿切开乳头长度的50%,结合扩张,部分可达到大切开程度,并适当保留了部分括约肌。当然,中切开对于较长共同管患儿可能未完全切开,因此复发或再次手术的概率较高。虽然年龄小不是ERCP的禁忌证,但我们的研究发现年龄是影响内镜治疗无明显胆管扩张型PBM疗效的关键因素,年龄小意味着患儿胰胆管直径小,增加了内镜操作的难度,可能更易出现胰胆管损伤。
PEP是ERCP最常见的术后并发症,增加了患儿住院时长,本研究中PEP的发生率为15.9%,略高于已有研究报道的PEP发生率12.0%,可能与早期学习曲线、性别比例差异、手术年龄小、胰腺炎患病率高等因素相关[7]。PEP的发生与多个因素相关,包括乳头损伤、静水压损伤、肠道酶回流及细菌感染等,儿童围手术期使用非甾体类抗炎药预防PEP的疗效还有待深入研究。
本研究存在一定局限性。首先,本研究通过MRCP测量PBM共同管长度,根据研究报道共同管长度≤9 mm,MRCP诊断PBM的灵敏度下降,本研究部分胰胆合流患儿可能未被纳入[17];其次,术中未进行Oddi括约肌压力测定,无法明确Oddi括约肌功能,这可能是导致部分患儿需要接受根治手术的原因;再者,ERCP术后残留括约肌是否有效控制胰胆反流尚缺乏客观判断依据。
综上,ERCP作为儿童无明显胆管扩张型PBM的辅助治疗方法,可有效缓解部分无明显胆管扩张PBM患儿症状,解除梗阻,促进引流。关于ERCP的合流段切开长度、中转或二期根治术的时机,还有待进一步研究探讨。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 钱曼宁、陈功负责研究的设计、实施和文章起草;吴颖、姜丽媛、王秋燕进行病例数据收集;汪佳伟、孙松、宋再、杨少波负责临床技术及研究设计;董岿然、肖现民、郑珊、陈功对文章知识性内容进行审阅
| [1] |
Kamisawa T, Ando H, Hamada Y, et al. Diagnostic criteria for pancreaticobiliary maljunction 2013[J]. J Hepatobiliary Pancreat Sci, 2014, 21(3): 159-161. DOI:10.1002/jhbp.57 |
| [2] |
Shimada M, Ishibashi H, Morine Y, et al. Nationwide survey of pancreaticobiliary maljunction focusing on biliary cancer incidence in Japan[J]. J Clin Oncol, 2020, 38(4_suppl): 587. DOI:10.1200/JCO.2020.38.4_suppl.587 |
| [3] |
中华医学会小儿外科学分会新生儿学组, 中华医学会小儿外科学分会肝胆学组. 儿童胰胆管合流异常临床实践专家共识[J]. 临床肝胆病杂志, 2019, 35(12): 2712-2715. Groups of Neonatal Surgery and Pediatric Biliary Surgery, Branch of Pediatric Surgery, Chinese Medical Association. Guidelines for Diagnosing and Treating Pediatric Pancreaticobiliary Maljunction[J]. J Clin Hepatol, 2019, 35(12): 2712-1215. DOI:10.3969/j.issn.1001-5256.2019.12.014 |
| [4] |
Kamisawa T, Ando H, Suyama M, et al. Japanese clinical practice guidelines for pancreaticobiliary maljunction[J]. J Gastroenterol, 2012, 47(7): 731-759. DOI:10.1007/s00535-012-0611-2 |
| [5] |
李星志, 任笠坤, 刘浩, 等. 内镜诊疗胰胆管合流异常的有效性和安全性[J]. 中华肝胆外科杂志, 2021, 27(8): 604-609. Li XZ, Ren LK, Liu H, et al. Endoscopic diagnosis and treatment of pancreaticobiliary maljunction: a study on efficacy and safety[J]. Chin J Hepatobiliary Surg, 2021, 27(8): 604-609. DOI:10.3760/cma.j.cn113884-20201114-00584 |
| [6] |
Jin Z, Bie LK, Tang YP, et al. Endoscopic therapy for patients with pancreaticobiliary maljunction: a follow-up study[J]. Oncotarget, 2017, 8(27): 44860-44869. DOI:10.18632/oncotarget.16228 |
| [7] |
Zeng JQ, Deng ZH, Yang KH, et al. Endoscopic retrograde cho-langiopancreatography in children with symptomatic pancreaticobiliary maljunction: a retrospective multicenter study[J]. World J Gastroenterol, 2019, 25(40): 6107-6115. DOI:10.3748/wjg.v25.i40.6107 |
| [8] |
Weng MZ, Wang LB, Weng H, et al. Utility of endoscopic retrograde cholangiopancreatography in infant patients with conservational endoscopy[J]. Transl Pediatr, 2021, 10(10): 2506-2513. DOI:10.21037/tp-21-406 |
| [9] |
Wang QQ, Moon SB, Zang JY, et al. Usefulness of pre-operative endoscopic retrograde cholangiopancreatography in diagnosis and management of forme fruste choledochal cyst in children[J]. ANZ J Surg, 2020, 90(6): 1041-1045. DOI:10.1111/ans.15674 |
| [10] |
Kamisawa T, Kaneko K, Itoi T, et al. Pancreaticobiliary maljunction and congenital biliary dilatation[J]. Lancet Gastroenterol Hepatol, 2017, 2(8): 610-618. DOI:10.1016/S2468-1253(17)30002-X |
| [11] |
Kamisawa T, Honda G. Pancreaticobiliary maljunction: markedly high risk for biliary cancer[J]. Digestion, 2019, 99(2): 123-125. DOI:10.1159/000490816 |
| [12] |
Hyvärinen I, Hukkinen M, Kivisaari R, et al. Increased prevalence of pancreaticobiliary maljunction in biliary malignancies[J]. Scand J Surg, 2019, 108(4): 285-290. DOI:10.1177/1457496918822617 |
| [13] |
Miyoshi H, Inui K, Katano Y, et al. B-mode ultrasonographic diagnosis in gallbladder wall thickening[J]. J Med Ultrason (2001), 2021, 48(2): 175-186. DOI:10.1007/s10396-020-01018-6 |
| [14] |
Terui K, Yoshida H, Kouchi K, et al. Endoscopic sphincterotomy is a useful preoperative management for refractory pancreatitis associated with pancreaticobiliary maljunction[J]. J Pediatr Surg, 2008, 43(3): 495-499. DOI:10.1016/j.jpedsurg.2007.10.071 |
| [15] |
Yoshimoto K, Kamisawa T, Kikuyama M, et al. Classification of pancreaticobiliary maljunction and its clinical features in adults[J]. J Hepatobiliary Pancreat Sci, 2019, 26(12): 541-547. DOI:10.1002/jhbp.691 |
| [16] |
Miyake H, Fukumoto K, Yamoto M, et al. Pancreaticobiliary maljunction without biliary dilatation in pediatric patients[J]. Surg Today, 2022, 52(2): 207-214. DOI:10.1007/s00595-021-02322-5 |
| [17] |
Itokawa F, Kamisawa T, Nakano T, et al. Exploring the length of the common channel of pancreaticobiliary maljunction on magnetic resonance cholangiopancreatography[J]. J Hepatobiliary Pancreat Sci, 2015, 22(1): 68-73. DOI:10.1002/jhbp.168 |
 2024, Vol. 23
2024, Vol. 23


