短肠综合征(short bowel syndrome, SBS)是一组由于小肠广泛切除或旷置后,残存功能性肠管不能维持患儿营养需要或生长需求的吸收不良相关症候群,通常由新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)、肠闭锁、肠扭转、腹裂及先天性短肠等导致。部分患儿小肠总长度小于15~20 cm,或肠管切除后剩余肠管长度小于相应年龄儿童肠管预期长度的10%,称为超短肠综合征(ultra-short bowel syndrome, USBS)[1-3]。部分患儿由于病变位置较高,需行高位空肠造口,但远端仍有正常小肠可以利用,称为暂时性短肠综合征(temporary short bowel syndrome, TSBS)[4]。USBS相对罕见,属于SBS分型中的Ⅰ型及ⅡA型,是病情最严重的一种类型,治疗较困难,且治疗过程中并发症多,患儿较难摆脱对于肠外营养的依赖。本研究回顾性收集浙江大学医学院附属儿童医院收治的USBS患儿临床资料,总结分析其临床特点、诊疗经验及预后。
资料与方法 一、临床资料回顾性分析浙江大学医学院附属儿童医院新生儿外科2015年1月至2021年2月收治的24例USBS患儿临床资料。病例纳入标准:患儿小肠长度小于20 cm,或肠管切除后剩余肠管长度小于相应年龄儿童肠管预期长度的10%。排除标准:①临床资料不完整; ②合并其他致死性先天性畸形。本研究通过浙江大学医学院附属儿童医院科研伦理委员会审核批准(2021 — IRB — 262), 患儿家属对治疗方案、手术方式及相关病情数据的纳入均知情同意并签署知情同意书。
纳入研究的24例USBS患儿中,男17例,女7例;早产儿20例,足月儿4例;胎龄26~39+5周;出生体重(1 993±744)g;入院年龄2小时至1岁4个月。发病原因:NEC 19例(其中1例合并食管闭锁,1例合并脐膨出),肠闭锁3例,肠扭转2例。剩余小肠长度(13.5±6.6)cm,16例有回盲瓣。7例为暂时性超短肠综合征;17例为非暂时性超短肠综合征,其中5例放弃治疗。对19例存活患儿进行随访,随访时间3~70个月,中位随访时间37个月。
二、治疗方法 (一) 营养治疗除5例放弃治疗外,其余19例患儿于术后3~14 d开始微量喂养,喂养量为12~25 mL·kg-1·d-1。10例先尝试母乳喂养,但因对母乳不耐受而改深度水解配方奶喂养;9例因无法母乳喂养而直接行深度水解配方奶喂养。其中3例对牛奶蛋白过敏,且使用深度水解蛋白奶喂养无效,后改为氨基酸配方奶喂养。19例喂养途径均为经鼻胃管持续泵注,并联合经口微量喂养。当持续泵注的肠内营养热卡超过所需能量的50%时,逐渐过渡至间歇泵注,再过渡至经口间歇喂养。
19例均予肠外营养联合肠内营养治疗,基于USBS患儿肠道对肠内营养物质的吸收率低,根据患儿体重增长情况,肠外营养的实际供给量高于目标需求值。3例患儿采取完全植入式静脉输液港输注(totally implantable venous access port, TIVAP),其中2例因反复感染而拆除,1例因脱离肠外营养而拆除,其余16例患儿均采取经外周静脉穿刺中心静脉置管(peripherally inserted central venous catheter, PICC)输注。
(二) 药物治疗19例患儿早期肠道分泌量较大,均常规给予奥美拉唑注射液,其中7例分泌量无明显减少,后应用生长抑素。8例发生小肠细菌过度生长,予甲硝唑及庆大霉素口服或保留灌肠。2例应用生长激素。
(三) 手术治疗7例暂时性USBS患儿中,1例予肠液回输;6例排除手术禁忌后予早期造口回纳,回纳时间为术后30~70 d(分别为术后30 d、32 d、36 d、43 d、45 d、50 d)。12例非暂时性USBS患儿于治疗过程中采取消化道造影评估肠道情况,其中6例行非移植外科手术治疗;2例小肠扩张超过4 cm者行连续横向肠成形术(serial transverse enteroplasty, STEP),其中1例因术后肠管扩张再次行STEP手术;4例造影提示肠道内容物排空快,且无回盲部,予肠管部分倒置术;2例行小肠倒置术(其中1例外院手术),2例行结肠倒置术。
(四) 多学科诊疗对于暂时性USBS,术后经多学科指导营养治疗方案,讨论再次手术时机以及预防并发症的措施,拟定口腔训练及运动训练方案等。对非暂时性USBS,定期评估患儿肠适应情况,调整营养方案;针对已有并发症或并发症预防,采取多学科讨论评估是否需行手术治疗、康复训练等。
结果24例USBS患儿中,7例暂时性USBS于造口回纳后治愈。17例非暂时性USBS患儿中,7例顺利脱离肠外营养达到肠适应,其中4例有完整回盲瓣及结肠,脱离肠外营养年龄为3个月18天至3岁10个月,中位年龄为2岁;5例放弃治疗;5例尚未达到完全肠适应,仍需持续或间断住院治疗。暂时性USBS患儿住院时长及住院费用较非暂时性USBS患儿减少。
7例暂时性USBS中,发生静脉营养相关性胆汁淤积1例。12例非暂时性USBS中,发生静脉营养相关性胆汁淤积8例,其中3例于造口关闭术中同期行胆道冲洗术,术后2例直接胆红素明显下降,1例直接胆红素下降后再次升高(图 1);导管相关感染9例;获得性锌缺乏皮炎3例;维生素D缺乏6例;代谢性骨病2例。2例STEP术后患儿出现消化道出血及不全性肠梗阻。上述患儿经对症处理后均好转。STEP术后肠管直径缩窄至2~2.5 cm,长度增加20% ~50%,患儿大便次数及性状均较前改善,肠内营养物利用率升高,对肠外营养的依赖性降低。
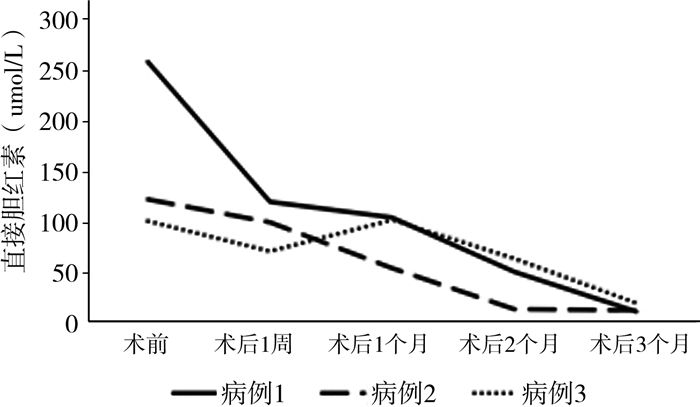
|
图 1 3例非暂时性超短肠综合征患儿胆道冲洗后直接胆红素变化趋势折线图 Fig.1 Alternations of direct bilirubin after biliary tract flushing in 3 non-temporary USBS infants |
19例患儿随访时采用世界卫生组织生长曲线及中国儿童生长发育百分位曲线图进行年龄别体重评估(图 2)。
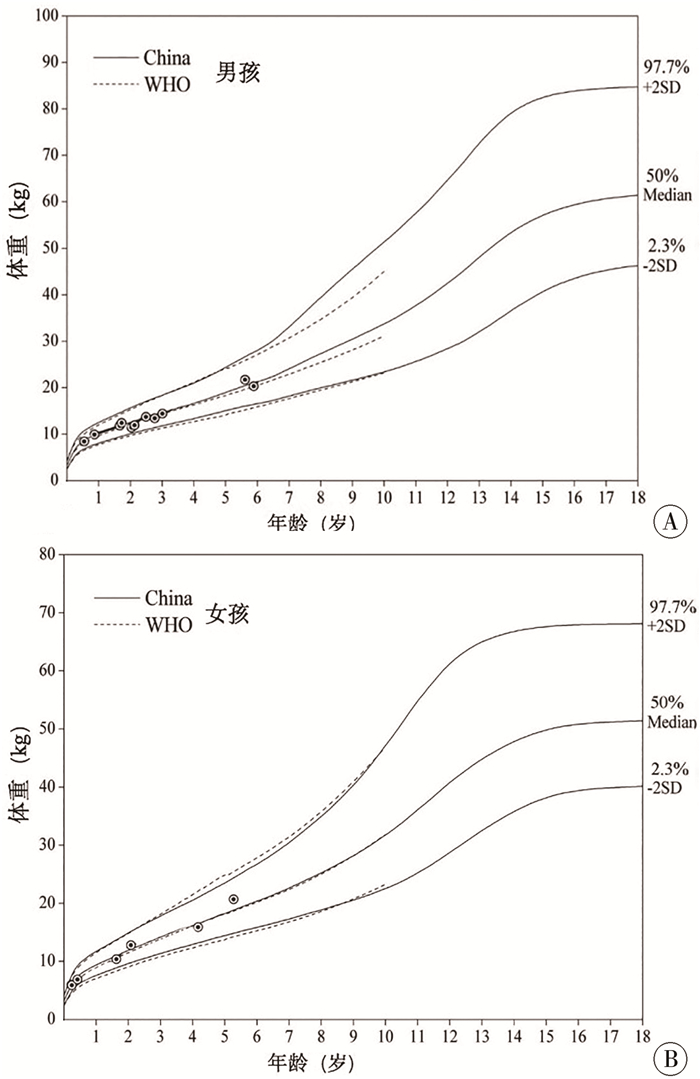
|
图 2 超短肠综合征患儿随访时年龄别体重生长曲线图 Fig.2 Age-specific body weight and growth curves of USBS infants during follow-ups 注 A:男孩;B:女孩 |
短肠综合征的发病率为24.5/100 000[1, 5]。USBS相对少见,其确切发病率目前尚不十分清楚, 文献报道USBS的发病率从6%到29%不等[1, 3]。本中心USBS在SBS中的发病率约为12.8%。USBS与SBS相似,其症状是由于肠切除后营养物质吸收不良及肠运动障碍所引起。患儿可出现腹泻或造口排出量增多、脱水、微量元素缺乏(维生素和矿物质)、呕吐、胃食管反流及体重减轻,且症状较SBS严重[6]。USBS患儿的总体预后与术后肠管残余长度,有无回盲瓣,结肠连续性,造口关闭时间,败血症以及多学科专业团队护理技术有关[1, 3, 6-7]。治疗的最终目标是达到肠适应而脱离肠外营养。文献报道USBS患儿可能需要终身静脉营养或肠移植[3, 7]。由于无法达到肠适应以致其死亡率高于SBS[7]。国外有文献报道USBS的病死率为4% ~53%[2, 7-9]。本研究中除放弃治疗者外,其余患儿暂无一例死亡,且通过治疗,患儿最终脱离静脉营养,达到肠适应。从实现肠适应的病例来看,回盲瓣的存在以及结肠完整性对于早日实现肠适应至关重要。
一、营养治疗USBS患儿因剩余肠管较短,容易流失大量肠液而致电解质平衡失调,其治疗和管理具有挑战性。本中心在开始肠内营养早期对有母乳的10例患儿尝试母乳喂养,但均出现喂养不耐受,经改为深度水解配方奶喂养后好转。当达到肠道耐受及足量肠内营养量时,逐渐增加非水解配方奶粉,以达到更好的肠适应。另外,我们采取的经口微量喂养,对维持口腔技能、保持患儿舒适度和防止口腔反感也有益。
关于静脉营养输注途径的选择,本研究有3例选用TIVAP,16例选用PICC。目前TIVAP已广泛应用于肿瘤化疗治疗中,但TIVAP应用于SBS较罕见,可能是由于较多SBS患儿发病年龄较小,特别是新生儿及婴儿生长发育快,TIVAP放置相对困难,费用高,容易出现导管异位及导管感染等原因,目前仍推荐PICC作为SBS治疗的首选途径[10-11]。TIVAP应用于SBS患儿治疗,仍需要多中心进一步研究探讨。
二、药物治疗USBS患儿由于剩余肠管较短或造瘘位置高,容易发生排泄物质稀、胃肠液排泄量高,我们常规选用奥美拉唑注射液,可抑制50%以上的患儿肠切除术后胃肠液高排出量,对排出量高于100 mL/kg者应用生长抑素,短期治疗有效。此外,通过口服或保留灌肠甲硝唑及庆大霉素等可改善小肠细菌过度生长[1, 12]。此外,有研究表明,替度鲁肽可通过增加绒毛高度、抑制胃酸分泌、减慢肠蠕动以及增加肠道和门静脉血流量,进而改善USBS患儿的肠道吸收[13]。替度鲁肽已获准用于成人,是否可用于儿童目前仍在研究之中。
三、手术治疗对于暂时性USBS患儿,经适当处理、适时关闭造口可以增加肠内营养量,降低静脉营养应用率,并减少静脉营养相关并发症,早期脱离静脉营养,从而达到完全肠适应。在关瘘手术前需考虑是否有肠狭窄发生,文献报道NEC肠狭窄通常发生在术后第4~10周,因此造口关闭时间应尽量推迟至术后4~10周,且患儿体重达到2.5~3.0 kg[14]。本研究中7例暂时性USBS患儿于术后30~70 d关闭造口,术后无肠狭窄发生。因此,对于暂时性USBS,排除手术禁忌后,术后4周即可考虑关闭造口。
SBS患儿残存的肠管会发生结构和功能上的适应性变化,部分患儿经营养治疗后可达到肠适应而脱离静脉营养。但USBS患儿剩余肠管较短,较难达到肠适应,对此可评估患儿肠道情况选择非移植外科手术治疗。
本研究中,患儿在治疗过程中均经全消化道造影评估造影剂在小肠内停留的时间,以及小肠肠管是否扩张。结果显示3例患儿造影剂在小肠内通过时间快、停留时间短,且没有回盲瓣,行肠管倒置术;由于USBS患儿剩余小肠均较短,2例术中取近段5 cm左右结肠行倒置术,1例由于仅剩余小肠,术中选取5 cm末端小肠行倒置术。术后大便次数及性状均明显改善。治疗中有2例因吻合口狭窄存在不全性肠梗阻,经消化道造影发现小肠肠管扩张直径超过4 cm,遂于纠正吻合口狭窄的同时对近段扩张肠管行STEP术。STEP术达到既缩窄扩张肠管又延长小肠长度的双重目的。
四、相关并发症USBS治疗的重点和难点是预防和治疗并发症。本研究中共有13例患儿发生相关并发症(暂时性USBS 1例,非暂时性USBS 12例)。其中最严重和最普遍的并发症是静脉营养相关性胆汁淤积,其危险因素包括早产、胎龄小、败血症早期和复发、小肠细菌过度生长及肠外营养管理不佳(如高葡萄糖输注率及不适当的脂质乳剂和用量)[15]。
研究表明,由于大豆油脂肪乳存在大量植物甾醇,会通过破坏胆汁酸平衡和中断胆汁运输而导致胆汁淤积[6, 15]。鱼油中的ω-3多不饱和脂肪酸具有抗炎作用,不会阻碍胆汁排出,并可能逆转胆汁淤积[15-16]。Olszewska等[3]报道USBS患儿应用含ω-3脂肪酸的鱼油脂肪乳后未出现胆汁淤积,认为鱼油脂肪乳可有效预防胆汁淤积。本中心对USBS患儿首选由大豆油、中链甘油三酯、橄榄油、鱼油组成的多种油脂肪乳,以预防和减少胆汁淤积的发生。对9例发生静脉营养相关性胆汁淤积的患儿,将脂肪乳剂改为暂时性单用ω-3鱼油脂肪乳或ω-3鱼油脂肪乳联合大豆油脂肪乳。另外,3例在行关瘘手术的同时行胆道冲洗术,最终胆红素水平较术前明显下降。我们认为,胆道冲洗对静脉营养相关性胆汁淤积是有利的,但目前文献报道较少,是否对此类患儿行胆道冲洗仍需进一步研究。
本研究中有3例出现获得性锌缺乏皮炎(acquired zinc deficiency dermatitis, AZDD),考虑是由于USBS患儿特别是早产儿,对锌的储备不足,出生后对锌的需求增加,围术期长期禁食导致锌的摄入及吸收受到明显限制,加上肠外营养中锌补充不足,容易导致血清锌水平低下。患儿均发生于术后早期,予输注血浆支持治疗后好转。因此,临床治疗中应注意监测微量元素,尽早识别AZDD并及时治疗,以防止患儿皮肤病损进一步加重,并做到预防新的皮肤病损出现。
本研究中有6例发生维生素D缺乏,其中2例出现代谢性骨病。Hadjittofi等[17]报道通过给SBS模型大鼠补充维生素D发现,维生素D通过上调小肠VDR(VtD receptor)蛋白的表达而促进肠道上皮细胞分化及增生,进而增加SBS大鼠小肠隐窝深度及肠道绒毛高度,促进肠适应。本中心对USBS患儿加大维生素D口服剂量后发现,患儿大便排出量明显增加,故改为维生素D2注射液肌肉注射。因此,USBS治疗过程中需定期监测维生素D水平,预防维生素D缺乏以及代谢性骨病的发生,在治疗初期,肌肉注射维生素D2注射液是最佳选择。
多学科团队协作模式可以制定更加规范、个体化的治疗方案,提高患儿治疗效果,预防、减少并及时治疗相关并发症,从而更有效地实施营养管理,改善患儿生存质量,提高患儿疗效及预后。
尽管USBS治疗困难,治疗过程中相关并发症较多,但合理、有效的营养管理及营养支持可较好地促进剩余肠管的代偿和肠适应,大多数USBS患儿最终可脱离肠外营养而达到完全肠内营养。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 赵晓霞负责文献检索和起草文章;胡书奇、高佳芳、秦琪负责论文设计;赖登明、马东、陈锐、王鹏、韩一江负责数据收集与分析;赵晓霞、汪家莉、吕成杰、黄寿奖负责论文结果撰写和讨论分析;钭金法负责对文章知识性内容进行审阅
| [1] |
Batra A, Keys SC, Johnson MJ, et al. Epidemiology, management and outcome of ultrashort bowel syndrome in infancy[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(6): F551-F556. DOI:10.1136/archdischild-2016-311765 |
| [2] |
Dore M, Junco PT, Moreno AA, et al. Ultrashort bowel syndrome outcome in children treated in a multidisciplinary intestinal rehabilitation unit[J]. Eur J Pediatr Surg, 2017, 27(1): 116-120. DOI:10.1055/s-0036-1597812 |
| [3] |
Olszewska K, Ksiazyk J, Kozlowski D, et al. Nutritional therapy complications in children with ultra-short bowel syndrome include growth deficiency but not cholestasis[J]. Acta Paediatr, 2018, 107(6): 1088-1093. DOI:10.1111/apa.14260 |
| [4] |
颜伟慧, 戴丽娜, 陶怡菁, 等. 新生儿暂时性短肠综合征治疗体会[J]. 中华小儿外科杂志, 2016, 37(11): 837-840. Yan WH, Dai LN, Tao YJ, et al. Management experiences of newborns with temporary short bowel syndrome prior to enterostomy closure[J]. Chin J Pediatr Surg, 2016, 37(11): 837-840. DOI:10.3760/cma.j.issn.0253-3006.2016.11.008 |
| [5] |
Chandra R, Kesavan A. Current treatment paradigms in pediatric short bowel syndrome[J]. Clin J Gastroenterol, 2018, 11(2): 103-112. DOI:10.1007/s12328-017-0811-7 |
| [6] |
Cohran VC, Prozialeck JD, Cole CR. Redefining short bowel syndrome in the 21st century[J]. Pediatr Res, 2017, 81(4): 540-549. DOI:10.1038/pr.2016.265 |
| [7] |
Merritt RJ, Cohran V, Raphael BP, et al. Intestinal rehabilitation programs in the management of pediatric intestinal failure and short bowel syndrome[J]. J Pediatr Gastroenterol Nutr, 2017, 65(5): 588-596. DOI:10.1097/MPG.0000000000001722 |
| [8] |
Norsa L, Artru S, Lambe C, et al. Long term outcomes of intestinal rehabilitation in children with neonatal very short bowel syndrome: parenteral nutrition or intestinal transplantation[J]. Clin Nutr, 2019, 38(2): 926-933. DOI:10.1016/j.clnu.2018.02.004 |
| [9] |
Infantino BJ, Mercer DF, Hobson BD, et al. Successful rehabilitation in pediatric ultrashort small bowel syndrome[J]. J Pediatr, 2013, 163(5): 1361-1366. DOI:10.1016/j.jpeds.2013.05.062 |
| [10] |
Huang JH, Yu Q, Wen J, et al. Peripherally inserted central catheter-related complications in infants with intestinal failure[J]. Asia Pac J Clin Nutr, 2018, 27(6): 1225-1229. DOI:10.6133/apjcn.201811_27(6).0008 |
| [11] |
LaRusso K, Schaack G, Fung T, et al. Should you pick the PICC? Prolonged use of peripherally inserted central venous catheters in children with intestinal failure[J]. J Pediatr Surg, 2019, 54(5): 999-1004. DOI:10.1016/j.jpedsurg.2019.01.052 |
| [12] |
Duggan CP, Jaksic T. Pediatric intestinal failure[J]. N Engl J Med, 2017, 377(7): 666-675. DOI:10.1056/NEJMra1602650 |
| [13] |
Kochar B, Herfarth HH. Teduglutide for the treatment of short bowel syndrome-a safety evaluation[J]. Expert Opin Drug Saf, 2018, 17(7): 733-739. DOI:10.1080/14740338.2018.1483332 |
| [14] |
Al-Hudhaif J, Phillips S, Gholum S, et al. The timing of enterostomy reversal after necrotizing enterocolitis[J]. J Pediatr Surg, 2009, 44(5): 924-927. DOI:10.1016/j.jpedsurg.2009.01.028 |
| [15] |
Norsa L, Nicastro E, Di Giorgio A, et al. Prevention and treatment of intestinal failure-associated liver disease in children[J]. Nutrients, 2018, 10(6): 664. DOI:10.3390/nu10060664 |
| [16] |
Klek S. Omega-3 fatty acids in modern parenteral nutrition: a review of the current evidence[J]. J Clin Med, 2016, 5(3): 34. DOI:10.3390/jcm5030034 |
| [17] |
Hadjittofi C, Coran AG, Mogilner JG, et al. Dietary supplementation with vitamin D stimulates intestinal epithelial cell turnover after massive small bowel resection in rats[J]. Pediatr Surg Int, 2013, 29(1): 41-50. DOI:10.1007/s00383-012-3205-4 |
 2023, Vol. 22
2023, Vol. 22


