肝母细胞瘤(hepatoblastoma, HB)是儿童最常见的肝脏恶性肿瘤,手术完整切除肿瘤仍然是目前主要治疗手段[1]。肝脏肿瘤切除需要遵循的原则是在完整切除肿瘤的同时保证有足够的剩余肝脏,以确保术后肝功能正常[2]。一些巨块型肝脏肿瘤患儿往往因剩余正常肝脏体积不足,导致术后肝功能衰竭的风险较大而丧失手术机会。联合肝脏离断和门静脉结扎二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)于2007年由德国医师Hans Schlitt发明,并于2012年由Schnitzbauer等正式命名[3]。该术式通过分期手术,有效促进剩余正常肝脏体积(future liver remnant, FLR)增长,在因FLR不足而无法手术切除的成人巨块型肝肿瘤中应用广泛。近年来,在儿童巨块型肝脏肿瘤的治疗中,ALPPS手术也得到了一定的应用。2018年笔者所在团队首次报道了1例ALPPS治疗HB[4]。余辉等[5]于2021年报道腹腔镜ALPPS治疗儿童肝脏巨块型间叶错构瘤1例。目前ALPPS在儿童病例中的适应证及临床疗效等仍不确切。本研究回顾性分析在复旦大学附属儿科医院行ALPPS手术治疗的4例HB患儿临床资料,评估ALPPS应用于儿童巨块型肝脏肿瘤的可行性、有效性及安全性。
资料与方法 一、一般资料本研究为回顾性研究。2016年7月至2020年2月,复旦大学附属儿科医院共有4例HB患儿行ALPPS手术(表 1),其中男1例,女3例;手术年龄27~64个月,平均39.5个月。初诊时血甲胎蛋白(alpha fetoprotein, AFP)均超过121 000 ng/mL,肝功能无明显异常。行根治手术前均经肿块活检术明确诊断为HB,其中3例术前经4~7次新辅助化疗,1例未行化疗。影像学检查:病例1病灶位于肝脏左叶,大小约8.7 cm×15.7 cm×14.4 cm,已于2018年报道[4];其余3例病灶位于肝脏右叶,大小分别为12 cm×11.9 cm×12 cm、9.8 cm×6.9 cm×9.3 cm、8 cm×7.5 cm×7 cm。
| 表 1 4例行ALPPS术的HB患儿临床资料 Table 1 Clinical profiles of 4 children with hepatoblastoma undergoing ALPPS |
|
|
患儿术前均应用海信计算机辅助手术系统和三维重建技术计算FLR及其占全肝体积(total liver volume, TLV)的比例,肝功能正常患儿FLR/TLV≤35%,预切除肝容量达到或超过70%;预留肝叶无转移灶;心、脑、肺、肾等系统功能无明显异常。
二、手术方法4例患儿均在全身麻醉下行肝实质离断+门静脉结扎+胆囊切除术。患儿仰卧位,取上腹部肋缘下屋顶切口,先分离第一肝门,结扎胆囊动脉后切除胆囊,解剖肝蒂,选择性结扎右(左)侧门静脉,术中保留右(左)肝动脉及静脉并套以黑色丝线作标记。沿肿瘤边缘0.3~0.5 cm用超声刀、水刀离断肝实质,肝断面予充分止血。肿瘤及剩余肝脏使用无菌袋包裹。术后复查CT评估FLR,若增加明显,则行二期半肝切除术。二期手术自原手术切口入腹,分离粘连后暴露肝门,寻找一期手术标记的肝右(左)动脉及静脉,阻断第一肝门血管后,离断右(左)肝动脉、肝静脉及肝管,同时小心处理各肝短静脉,完全离断肝右(左)叶及肿瘤,完整切除肿瘤。
三、观察指标收集患儿一期及二期手术的术中及术后情况、康复情况以及随访结果。
结果 一、一期手术及术后情况一期手术均为开腹手术,平均手术时间286 min,平均出血量150 mL。其中1例因腹部肿瘤巨大、腹壁切口关闭困难而暂缓关闭,予补片缝合(图 1)。4例术后均于儿童重症监护室(pediatric intensive care unit, PICU)继续治疗,复查肝功能,转氨酶及胆红素于术后第1~2天达峰值后逐渐下降至正常。3例术后第5天复查肝脏CT,1例术后第8天复查肝脏CT,FLR/TLV均增加明显,为35.8% ~163.8%(图 2)。
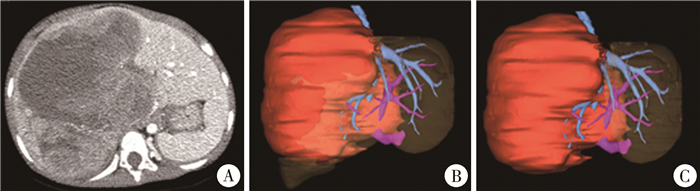
|
图 1 1例肝母细胞瘤患儿术前CT影像及三维重建成像 Fig.1 Preoperative CT image and 3-D reconstructions of one hepatoblastoma child 注 A:术前增强CT显示肝脏肿瘤;B:术前三维重建显示肝脏肿瘤,肿瘤体积1 42 L;C:经术前模拟手术切除右半肝后测得残余肝脏体积为0.22 L,占全肝体积的12% |
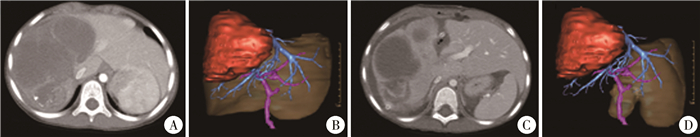
|
图 2 1例肝母细胞瘤患儿术前及术后CT影像及三维重建成像 Fig.2 Preoperative and postoperative CT images and 3-D reconstructions of one hepatoblastoma child 注 A:术前增强CT显示肝脏肿瘤;B:术前三维重建显示肝脏肿瘤,经术前模拟手术切除右半肝后测得残余肝脏体积为0.21 L,占全肝体积的35.1%;C:术后4 d复查增强CT显示肝脏肿瘤;D:术后4 d再次行三维重建显示肝脏肿瘤,测得残余肝脏体积为0.37 L,占全肝体积的61.2%,较术前增长74.6% |
二期手术均采用原手术切口,其中1例为扩大左半肝切除术,3例为扩大右半肝切除术。平均手术时间127 min,平均出血量112mL。行左半肝切除术患儿于二期手术后第7天因胆道梗阻再次手术,术中解除右肝管汇入肝总管处成角, 行肝管空肠Roux-Y吻合。术后2周查肝功能及凝血功能正常;另外3例患儿二期手术后肝功能均恢复良好,无明显围手术期并发症。
三、随访结果4例患儿术后均于本院继续治疗和随访,2例术后行辅助化疗4次后,AFP降至正常,结束治疗,随访至今无明显异常;1例随访过程中出现双侧肺部转移灶,经4次化疗后,AFP水平下降不明显,随访4个月后失访;1例术后化疗4次,随访AFP正常,腹部CT未见肿瘤复发,因右下肢疼痛经检查发现肿瘤,病理活检结果为HB转移及尤文氏样肉瘤,二者鉴别困难,结合患儿AFP及腹部影像资料结果考虑为尤文氏样肉瘤,行右下肢截肢术,术后予长春新碱+阿霉素+环磷酰胺/异环磷酰胺+依托泊苷方案交替化疗,效果欠佳,现仍带瘤生存中。
讨论HB是儿童常见的肝脏恶性肿瘤,其特点是起病隐匿,发展迅速,大部分HB患儿就诊时肿瘤体积巨大,累及多个肝段,其中部分患儿经新辅助化疗后肿瘤体积缩小明显,符合手术标准,但仍有部分患儿术前化疗效果欠佳,术后会面临剩余肝脏体积不足导致肝功能衰竭,因此手术风险极大。而肝移植因手术费用高、治疗周期长、肝源紧张、术后需终身服用免疫抑制剂等原因,并非患儿家长第一选择,ALPPS为HB患儿提供了一种新的手术治疗策略。
自2013年国内首次开展ALPPS治疗FLR不足的肝细胞癌(hepatocellular carcinoma, HCC)至今,多家医疗中心开始了ALPPS的尝试和探索[6]。目前,ALPPS主要应用于成人原发或继发性肝脏肿瘤中因瘤体巨大以致FLR不足,同时不合并门静脉主干癌栓、下腔静脉癌栓及远处转移的病例。对于成人,其适应证为:术前肝功能正常的肝脏(Child A级),FLR/TLV>20%[7];若肝功能异常(如存在梗阻性黄疸、肝纤维化、重度脂肪肝或化学因素导致肝损害等),FLR/TLV可适当增加[8];对于已经合并肝硬化的Child B级患者,理论上要求FLR/SLV>40%。ALPPS目前在国外多用于结直肠肝脏转移瘤,剩余肝质地较好的病例。而国内多用于原发性肝癌,通常合并肝硬化,因此术后常发生肝功能失代偿。在儿童中,由于扩大肝切除手术应用较少,且缺乏对于儿童肝切除后肝衰竭(post hepatectomy liver failure, PHLF)的有效定义,因此目前对于ALPPS术式的适用标准及范围尚无详细的建议,FLR/TLV的最低值也难以确定。Fuchs等[9]、Wiederkehr等[10]、Hong等[11]及Akhaladze等[12]认为,在儿童病例中FLR/TLV的比值在15% ~40%是安全的。但与成人相比,儿童肝母细胞瘤较少合并基础疾病,剩余肝脏质地及功能较好。既往也有研究表明,对于行常规肝脏手术的儿童,其肝功能恢复所需时间较成人少[13]。另外,因肝脏肿瘤通常不具备正常肝脏的功能,因此包含肿瘤在内的肝脏体积并不能代表真正的全肝体积,因此使用全肝体积来计算FLR/TLV是否可以真正代表剩余肝比例及预测剩余肝功能,仍有待商榷。本研究中1例患儿一期手术前FLR/TLV仅12%,但经模拟手术切除肿瘤后,其实际剩余肝体积可达0.22 L,而巨大肿瘤体积达1.42 L(图 1)。该患儿一期手术后因肿瘤巨大导致腹腔关闭困难,切口暂予补片修补。二期手术前,剩余肝体积增长至0.30 L,而FLR/TLV仅16.3%。二期手术后随访肝功能及胆红素均维持在正常水平。
目前成人肝脏肿瘤多使用标准肝脏体积(standard liver volume, SLV)来进行评估[14]。但因儿童生长发育特点,关于SLV的计算方法研究较少,目前仍无统一的计算方法。2013年Herden等[15]对388名儿童进行尸检数据分析,得到了儿童SLV的计算方法为:0~1岁,SLV=-143.063+4.275×身高(cm)+14.788×体质量(kg);1~16岁,SLV=-20.247+3.339×身高(cm)+13.113×体质量(kg)。此外,也有研究使用FLR/体质量来评估剩余肝体积及代偿增长情况,并认为其较剩余肝占全肝比例预测术后PHLF的灵敏度、特异度更高[16-18]。一般认为,FLR/体质量>0.4%是安全的。因此笔者认为,针对术前肝功能正常的儿童,FLR/TLV在15% ~40%可考虑行ALPPS,对于FLR/TLV < 15%的患儿,若考虑肿瘤巨大导致FLR/TLV较小,且无条件行肝移植,可结合FLR/体质量来综合评估是否可行ALPPS术。但在儿童中,无论是利用体质量、SLV还是TLV来评估手术后是否会发生PHLF,仍然需要更多的临床数据来验证。
经典的ALPPS手术主要包括两步,第一步是结扎患侧门静脉分支+原位肝离断术,第二步是将患侧肝脏的肝动静脉离断后行肝脏大部分切除术。本组手术在经典ALPPS的基础上,利用已掌握的对肝脏Glisson鞘的解剖知识和操作技能,对肝血管进行精准解剖;术中高选择性切断支配患肝的血管,充分保留剩余肝门静脉、肝动脉和静脉,并对肝实质进行完整离断。因此术前需充分评估要保留的剩余肝的入肝及出肝血流。本组第1例行左半肝切除术患儿术前经CT评估肿瘤侵犯第二肝门,三支肝静脉均未显影,仅有肝短静脉回流,因肿瘤侵犯,仅保留Ⅴ、Ⅵ段正常肝组织,因此一期手术中离断肝右静脉及肝左静脉,二期手术中也证实肝中静脉内有可疑瘤栓,最终离断肝中静脉,剩余肝回流完全依靠代偿增粗的肝短静脉。另外3例患儿术前评估剩余肝的入肝及出肝血流均未见明显肿瘤侵犯。因此,笔者认为术前应完善B超、CT等辅助检查,充分评估剩余肝的入肝及出肝血流,以降低手术难度和风险,同时可以最大程度保证剩余肝的存活及功能。
本组4例患儿在一期手术后定期复查血常规、肝功能及腹部CT,通过评估患儿有无腹腔感染、肝功能恢复及剩余肝体积增大情况来评估二期手术时机,两次手术间隔时间为6~9 d。二期手术前FLR/TLV增长幅度为35.8% ~163.8%,这使得二期手术中肝肿瘤可以完整切除。第二期手术后除1例肝左叶扩大切除的患儿因胆道梗阻再次手术外,其余3例患儿肝功能在一过性异常后均快速恢复正常。无一例围手术期死亡病例。在一项包含了12例患儿的Meta分析中,ALPPS一期手术后FLR/TLV增长69.4%,术后并发症发生率为25%(3/12)[8]。这也在一定程度上证明了ALPPS可以有效增加剩余肝体积,但同样因为病例数量较少,结果可能存在偏倚。
总之,对于经新辅助化疗治疗后仍无法行一期手术切除的HB,ALPPS是一种可以选择的手术方法。对一期完整切除肿瘤后剩余肝体积不足、术后存在肝衰竭风险,且无条件行肝移植的患儿,可考虑行ALPPS;对于肝功能正常患儿,FLR/TLV在15% ~40%是安全的,对于FLR/TLV小于15%的患儿,可结合FLR/体质量进行评估。术前需通过多种影像学检查充分评估剩余肝的入肝及出肝血流,以保证术后剩余肝的存活及功能。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 刘百慧负责文献检索、论文设计和起草文章;董岿然、董瑞、李凯、肖现民、解鲁璐、姚伟负责数据收集和整理;刘百慧、董岿然、姚伟负责研究结果分析与讨论;董岿然负责对全文知识性内容进行审读与修正
| [1] |
Ng K, Mogul DB. Pediatric liver tumors[J]. Clin Liver Dis, 2018, 22(4): 753-772. DOI:10.1016/j.cld.2018.06.008 |
| [2] |
Tucker ON, Heaton N. The 'small for size' liver syndrome[J]. Curr Opin Crit Care, 2005, 11(2): 150-155. DOI:10.1097/01.ccx.0000157080.11117.45 |
| [3] |
Schnitzbauer AA, Lang SA, Goessmann H, et al. Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings[J]. Ann Surg, 2012, 255(3): 405-414. DOI:10.1097/SLA.0b013e31824856f5 |
| [4] |
姚伟, 董岿然, 肖现民, 等. 联合肝脏离断和门静脉结扎二步肝切除术治疗儿童肝母细胞瘤一例报告[J]. 中华小儿外科杂志, 2018, 39(8): 597-603. Yao W, Dong KR, Xiao XM, et al. Associating liver partition and portal vein ligation for staged hepatectomy for hepatoblastoma: a report of one case[J]. Chin J Pediatr Surg, 2018, 39(8): 597-603. DOI:10.3760/cma.j.issn.0253-3006.2018.08.009 |
| [5] |
余辉, 郑百俊, 高亚, 等. 全腹腔镜ALPPS治疗小儿巨块型肝脏肿瘤[J]. 临床小儿外科杂志, 2021, 20(7): 635-640, 657. Yu H, Zheng BJ, Gao Y, et al. Total laparoscopic ALPPS for massive liver tumor[J]. J Clin Ped Sur, 2021, 20(7): 635-640, 657. DOI:10.12260/lcxewkzz.2021.07.008 |
| [6] |
王征, 樊嘉, 周俭. ALPPS在肝脏外科的应用前景[J]. 肝胆外科杂志, 2015, 23(1): 1-2. Wang Z, Fan J, Zhou J. Application prospects of ALPPS in liver surgery[J]. J Hepatobiliary Surg, 2015, 23(1): 1-2. |
| [7] |
Lim MC, Tan CH, Cai J, et al. CT volumetry of the liver: where does it stand in clinical practice?[J]. Clin Radiol, 2014, 69(9): 887-895. DOI:10.1016/j.crad.2013.12.021 |
| [8] |
Søreide JA, Deshpande R. Reply to: Somatostatin perfusion and modulation of portal inflow after major liver resection: response to "Post hepatectomy liver failure (PHLF)-recent advances in prevention and clinical management"[J]. Eur J Surg Oncol, 2021, 47(8): 2204-2205. DOI:10.1016/j.ejso.2021.03.255 |
| [9] |
Fuchs J, Murtha-Lemekhova A, Rabaux-Eygasier L, et al. Evidence on indications and techniques to increase the future liver remnant in children undergoing extended hepatectomy: a systematic review and meta-analysis of individual patient data[J]. Front Pediatr, 2022, 10: 915642. DOI:10.3389/fped.2022.915642 |
| [10] |
Wiederkehr JC, Avilla SG, Mattos E, et al. Associating liver partition with portal vein ligation and staged hepatectomy (ALPPS) for the treatment of liver tumors in children[J]. J Pediatr Surg, 2015, 50(7): 1227-1231. DOI:10.1016/j.jpedsurg.2014.10.019 |
| [11] |
Hong JC, Kim J, Browning M, et al. Modified associating liver partition and portal vein ligation for staged hepatectomy for hepatoblastoma in a small infant: how far can we push the envelope?[J]. Ann Surg, 2017, 266(2): e16-e17. DOI:10.1097/SLA.0000000000002217 |
| [12] |
Akhaladze D, Uskova N, Rabaev G, et al. A minimally invasive first stage of ALPPS for hepatoblastoma in a child[J]. Ann Hepatobiliary Pancreat Surg, 2020, 24(3): 352-356. DOI:10.14701/ahbps.2020.24.3.352 |
| [13] |
Needham P, Dasgupta D, Davies J, et al. Postoperative biochemical liver function after major hepatic resection in children[J]. J Pediatr Surg, 2008, 43(9): 1610-1618. DOI:10.1016/j.jpedsurg.2007.12.056 |
| [14] |
李富贵, 严律南, 李波, 等. 中国成人标准肝体积评估公式的临床研究[J]. 四川大学学报(医学版), 2009, 40(2): 302-306. Li FG, Yan LN, Li B, et al. Estimation formula of standard liver volume for Chinese adults[J]. J Sichuan Univ (Med Sci), 2009, 40(2): 302-306. DOI:10.3969/j.issn.1672-173X.2009.02.028 |
| [15] |
Herden U, Wischhusen F, Heinemann A, et al. A formula to calculate the standard liver volume in children and its application in pediatric liver transplantation[J]. Transpl Int, 2013, 26(12): 1217-1224. DOI:10.1111/tri.12198 |
| [16] |
Wildhaber BE, Terraz S. Portal vein embolization in children: As good as ALPPS[J]. Ann Hepatobiliary Pancreat Surg, 2021, 25(2): 313-314. DOI:10.14701/ahbps.2021.25.2.313 |
| [17] |
Chun YS, Ribero D, Abdalla EK, et al. Comparison of two methods of future liver remnant volume measurement[J]. J Gastrointest Surg, 2008, 12(1): 123-128. DOI:10.1007/s11605-007-0323-8 |
| [18] |
廖文戈, 彭强, 任清华, 等. 精准肝脏外科理念在儿童肝母细胞瘤中的应用进展[J]. 临床小儿外科杂志, 2021, 20(11): 1082-1085. Liao WG, Peng Q, Ren QH, et al. Application advances of precision liver surgery for pediatric hepatoblastoma[J]. J Clin Ped Sur, 2021, 20(11): 1082-1085. DOI:10.12260/lcxewkzz.2021.11.016 |
 2023, Vol. 22
2023, Vol. 22


