横纹肌肉瘤(rhabdomyosarcoma, RMS)是一种源于向横纹肌分化的原始间叶细胞,并由不同分化程度的横纹肌细胞组成的软组织恶性肿瘤,常见于儿童和青少年,占所有软组织肉瘤的2% ~5%[1]。根据第4版世界卫生组织(World Health Organization, WHO)软组织肿瘤分类横纹肌肉瘤分为4种组织病理学类型:胚胎型、腺泡型、梭形细胞/硬化型及多形型RMS,其中胚胎型横纹肌肉瘤(embryonic rhabdomyosarcoma, EMRS)占80% ~90%,预后相对较好[2-3]。RMS转移常发生在肺、胸膜、骨骼和骨髓等,脑转移较罕见[4-5]。本文报告1例间变性胚胎型横纹肌肉瘤脑转移患儿的诊治过程。
患儿女,1岁7个月,因发现左胸壁肿块二十余天入院,胸部CT提示左胸部皮下软组织肿块,考虑为胸壁横纹肌肉瘤或原始神经外胚层肿瘤,行胸壁肿块切除术(图 1),术后病理诊断提示为间变性ERMS。免疫组织化学染色:MyoD1、Des、SMA、INI-1、syn、Ki-67(50%)均为阳性,S-100、CK均为阴性(图 2A、图 2B、图 2C)。术后评估全身情况,考虑为横纹肌肉瘤Ⅲ期。继续予序贯化疗,具体化疗方案为VAC方案(长春地辛+吡柔比星+卡铂)与VIE方案(长春地辛+异环磷酰胺+依托泊苷)交替,共12个疗程,期间根据患儿身高体重及化疗前评估情况调整化疗药物剂量,共持续化疗11个月[6]。本研究经浙江大学医学院附属儿童医院伦理委员会审批通过(2023-IRB-0286-P-01)。

|
图 1 横纹肌肉瘤患儿胸部CT平扫见左锁骨下方及腋前方软组织肿块密度影 Fig.1 Chest routine scan revealed left chest wall soft tissue mass |
|
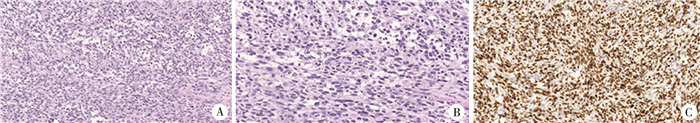
图 2 胸壁原发部位肿瘤组织化学染色 Fig.2 Histochemical stain of primary chest wall tumor 注 A: 胸壁肿瘤细胞成片分布,细胞核圆形或短梭形,可见瘤巨细胞(HE染色,200×);B: 细胞核圆形或梭形,部分黏液样变,局部细胞异型性明显(HE染色,400×);C: 免疫组化Envision二步法MyoD1+,肿瘤脑转移组织学染色 |
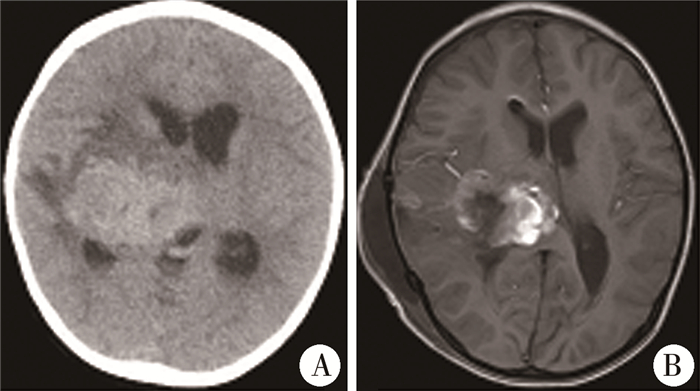
结束化疗后4月余,患儿出现颅高压症状、左侧肢体功能障碍(步态不稳、行走左偏、左侧肢体肌力Ⅳ级)及双眼右斜视,头颅CT(图 3A)提示右侧基底节区占位伴周围大片水肿,可能为转移瘤,入院行右侧丘脑肿瘤切除;术后MR(图 3B)提示右侧丘脑后方及颞叶不规则斑片状混杂信号,范围较术前缩小。术后颅高压症状缓解,左侧肢体活动改善(左侧肢体肌力Ⅳ+级),双眼右斜视未改善。病理提示间变性胚胎型横纹肌肉瘤脑转移。免疫组织化学染色:MyoD1、Des、VIM、S-100、INI-1、syn、NF均为阳性。术后行全脑放疗,放疗方案为:全脑剂量20 Gy,分10次照射,单次剂量2 Gy,1周5次;术区放疗剂量加至50 Gy,分25次照射,单次剂量为2 Gy。
|
图 3 胚胎型横纹肌肉瘤脑转移手术前后头颅影像对照 Fig.3 Comparison of imaging features before and after surgery for rhabdomyosarcoma brain metastasis 注 A: 术前头颅CT提示右侧基底节区占位伴周围大片水肿,转移瘤可能;B: 术后MR见右侧丘脑及颞叶不规则大片状信号影,右侧侧脑室变窄 |
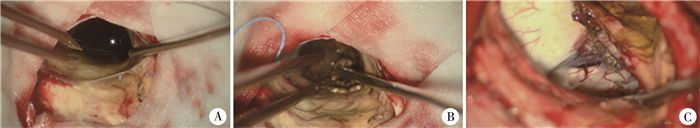
全脑放疗后继续予3次化疗,依次为长春地辛+异环磷酰胺方案、长春地辛+吡柔比星+依托泊苷方案、长春地辛+卡铂+放线菌素D化疗方案[7]。该患儿第一次RMS颅脑转移手术后4个月再次因颅内残余导致肿瘤复发,接受再次手术干预(显微镜下颅脑病变切除术、脉络丛灼烧术及蛛网膜下腔造瘘术)缓解颅高压症状(图 4)。术后患儿颅高压症状明显改善,复查颅脑MR提示右侧丘脑气体影,大片状液性信号,延伸至颅脑表面,右侧侧脑室扩张,未见明显颅内占位;侧脑室三角区扩张较前明显缩小。病理提示右大脑恶性肿瘤符合间变性胚胎型横纹肌肉瘤脑转移,免疫组化:INI-1、Ki67(3%)均为阳性,MyoD1、MYOGENIN、Des、CE、EMA、GFAP均为阴性。术后继续化疗3次(第2次脑转移手术后随访3个月)未见肿瘤复发。
|
图 4 胸壁横纹肌肉瘤脑转移患儿显微镜颅脑肿瘤切除手术过程图 Fig.4 Cerebral tumor resection under a microscope 注 A: 肿瘤位置暴露;B: 切除肿瘤; C: 蛛网膜下腔造瘘,打通颞角与环池 |
讨论 RMS分为4种组织病理学类型,胚胎型预后相对较好。在RMS分子分型特点中,ERMS比腺泡型肿瘤具有更多的变异结构[8]。ERMS多发生于8岁以下儿童,原发位置包括头颈部、泌尿生殖道及腹膜后,常见转移部位包括肺、胸膜、骨骼及骨髓,发生脑转移的病例罕见。发生脑转移最常见症状是头痛、恶心、呕吐、视力障碍、言语困难和无力[5]。本例由于颅内右丘脑基底节区转移占位,患儿出现肢体活动障碍。对于RMS脑转移颅内占位、颅内高压及颅脑压迫症状明确的患儿,国内外研究者多采用手术干预以改善患儿生活质量,同时可结合立体定向放射治疗、放疗、全身或鞘内化疗方案的综合治疗手段[9]。
本例脑转移为单个病灶,存在明显颅高压症状(浅昏迷)及颅内占位压迫症状,故第一次颅脑手术应在保全重要结构前提下尽可能达成肿瘤全切手术。再次复发出现明显颅高压症状(头痛、呕吐),头颅MR提示右侧侧脑室三角区、颞角、枕角明显扩张,考虑为孤立侧脑室[10]。孤立侧脑室的治疗包括动态观察、脑室镜造瘘术以及颞角腹腔分流术[10-12]。本例采用显微镜颅脑病变切除、脉络丛灼烧以及蛛网膜下腔造瘘的手术方式,因患儿出现恶性肿瘤脑转移术后颅高压症状,头颅MR示颅内复发并孤立侧脑室,缓解颅高压症状及颅内占位切除为主要治疗目的。经第一次颅内占位切除手术;术前MR提示存在孤立侧脑室,予脉络丛灼烧术减少脑脊液分泌;行肿瘤位置与环池造瘘(见术后MR),改善脑脊液循环(蛛网膜下腔造瘘)从而有效减缓颅高压。缓解颅高压症状s可选择其他手术方式,基于该患儿病情及综合治疗考量,笔者认为行脑室腹腔分流术会增加肿瘤转移风险,脑室储液囊埋置术仅作为一种姑息性治疗,且鞘内化疗风险大,同时以上两种引流术可能增加颅内感染风险。因此,对于恶性肿瘤脑转移患者,如颅脑手术获益较大,或者出现颅高压症状对患儿生命存在威胁时,合理手术方式对改善患者生存预后及生活质量有重大意义。
VAC-IE的交替化疗方案已成为中高危组小儿非转移性RMS的标准化疗方案,卡铂、伊立替康、托泊替康和长春瑞滨等治疗转移性、复发性或难治性RMS儿童患者有明显效果[6-7]。本例应用全身化疗及颅脑放疗对治疗RMS脑转移存在显著意义,脑转移二次手术后病理结果显示,胸壁原发横纹肌肉瘤Ki67增值速度有明显降低。相关研究报道,对于出现颅内转移或软脑膜侵犯的RMS患儿,放射治疗效果不佳,可行大剂量甲氨蝶呤化疗[13]。本例患儿经过常规综合治疗,接受2次颅脑手术后随访3月余未见肿瘤复发,故未予甲氨蝶呤等化疗方案。
总之,RMS侵袭性强,约90%出现RMS脑转移的患儿存在肿瘤广泛传播的迹象[14]。对于RMS出现脑转移应予重视,定期行头颅筛查。综合治疗方案的选择(包括手术及放化疗)对于控制RMS脑转移极其重要,可有效提高患者存活率。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 彭丽、沈志鹏负责研究的设计、实施和起草文章;彭丽进行病例数据收集及分析;彭丽、王金湖负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Ferrari A, Dileo P, Casanova M, et al. Rhabdomyosarcoma in adults: a retrospective analysis of 171 patients treated at a single institution[J]. Cancer, 2003, 98(3): 571-580. DOI:10.1002/cncr.11550 |
| [2] |
Rudzinski ER, Teot LA, Anderson JR, et al. Dense pattern of embryonal rhabdomyosarcoma, a lesion easily confused with alveolar rhabdomyosarcoma: a report from the Soft Tissue Sarcoma Committee of the Children's Oncology Group[J]. Am J Clin Pathol, 2013, 140(1): 82-90. DOI:10.1309/AJCPA1WN7ARPCMKQ |
| [3] |
Ognjanovic S, Linabery AM, Charbonneau B, et al. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005[J]. Cancer, 2009, 115(18): 4218-4226. DOI:10.1002/cncr.24465 |
| [4] |
Shweikeh F, Bukavina L, Saeed K, et al. Brain metastasis in bone and soft tissue cancers: a review of incidence, interventions, and outcomes[J]. Sarcoma, 2014, 2014: 475175. DOI:10.1155/2014/475175 |
| [5] |
De B, Kinnaman MD, Wexler LH, et al. Central nervous system relapse of rhabdomyosarcoma[J]. Pediatr Blood Cancer, 2018, 65(1): e26710. DOI:10.1002/pbc.26710 |
| [6] |
Arndt CAS, Hawkins DS, Meyer WH, et al. Comparison of results of a pilot study of alternating vincristine/doxorubicin/cyclophosphamide and etoposide/ifosfamide with IRS-Ⅳ in intermediate risk rhabdomyosarcoma: a report from the Children's Oncology Group[J]. Pediatr Blood Cancer, 2008, 50(1): 33-36. DOI:10.1002/pbc.21093 |
| [7] |
Dharmarajan KV, Wexler LH, Wolden SL. Concurrent radiation with irinotecan and carboplatin in intermediate- and high-risk rhabdomyosarcoma: a report on toxicity and efficacy from a prospective pilot phase Ⅱ study[J]. Pediatr Blood Cancer, 2013, 60(2): 242-247. DOI:10.1002/pbc.24205 |
| [8] |
Chen X, Stewart E, Shelat AA, et al. Targeting oxidative stress in embryonal rhabdomyosarcoma[J]. Cancer Cell, 2013, 24(6): 710-724. DOI:10.1016/j.ccr.2013.11.002 |
| [9] |
Parasuraman S, Langston J, Rao BN, et al. Brain metastases in pediatric Ewing sarcoma and rhabdomyosarcoma: the St.Jude Children's Research Hospital experience[J]. J Pediatr Hematol Oncol, 1999, 21(5): 370-377. DOI:10.1097/00043426-199909000-00007 |
| [10] |
郝淑煜, 田润发, 于兰冰, 等. 孤立颞角综合征三例报告并文献复习[J]. 中华神经外科杂志, 2016, 32(12): 1263-1265. Hao SY, Tian RF, Yu LB, et al. Solitary temporal horn syndrome: a report of 3 cases with a literature review[J]. ChinJ Neurosurg, 2016, 32(12): 1263-1265. DOI:10.3760/cma.j.issn.1001-2346.2016.12.016 |
| [11] |
Chen CC, Kasper EM, Zinn PO, et al. Management of entrapped temporal horn by temporal horn to prepontine cistern shunting[J]. World Neurosurg, 2013, 79(2): 404. e7-404.10. DOI:10.1016/j.wneu.2011.02.025 |
| [12] |
Krähenbühl AK, Baldauf J, Gaab MR, et al. Endoscopic temporal ventriculocisternostomy: an option for the treatment of trapped temporal horns[J]. J Neurosurg Pediatr, 2013, 11(5): 568-574. DOI:10.3171/2013.2.PEDS12417 |
| [13] |
Pappo AS, Bowman LC, Furman WL, et al. A phase Ⅱ trial of high-dose methotrexate in previously untreated children and adolescents with high-risk unresectable or metastatic rhabdomyosarcoma[J]. J Pediatr Hematol Oncol, 1997, 19(5): 438-442. DOI:10.1097/00043426-199709000-00006 |
| [14] |
Rodriguez-Galindo C, Hill DA, Onyekwere O, et al. Neonatal alveolar rhabdomyosarcoma with skin and brain metastases[J]. Cancer, 2001, 92(6): 1613-1620. DOI:10.1002/1097-0142(20010915)92:6<1613::aid-cncr1487>3.0.co;2-n |
 2023, Vol. 22
2023, Vol. 22



