2. 南华大学儿科学院 湖南省儿童医院, 长沙 410007
2. Faculty of Pediatrics, Hengyang Medical School, University of South China, Changsha 410007, China
儿童肾透明细胞肉瘤(clear cell sarcoma of kidney, CCSK)是一种十分罕见的恶性肿瘤,占儿童肾脏恶性肿瘤的3% ~5%[1]。CCSK(尤其是中晚期患者)推荐化疗、手术和放疗为主的综合治疗方案[2]。儿童CCSK合并下腔静脉瘤栓(inferior vena cava tumor thrombus, IVCTT)罕见[3-7]。湖南省儿童医院收治1例儿童CCSK,在穿刺确诊后行肾肿瘤切除并下腔静脉瘤栓取出术,下腔静脉瘤栓复发后行部分腔静脉并瘤栓切除术,术后恢复良好。本文对该例患儿的临床资料进行总结,并对相关文献进行分析,旨在探讨儿童肾透明细胞肉瘤合并下腔静脉瘤栓并瘤栓复发的临床特点、诊治及预后。
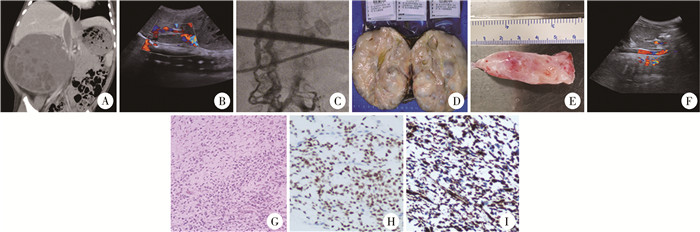
病例资料 一、本例患儿首诊临床资料患儿,男,1岁3个月,于2020年5月19日以“发热、血尿3天”为主诉来本院就诊,以“腹部肿物性质待查,考虑右肾肿瘤”收入院。既往无肿瘤病史及家族史。个人史、生长发育史无特殊。体查:血压142/93 mmHg(1 mmHg=0.133 kPa),腹部柔软,无压痛、反跳痛,右上腹似可扪及一直径约10 cm肿块,边界欠清,质中,活动度可。腹部CT:右侧肾区可见一巨大肿块影,边界稍欠清,大小约12.2 cm×9.9 cm×8.9 cm,密度不均,CT值为8~53 HU,肿块不均匀强化,周围器官明显受压。下腔静脉肝下段扩张,可见低密度影充填,呈不均匀强化,腹膜后可见多发稍大淋巴结影(图 1A)。下腔静脉超声:右肾静脉汇合以上下腔静脉及肝后段下腔静脉内充满低回声团块,长约53 mm,宽约16 mm(图 1B)。肺部、头部平扫+增强CT提示肺间质炎症改变。
|
图 1 接受右侧肾肿瘤根治术+下腔静脉切开瘤栓取出术的肾透明细胞肉瘤患者的影像、病理图片 Fig.1 CT and pathological images of renal clear cell sarcoma patients undergoing right renal tumor radical surgery and inferior vena cava incision thrombectomy 注 A: 腹部CT示右肾区巨大肿物,下腔静脉内低密度影充盈,周围器官受压;B: 彩超示下腔静脉内低回声团块充盈;C: DSA示造影剂在下腔静脉中断,从椎静脉丛回流;D: 切除肿瘤大体标本;E: 切开腔静脉取出瘤栓;F: 瘤栓取出后食道彩超证实腔静脉血流通畅;G: 肿瘤细胞显微镜下图像(HE染色×100);H: 肿瘤细胞核BCOR染色(2+);I: 肿瘤细胞浆Vimtin染色(3+) |
2020年6月在B超定位下行右肾肿瘤穿刺活检术,病理检查结果:BCOR基因异常的肾透明细胞肉瘤,结合影像学检查确诊为“右肾透明细胞肉瘤Ⅲ期;下腔静脉瘤栓Ⅲ级”(Mayo分级:0级, 肾静脉瘤栓;Ⅰ级, 瘤栓距肾静脉开口≤2 cm;Ⅱ级, 距肾静脉开口>2 cm但低于肝静脉;Ⅲ级, 在肝静脉内但低于膈肌;Ⅳ级, 高于膈肌)[8]。确诊后予化疗(环磷酰胺、阿霉素、长春新碱、依托泊苷、多柔比星)4个周期,口服卡托普利降血压。瘤体内可见大量坏死组织,肿瘤及瘤栓体积未见明显缩小。于2020年11月手术:下腔静脉数字减影血管造影(digital subtraction angiography,DSA)见髂静脉汇入下腔静脉口后远端未显影,双侧大量侧支循环形成,经脊柱旁静脉回流至奇静脉入右心房;下腔静脉肝静脉汇合口可见充盈缺损(图 1C);行倒T切口开腹,游离肾周后行肿瘤根治术,术中见肿瘤大小约13 cm×12.5 cm×10 cm,包膜完整,灰粉间暗紫色,质软。右侧肾门、下腔静脉旁可见直径约1 cm肿大淋巴结;裸化腔静脉及其重要分支后阻断;切开下腔静脉,取出瘤栓后缝合血管、松阻断钳,清扫肾周淋巴结后关腹(图 1D至图 1F)。
常规病理检查结果(HE染色):符合肾透明细胞肉瘤特征,区域囊性变,肿瘤侵犯肾脏实质未突破被膜,侵犯肾盂壁;肾窦及肾门血管未见肿瘤成分;下腔静脉瘤栓为肿瘤成分;输尿管切缘及右肾静脉旁淋巴结(0/1)未见肿瘤细胞。免疫组化结果:Ki-67(20%)、Vim(3+)、CyclinD1(2+)、BCOR(2+)、CD56(+)、INI-1(2+)(图 1G至图 1I)。
术后予上海新华医院放疗6个疗程:瘤床(含腔静脉)10.8 Gy/6Fx。在本院化疗4个疗程(环磷酰胺、阿霉素、长春新碱、依托泊苷、多柔比星)。2021年2月结束治疗,5月PET-CT提示①右肾切除术后改变,局部未见明显软组织肿块及异常放射性浓聚影;②全身其他部位未见异常。患儿处于肿瘤完全缓解状态。
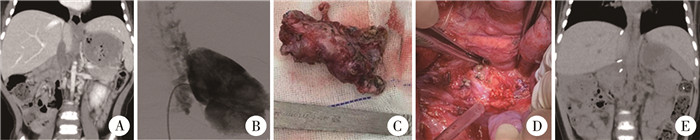
二、本例患儿复发后诊治临床资料2022年3月在本院复诊查腹部CT:静脉期示下腔静脉肝段上部变窄,下部及肝下段部分未见造影剂充盈,其下方见较多血管影(图 2A)。提示腔静脉瘤栓复发。术前下腔静脉DSA见下腔静脉位于L1/2水平受阻,造影剂汇入双侧椎静脉丛,最后汇入上腔静脉。左侧肾静脉远段未汇入下腔静脉,经肾周静脉丛进入半奇静脉(图 2B)。于原手术切口开腹,游离肾周、肝周、下腔静脉周围粘连;术中超声确保瘤栓位于各血管阻断带以内;阻断瘤栓近、远端腔静脉后观察腹腔内各脏器无淤血,侧支循环良好;于第二肝门水平下- 左肾静脉水平下2 cm段一同切断下腔静脉及瘤栓,断端缝闭,关腹(图 2C至图 2D)。患儿术后化疗5个疗程,定期随诊,术后3个月复查腹部CT未见肿瘤及瘤栓复发(图 2E)。现术后6月余,一般情况好,浅表淋巴结无肿大,肝脾未扪及,移动性浊音阴性,无腹痛、下肢水肿、静脉曲张等症状。
|
图 2 接受部分腔静脉并瘤栓切除术的肾透明细胞肉瘤患者影像学及手术图片 Fig.2 Intraoperative findings of patients undergoing partial inferior vena cava resection and tumor thrombectomy 注 A: 2022年3月CT示瘤栓复发于下腔静脉肝及肝下部分;B: 术中DSA见造影剂由左肾静脉汇入半奇静脉;C: 术中切除的瘤栓及部分下腔静脉;D: 瘤栓及部分腔静脉切除后显露的部分腹腔后壁;E: 术后3个月复查瘤栓完整切除,未复发 |
检索PubMed、Web of Science、万方医学网、中国知网等数据库。检索关键词:透明细胞肉瘤(clear cell sarcoma)、瘤栓(thrombus)和儿童(pediatric)为检索词;检索时间不限。文献纳入标准:①病理结果确定为CCSK,且合并IVCTT的个案报道或病例报道或论著提及此症等文献;②年龄小于18岁;③有较为全面的诊疗经过。排除标准:仅简要笼统描述存在此症的患儿,而无具体临床资料。
共获得9篇符合要求文献报道11例CCSK合并IVCTT患儿,其中男7例,女4例。平均诊断年龄7岁10个月(1岁11个月至14岁)。CCSK位于左侧4例,右侧7例;8例瘤栓侵入右心房;9例行肾肿瘤根治切除及腔静脉切开取栓(其中5例在体外循环下取栓),2例手术方式不详;除1例放弃治疗外,其余10例均在术前和(或)术后行放疗和(或)化疗。中位随访时间16个月(1.5~36个月),3例出现转移或复发。
讨论CCSK最常见于2~4岁的儿童,男女患病比约为2 ∶ 1。最常见的转移部位是脑、骨骼和肺[9]。CCSK作为发病率仅次于肾母细胞瘤(Wilms tumor, WT)的小儿肾肿瘤,在临床及影像学表现上与WT有着许多相似之处,包括腹部包块、肉眼血尿,偶可见腹部疼痛[10]。CCSK的CT图像可表现为巨大团块状不均匀密度影,局部与正常肾分界不清,肾包膜界限与周围组织分界清楚,增强后呈不均匀强化,邻近胃肠道等器官受压。遗憾的是,没有任何影像学特征能准确区分CCSK与其他儿童肾肿瘤,确诊需依靠病理检查[5]。本例患儿以腹部包块及血尿入院,腹部CT提示右肾占位。CCSK的治疗通常是根治性肾切除术联合化疗,手术困难者常在穿刺活检明确病因后予以新辅助化疗降低手术难度。表 1中病例3~7在穿刺活检确诊后行新辅助化疗,病例5、7、9新辅助化疗后肿瘤及瘤栓均未见缩小,对化疗不敏感的特点与本例相同。突出的是病例3在新辅助化疗12周后,肿瘤体积缩小82%,提示在患者身体状况良好、肿瘤有减小趋势的前提下,可适当将延长术前化疗周期。按照美国肾母细胞瘤研究组(National Wilms' Tumor Study Group, NWTSG) 方案,本例经活检确诊Ⅲ期的CCSK患儿按CCCG-WT-2009(3)方案治疗[11]。基于既往经验,Ⅲ期及以上肾肿瘤周围及腹膜后淋巴结转移患者于术中行腹膜后及肾周淋巴结清扫。本例术前已确认患儿肿瘤分期Ⅲ期,大范围淋巴结病理活检不会改变术后治疗方案[12]。
| 表 1 儿童肾透明细胞肉瘤并下腔静脉瘤栓文献报道 Table 1 Clinical data of children with CCSK and inferior vena cava tumor thrombus |
|
|
CCSK有较强的侵袭性,易远处转移,术前应行全身骨扫描、头颅CT等检查以确保诊断分期正确[13]。CCSK复发率较高,文献报道复发率为15% ~39%[2]。脑是最常见的复发部位,其次是骨,大约30%的CCSK在诊断后2年以上复发,定期规律的复诊有助于早期发现异常、减少再治疗的难度[14]。本例患儿复发并没有出现明显临床表现,原因可能在于肿瘤缓慢增长以致侧支循环代偿。提示儿童恶性肿瘤复查过程中,不仅要关注其原发病灶有无症状,更要着眼全身进行细致问诊及查体与影像学检查。
少数CCSK可并发下腔静脉瘤栓,Zamperlini-Netto等[6]在2016年回顾了12例CCSK患儿的临床资料,约8.3%出现了腔静脉瘤栓;胡慧敏等[7]的一项回顾性研究中,约20.0%的CCSK合并肾静脉/腔静脉瘤栓。下腔静脉瘤栓是指肿瘤延伸转移至下腔静脉血管腔内,临床症状取决于肿瘤延伸的部位以及阻塞下腔静脉的程度[15]。下腔静脉瘤栓的具体分期及大致形态,需B超、MRI及CT共同评估。MRI和CT有其局限性,不能很好地反映腔静脉侧支循环情况,亦不能判断其具体阻塞程度。而腔静脉DSA可以通过造影剂完全模拟血液流经腔静脉的情况,以观察其阻塞程度并帮助核对瘤栓分级,更为重要的优势是对侧支循环的评估和手术方案的设计有指导作用[16]。血管造影通常使用高压注射器,可能增加部分瘤栓脱落的风险,因此在DSA前可通过血管内置入球囊等方式防止术中瘤栓脱落导致肺栓塞等不良后果。儿童较成人对X线损害更为敏感,DSA操作过程中需注意控制辐射剂量,遮挡腺体等敏感部位,减少曝光时间及范围,以减少辐射对儿童生长发育的影响。
下腔静脉瘤栓的存在,极大提升了手术难度。目前肾肿瘤合并下腔静脉瘤栓的最佳手术方案是肾肿瘤根治切除加下腔静脉切开取瘤栓[17]。根据瘤栓分级的不同,其手术方式、手术难度、出血量、术后并发症也不同。本例瘤体巨大,Ⅲ级瘤栓位置高,首次手术我们计划在裸化下腔静脉后,采用轻轻向下挤压瘤栓头的方式将瘤栓降级以降低手术难度,然后切开取栓[18]。在确保手术效果的同时,避免因使用体外循环及大量肝素给患者带来的不良反应,降低手术风险。但术中我们发现,CCSK瘤栓较以往的WT对静脉壁粘连更为紧密,难以推动,本例瘤栓顶部距膈平面的空间仍可放入阻断钳,使得手术可不使用体外循环取栓方案。瘤栓与血管壁粘连紧密主要在腔静脉右肾静脉交汇区域,该部分瘤栓主要采用剪切的方式,在不损伤腔静脉的前提下于肉眼完全切除瘤栓,但此法难以保证切缘阴性,强调结合术后放化疗防止肿瘤生长及复发。
有研究显示手术切除实现切缘阴性手术可使腹膜后恶性肿瘤合并下腔静脉瘤栓的部分患者长期生存[19]。对于肿瘤浸润血管壁的情况,采用静脉切开取栓术会延长手术时间,且难以保证切缘阴性,因此为遵循肿瘤完整根治切除原则,被浸润的血管节段不得不切除。下腔静脉离断的指征包括静脉壁侵犯,肿瘤与血管内皮严重粘连,下腔静脉管腔完全梗阻以及存在远心端长段血栓[16]。在满足手术指征的同时,确保患者无重要器官功能衰竭是手术成功的基础。术中食道超声配合术前腔静脉DSA, 有助于在保护侧支循环主干的前提下准确判断腔静脉切除范围。目前对于下腔静脉切除后是否均需要重建仍存在争议,手术方式分为完全离断和部分离断加下腔静脉重建两种[16]。本例两次术前腔静脉DSA均发现下腔静脉部分节段未显影,同时侧支循环通畅,病程中始终未见腔静脉堵塞相关典型症状,故推测瘤栓缓慢增长,至完全堵塞时椎静脉丛、奇静脉等侧支循环已近乎全部代偿。
叶剑飞等[20]在一项单中心研究中回顾分析了17例因肾肿瘤瘤栓行腔静脉节段切除术的病例,其中6例出现了腔静脉节段切除相关术后并发症(3例下肢深静脉血栓、2例肌酐升高、1例布加综合征所致凝血功能下降),血栓和肌酐升高在经过抗凝、血液透析等对症治疗后于2周左右恢复,短期随访2例有双下肢水肿。Lifante等[21]对下腔静脉部分切除术患者进行最长达15年的随访,期间患者持续接受抗凝治疗,无复发及后遗症。Daylami等[22]的一项研究中,3例腔静脉部分切除术后出现急性肾衰竭的患者年龄均大于80岁(出院前均好转),所以老年人肾功能衰退可能是术后出现急性肾功能衰竭的主要原因。因为儿童的肾功能在1岁半左右接近成人水平,孤立肾的肾脏功能(总肾小球滤过率、24 h尿蛋白)可长期保持稳定,并未出现恶化趋势[23]。此结论虽然有一定的理论依据,但详细机制仍不明确,需要大量临床研究加以证明。本例患儿虽然在术后短期随访期间暂未出现上述并发症,仍需长期观察。此外,Grimaldi等[24]在一项单中心研究中,对4例肿瘤包绕下腔静脉的患儿进行了下腔静脉部分切除并置换人工血管,3例重新获得了腔静脉血流,预后良好。这表明当儿童腹膜后肿瘤侵犯腔静脉时,置换人工血管的方案是可行的。但出于人工血管支架会增加手术费用、延长手术时间,且存在人工血管血栓、排异反应风险等考虑,不建议将其作为首选方案。
综上所述,本例儿童肾透明细胞肉瘤合并腔静脉瘤栓、瘤栓复发行二次手术;在今后面临CCSK合并瘤栓时,如满足下腔静脉离断指征,果断连同瘤栓一并切除,以最大程度满足手术“无瘤原则”,达到治愈目的。重建下腔静脉的手术方式更符合生理解剖,但目前仍面临着诸多并发症和风险(尤其是儿童),在医用人工材料方面仍有巨大的进步空间。随着肿瘤免疫靶向等生物技术的不断进步,我们对CCSK的认识将不断加深,使得肿瘤和瘤栓在术前能够显著缩小,这将极大降低手术难度,减少手术损伤,提高患者的存活率。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 起草文章、获取研究经费为宁峰;采集分析数据、修写文章为龙兴宇;指导、支持贡献为王智、殷波、王侃;对文章知识性内容审阅并指导为何军
| [1] |
El Kababri M, Khattab M, El Khorassani M, et al. Clear cell sarcoma of the kidney.A study of 13 cases[J]. Arch Pediatr, 2004, 11(7): 794-799. DOI:10.1016/j.arcped.2004.02.023 |
| [2] |
Gooskens SL, Graf N, Furtwängler R, et al. Position paper: rationale for the treatment of children with CCSK in the UMBRELLA SIOP-RTSG 2016 protocol[J]. Nat Rev Urol, 2018, 15(5): 309-319. DOI:10.1038/nrurol.2018.14 |
| [3] |
Hiradfar M, Zabolinejad N, Shojaeian R, et al. Pediatric clear cell sarcoma of the kidney with atriocaval thrombus[J]. Pediatr Surg Int, 2012, 28(11): 1141-1145. DOI:10.1007/s00383-012-3160-0 |
| [4] |
高宇奎. 儿童肾透明细胞肉瘤(CCSK)的诊断与治疗[D]. 郑州: 郑州大学, 2019. Gao YK. Diagnosis and Treatment of CCSK (clear cell sarcoma of kidney) in children[D]. Zhengzhou: Zhengzhou University, 2019. |
| [5] |
Smets AM, de Kraker J. Malignant tumours of the kidney: imaging strategy[J]. Pediatr Radiol, 2010, 40(6): 1010-1018. DOI:10.1007/s00247-010-1584-z |
| [6] |
Zamperlini-Netto G, Zanette A, Wehbi E, et al. PO-60-renal tumors with extensive vascular disease: management challenges in a pediatric series from the hospital for sick children[J]. Thromb Res, 2016, 140(Suppl 1): S198-S199. DOI:10.1016/S0049-3848(16)30193-1 |
| [7] |
胡慧敏, 张伟令, 黄东生, 等. 中晚期儿童肾透明细胞肉瘤10例的诊治及预后分析[J]. 中华实用儿科临床杂志, 2020, 35(5): 370-374. Hu HM, Zhang WL, Huang DS, et al. Diagnosis, treatment and prognosis of advanced clear cell sarcoma of kidney: a report of 10 cases[J]. Chin J Appl Clin Pediatr, 2020, 35(5): 370-374. DOI:10.3760/cma.j.cn101070-20190607-00506 |
| [8] |
Blute ML, Leibovich BC, Lohse CM, et al. The Mayo Clinic experience with surgical management, complications and outcome for patients with renal cell carcinoma and venous tumour thrombus[J]. BJU Int, 2004, 94(1): 33-41. DOI:10.1111/j.1464-410X.2004.04897.x |
| [9] |
Gooskens SLM, Furtwängler R, Vujanic GM, et al. Clear cell sarcoma of the kidney: a review[J]. Eur J Cancer, 2012, 48(14): 2219-2226. DOI:10.1016/j.ejca.2012.04.009 |
| [10] |
de la Monneraye Y, Michon J, Pacquement H, et al. Indications and results of diagnostic biopsy in pediatric renal tumors: a retrospective analysis of 317 patients with critical review of SIOP guidelines[J]. Pediatr Blood Cancer, 2019, 66(6): e27641. DOI:10.1002/pbc.27641 |
| [11] |
汤静燕, 潘慈, 陆勤, 等. 儿童肾肿瘤多中心协作方案诊治随访报告[C]//第十三届江浙沪儿科学术会议暨2016年浙江省医学会儿科学学术年会论文汇编. 湖州: 浙江省科学技术协会, 2016: 632. Tang JY, Pan C, Lu Q, et al. Long-term Follow-up Report of Multicenter Clinical Study on Childhood Renal Tumor[C]//Compilation of Papers at the 13th Jiangsu Zhejiang Shanghai Pediatric Academic Conference and 2016 Zhejiang Medical Association's Pediatric Academic Annual Conference. Huzhou: Zhejiang Association of Science and Technology, 2016: 632. |
| [12] |
王焕民. 肾母细胞瘤手术治疗[J]. 中国小儿血液与肿瘤杂志, 2022, 27(1): 1-4. Wang HM. Surgical treatment of Wilm's tumor[J]. J China Pediatr Blood Cancer, 2022, 27(1): 1-4. DOI:10.3969/j.issn.1673-5323.2022.01.001 |
| [13] |
Aldera AP, Pillay K. Clear cell sarcoma of the kidney[J]. Arch Pathol Lab Med, 2020, 144(1): 119-123. DOI:10.5858/arpa.2018-0353-RS |
| [14] |
Furtwängler R, Gooskens SL, van Tinteren H, et al. Clear cell sarcomas of the kidney registered on International Society of Pediatric Oncology (SIOP) 93-01 and SIOP 2001 protocols: a report of the SIOP Renal Tumour Study Group[J]. Eur J Cancer, 2013, 49(16): 3497-3506. DOI:10.1016/j.ejca.2013.06.036 |
| [15] |
Rusyn VI, Korsak VV, Rusyn AV, et al. Radical nephrectomy and thrombectomy in patients with renal cell cancer complicated by tumoral thrombosis of the renal vein and vena cava inferior[J]. Klin Khir, 2013(1): 21-26. |
| [16] |
北京市瘤栓协作小组. 肾癌伴静脉瘤栓北京专家共识[J]. 微创泌尿外科杂志, 2017, 6(6): 321-327. Beijing Tumor Suppository Cooperation Group. Consensus of Beijing Experts on Renal Cell Carcinoma with Venous Tumor Thrombus[J]. J Mim Inv Urol, 2017, 6(6): 321-327. DOI:10.19558/j.cnki.10-1020/r.2017.06.001 |
| [17] |
Ciancio G, Gonzalez J, Shirodkar SP, et al. Liver transplantation techniques for the surgical management of renal cell carcinoma with tumor thrombus in the inferior vena cava: step-by-step description[J]. Eur Urol, 2011, 59(3): 401-406. DOI:10.1016/j.eururo.2010.07.028 |
| [18] |
Gonzalez-Fajardo JA, Fernandez E, Rivera J, et al. Transabdominal surgical approach in the management of renal tumors involving the retrohepatic inferior vena cava[J]. Ann Vasc Surg, 2000, 14(5): 436-443. DOI:10.1007/s100169910083 |
| [19] |
王德娟, 佘锦标, 李桂生, 等. 腹膜后恶性肿瘤并下腔静脉瘤栓的治疗——附16例报告[J]. 新医学, 2007, 38(9): 592-594. Wang DJ, She JB, Li GS, et al. Treatment of retroperitoneal malignant tumor with inferior vena cava tumor thrombus: a report of 16 cases[J]. J New Med, 2007, 38(9): 592-594. DOI:10.3969/j.issn.0253-9802.2007.09.015 |
| [20] |
叶剑飞, 马潞林, 赵磊, 等. 腔静脉节段切除术在处理侵犯腔静脉的肾肿瘤瘤栓中的应用[J]. 北京大学学报(医学版), 2018, 50(1): 183-187. Ye JF, Ma LL, Zhao L, et al. Segmental vena cava resection for renal tumor with invading tumor thrombus[J]. J Peking Univ (Health Sci), 2018, 50(1): 183-187. DOI:10.3969/j.issn.1671-167X.2018.01.031 |
| [21] |
Lifante JC, Glehen O, Peyrat P, et al. Segmental resection of tumoral invasion of the inferior vena cava without reconstruction[J]. Ann Chir, 2001, 126(1): 46-50. DOI:10.1016/s0003-3944(00)00457-0 |
| [22] |
Daylami R, Amiri A, Goldsmith B, et al. Inferior vena cava leiomyosarcoma: is reconstruction necessary after resection?[J]. J Am Coll Surg, 2010, 210(2): 185-190. DOI:10.1016/j.jamcollsurg.2009.10.010 |
| [23] |
张婵. 先天性与获得性孤立肾患儿血压及肾功能的差异分析[J]. 中国现代医学杂志, 2018, 28(31): 118-122. Zhang C. Variations of blood pressure and renal function in children with congenital and acquired solitary kidneys[J]. China J Mod Med, 2018, 28(31): 118-122. DOI:10.3969/j.issn.1005-8982.2018.31.024 |
| [24] |
Grimaldi C, Bertocchini A, Crocoli A, et al. Caval replacement strategy in pediatric retroperitoneal tumors encasing the vena cava: a single-center experience and review of literature[J]. J Pediatr Surg, 2019, 54(3): 557-561. DOI:10.1016/j.jpedsurg.2018.06.008 |
| [25] |
Han H, Bertrand KC, Patel KR, et al. BCOR-CCNB3 fusion-positive clear cell sarcoma of the kidney[J]. Pediatr Blood Cancer, 2020, 67(4): e28151. DOI:10.1002/pbc.28151 |
| [26] |
Zigman A, Shen I. Clear cell sarcoma of the kidney with cavo-atrial tumor thrombus: complete resection in a child[J]. J Pediatr Surg, 2006, 41(8): 1464-1466. DOI:10.1016/j.jpedsurg.2006.04.027 |
| [27] |
Sugandhi N, Munghate G, Malankar DP, et al. Pediatric clear cell sarcoma of the kidney with cavoatrial thrombus[J]. J Pediatr Surg, 2011, 46(12): 2387-2390. DOI:10.1016/j.jpedsurg.2011.09.050 |
| [28] |
Doya LJ, Alyousef K, Oukan M, et al. Clear cell sarcoma of the kidney with inferior vena cava thrombus: a case report[J]. J Med Case Rep, 2022, 16(1): 295. DOI:10.1186/s13256-022-03489-2 |
| [29] |
Khozeimeh N, Sinha P, Dome JS, et al. Strategy for management of retroperitoneal tumors with caval tumor thrombus[J]. J Pediatr Surg, 2011, 46(11): 2065-2070. DOI:10.1016/j.jpedsurg.2011.06.041 |
| [30] |
王冠男, 孙宁, 李宁, 等. 儿童肾透明细胞肉瘤合并右心房瘤栓一例报告[J]. 中华泌尿外科杂志, 2018, 39(7): 546. Wang GN, Sun N, Li N, et al. Renal clear cell sarcoma plus right atrial tumor thrombus in children: one case report[J]. Chin J Urol, 2018, 39(7): 546. DOI:10.3760/cma.j.issn.1000-6702.2018.07.020 |
| [31] |
Ohtake N, Shiono A, Okabe K, et al. Clear cell sarcoma extending into the inferior vena cava[J]. Nihon Hinyokika Gakkai Zasshi, 1995, 86(7): 1298-1301. DOI:10.5980/jpnjurol1989.86.1298 |
 2023, Vol. 22
2023, Vol. 22


