神经母细胞瘤(neuroblastoma, NB)是儿童最常见的颅外恶性实体肿瘤,占儿童肿瘤的6% ~10%,占儿童肿瘤死亡病例总数的10% ~20% [1-2]。近年来随着间位碘代苄胍(metaiodobenzylguanidine, MIBG)靶向放疗、抗双唾液酸神经节苷脂(disialoganglioside 2, GD2)治疗及自体干细胞移植的应用,NB的治疗效果有所提高,但高危组患儿的治愈率仍低于50%,且复发率、转移率和病死率仍较高[3-4]。NB具有显著的生物学异质性,前瞻性评估NB患者预后至关重要。循环肿瘤细胞(circulating tumor cells, CTCs)作为液体活检的重要分析物之一,可以无创、早期评估肿瘤预后[5-7]。但CTCs检测在儿童肿瘤领域,特别是对于NB的应用及价值研究,与成人相比仍有较大的探索空间。本研究使用细胞表面波形蛋白(cell surface vimentin, CSV)抗体纳米微流控芯片免疫捕获的CytoSorterⓇ CTC检测系统,通过GD2进行肿瘤细胞鉴定,进而分析CTCs数量与NB患儿临床及病理特征的相关性,探索CTCs检测在NB患儿诊断及预后评估中的应用价值。
资料与方法 一、一般资料本研究选取2021年1月至2022年9月重庆医科大学附属儿童医院肿瘤外科收治的经病理检查确诊的NB患儿为研究对象,剔除确诊后放弃治疗的12例,共纳入87例患儿。收集患儿年龄、性别、肿瘤分期、转移、生存情况等临床资料,以及尿香草扁桃酸(vanillyl mandelic acid, VMA)水平、CTCs检测结果等。
87例患儿中,男41例,女46例,中位年龄28个月(2~151个月)。根据国际神经母细胞瘤危险度分级协作组(International Neuroblastoma Risk Group, INRG)分级标准,L1期15例,L2期28例,M期40例,Ms期4例;低危20例,中危21例,高危46例。患儿均按照CCCG-NB-2015标准给予治疗,均未行自体干细胞移植及GD2免疫治疗,患儿临床资料见表 1[8]。同期选取20例健康儿童作为对照组,抽取外周血进行CTCs检测。
| 表 1 CTCs检出状态与神经母细胞瘤患儿临床病理特征的关联性分析(例) Table 1 Correlation analysis between CTCs status and clinicopathological features of NB(n) |
|
|
本研究已取得重庆医科大学附属儿童医院伦理委员会批准(2021-31),患儿父母签署书面知情同意书。
二、CTCs检测方法患儿确诊NB后,于化疗前采集CTCs样本。用乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)抗凝的真空采血管采集患儿静脉血6 mL,室温暂存,并在6 h内进行检测。CTCs检测采用CytoSorterⓇ CTCs检测系统,基本原理是基于微流控纳米芯片免疫捕获和免疫荧光鉴定,血液样本经过密度梯度离心后分离单核细胞层,同时将纳米微流控芯片上包被CSV捕获抗体,将微流控芯片和单核细胞悬液放置于CTC分选仪上行自动化分离捕获CTC。然后进行CTC的免疫荧光染色,Anti-CSV Ab和Anti-GD2 Ab鉴定肿瘤细胞,Anti-CD45 Ab鉴定白细胞,用Hoechst33342进行细胞核染色。
三、CTCs阳性判定CTCs检测结果判定标准:①细胞圆形或类圆形,细胞形态完整,可见完整细胞核形态及细胞核。②免疫荧光染色后表现为绿色(CSV)、红色(GD2)和蓝色(Hoechst),为CTCs阳性细胞;表现为橙色(CD45)和蓝色(Hoechst),为白细胞。③结果由2位以上经过培训的实验员判定,CTC≥1则判定为阳性。
四、统计学处理采用SPSS 26.0和Graphpad Prism 9进行数据处理和图表制作。采用χ2检验比较NB患儿与健康人以及不同年龄、分期、危险度分层、Mycn基因扩增状态、肿瘤大小、转移状态以及生存状态患儿的CTCs水平。不同临床特征的CTCs数量比较采用Mann-Whiney U检验,生存分析采用Kaplan-Meier生存函数,采用Log-rank检验比较生存曲线的差异。采用McNemar配对χ2检验评估CTCs检测在NB中的临床诊断效能。P<0.05为差异有统计学意义。
结果 一、CTCs检测结果与NB临床病理特征的关系本研究共对87例不同分期的NB患儿及20例健康对照进行CTCs检测。两组年龄、性别差异无统计学意义(P>0.05)。87例NB患儿中,59例(67.8%)检测到CTCs,数量1~10个不等,中位数量为2个。20例健康对照中仅检测出1例(5%)CTCs阳性,肿瘤组患儿CTCs检出率明显高于健康对照组,差异有统计学意义(P < 0.01)。肿瘤患儿CTCs数目也明显高于正常对照组(图 2A)。分析不同临床特征与CTCs检出率的关系显示,CTCs检出率与患儿年龄、肿瘤大小、INRG分期、危险度分层、骨/骨髓转移、生存状态、尿VMA水平具有显著关联性(P < 0.05),与患儿性别、肿瘤类型、Shimada分型、淋巴结转移、Mycn扩增与否无显著关联性(P>0.05),见表 1。
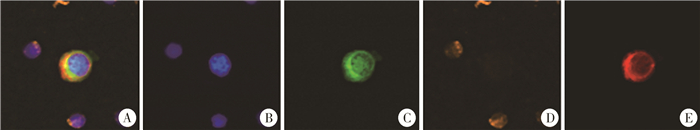
|
图 1 神经母细胞瘤CTCs免疫荧光染色结果 Fig.1 Immunofluorescent staining results of neuroblastoma CTCs 注A: CTC阳性的荧光合并图;B: 细胞核染色阳性,呈蓝色荧光;C: 细胞表面波形蛋白阳性,呈绿色荧光;D: 白细胞CD45-藻红蛋白阴性者不显荧光色,阳性者呈橙色荧光;E: GD2蛋白阳性,呈红色荧光;比例尺:10 μm;(×20);CTCs:循环肿瘤细胞 |
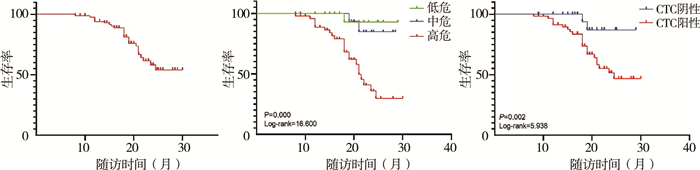
|
图 2 CTCs检测结果与神经母细胞瘤患儿生存期分析 Fig.2 Analysis of CTCs detection results and survival time of NB children |
分析不同临床特征患儿的CTCs数量发现,在年龄≥18个月、Shimada分型为预后不良型(uFH型)、肿瘤长径>5 cm、伴有骨/骨髓转移的患儿中,CTCs数量更多。肿瘤分期越晚、危险度分层越高的患儿,CTCs检出数量明显升高;存活患儿的CTCs检出数量明显低于死亡患儿,差异有统计学意义(P < 0.05)。另外,CTCs数目与性别、肿瘤类型、VMA水平、Mycn基因扩增状态、是否存在淋巴结转移无关(表 2)。
| 表 2 CTCs数量与神经母细胞瘤患儿临床病理特征的关联性分析(例) Table 2 Correlation analysis between CTCs number and clinicopathological features of NB(n) |
|
|
本组患儿随访时间最长2.5年,总体生存率为53.9%,低危组生存率92.9%,中危组生存率84.8%,高危组生存率29.8%。CTCs阴性者生存率为87.1%,CTCs阳性者生存率为46.8%(图 3),差异有统计学意义(P=0.002)。
四、CTCs辅助NB临床诊断的价值本研究中NB患儿尿VMA阳性率为49.4%(43/87),CTCs阳性检出率为67.8%(59/87)。通过McNemar配对χ2检验,发现CTCs检测对于NB的诊断效能显著高于24 h尿VMA,差异有统计学意义(P=0.009)。
讨论NB是儿童常见的颅外恶性实体肿瘤,该病发病隐匿,早期难以发现,恶性程度高,病情进展快,病死率高,预后相对较差。低中危患儿5年生存率75% ~98%,高危患儿5年生存率不足50%[9]。临床上患儿确诊时约50%为高危患儿,长期生存率低于40%[10]。如何改善NB患儿预后是目前亟待解决的重要问题。
NB患儿预后受诸多因素影响,比如肿瘤标志物神经元烯醇化酶(neuron specific enolase, NSE)、Mycn基因扩增、Ki67阳性率、手术切除范围、术中肿瘤残留等,存在多类骨转移患儿预后更差[11]。液体活检已成为NB诊断研究的新热点,CTCs反映肿瘤负荷,可作为NB预后评估的重要工具[12-13]。Merugu等[8]研究结果显示,CTCs计数可能有助于评估疗效,以及决定高危NB患儿诱导化疗的时间,从而指导治疗。Liu等[14]研究发现,不同风险组别NB患儿CTCs检出数量存在显著差异,有转移灶的患儿会有较高数量的CTCs检出,患儿预后较差。Mitra等[15]使用CSV作为NB患儿CTC的富集生物标志物,研究证明CSV+CTC可以作为判断早期复发(2个月至2年)的重要指标。本研究也采用CSV富集NB患儿CTCs,结果显示,CSV对于NB患儿CTCs具有较高的检测效率(67.8%,59/87),且可以辅助进行NB患儿的预后评估,CTCs阳性患儿的生存率明显低于CTCs阴性患儿,差异有统计学意义(P=0.002)。本研究结果进一步证实NB患儿CTCs富集检测的可行性及其临床应用价值。
本研究结果显示,不同年龄组患儿的CTC检测阳性率有统计学差异,可能与≥18月龄患儿中M期占比较高有关(33/58),而在<18月龄的29例患儿中,M期患儿仅11例。同时,我们发现INRG分期为M期的患儿中,CTCs检测阳性率明显高于L期,高危组患儿CTCs检出率高于中低危组,伴有骨髓/骨转移的患儿,CTCs检测阳性率也高于不伴有骨髓/骨转移的患儿,这与之前的研究结果相一致[14]。但是对于是否伴有淋巴结转移而言,CTCs检测阳性率无统计学意义,这也可能与转移的途径相关,血液播散转移途径更容易检测出CTC,而淋巴转移患儿,血液中检测出CTC的概率相对较低。
该研究结果还显示,不同病理类型和肿瘤类型的CTCs检出率差异无统计学意义,可能是由于本研究样本数量相对较少、患儿个体差异、CTC入血能力及程度的不确定性和不均一性等因素造成。后续我们将进一步扩大样本量来进行验证。本研究中CTCs数目与患儿Mycn基因扩增状态之间也无明显关联性,这与既往研究报道基本一致[13-14, 16]。MYC基因的主要功能是促进细胞增殖、抑制细胞分化和凋亡,Mycn基因扩增与NB的发生关系密切。Kuroda等[17]研究显示,Mycn扩增与CTCs阳性无关,CTCs可能提示有较高的全身扩散风险和不良预后。特定NB人群可能在疾病早期就可以检测到CTCs,形成独立于原发病变的转移性病变,这可能是受到Mycn基因以外因素的调控。其后续研究发现CTCs对晚期NB的预后评估有意义,CTCs检测与Mycn扩增关系不大,无论Mycn扩增与否,CTCs和(或)持续性微转移的存在都可能表明存在显著高风险[18]。NB中原发肿瘤的局部生长和肿瘤细胞的扩散可能受到不同分子机制的调控,Mycn基因扩增似乎与局部肿瘤生长密切相关,但与CTCs阳性的相关性极小[19]。
24 h尿VMA是NB最常用的辅助诊断指标,在临床上应用广泛,但是NB患儿存在一定比例的尿VMA阴性,其它肿瘤如嗜铬细胞瘤也会出现尿VMA升高,故尿VMA的敏感性及特异性仍无法满足诊断及鉴别诊断的需求,需要开发新的检测方法以提高NB的早期诊断率。本研究NB患儿CTCs阳性检出率为67.8%(59/87),相比24 h尿VMA的49.4%阳性率,CTCs检测阳性率更高,通过配对χ2检验发现,CTCs检测对于NB的诊断效能显著高于24 h尿VMA。因此,本研究为CTCs检测辅助NB临床早期诊断和鉴别诊断提供了一定依据,对于临床疑似NB患儿,可以考虑CTCs进行辅助诊断。
本研究尚存在一定的局限性: ①本研究为单中心研究,纳入病例数较少,且纳入的肿瘤患儿均为NB患儿,未纳入其他良性肿瘤(如嗜铬细胞瘤)患儿;②随访时间尚短,发生结局事件的肿瘤患儿数量仍较少;③本研究仅分析了患儿确诊时的CTCs状态与临床特征的关系,未对治疗后CTCs变化与治疗效果进行分析,故对CTCs在NB疗效评估、复发监测中的价值尚不明确。未来有必要开展更大规模的多中心研究,明确CTCs对NB患儿早期诊断、疗效判断及复发监测的临床诊断价值。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 杨超负责研究的设计并对文章知识性内容进行审阅、邓晓斌负责研究实施实施、病例数据收集及分析和起草文章;彭亮、赵珍珍、孔祥如、杜逸飞、周建武负责病例数据收集及分析
| [1] |
Uemura S, Ishida T, Thwin KKM, et al. Dynamics of minimal residual disease in neuroblastoma patients[J]. Front Oncol, 2019, 9: 455. DOI:10.3389/fonc.2019.00455 |
| [2] |
Yang R, Zheng S, Dong R. Circulating tumor cells in neuroblastoma: Current status and future perspectives[J]. Cancer Med, 2023, 12(1): 7-19. DOI:10.1002/cam4.4893 |
| [3] |
Aygun N. Biological and genetic features of neuroblastoma and their clinical importance[J]. Curr Pediatr Rev, 2018, 14(2): 73-90. DOI:10.2174/1573396314666180129101627 |
| [4] |
Pinto NR, Applebaum MA, Volchenboum SL, et al. Advances in risk classification and treatment strategies for neuroblastoma[J]. J Clin Oncol, 2015, 33(27): 3008-3017. DOI:10.1200/JCO.2014.59.4648 |
| [5] |
Sundling KE, Lowe AC. Circulating tumor cells: overview and opportunities in cytology[J]. Adv Anat Pathol, 2019, 26(1): 56-63. DOI:10.1097/PAP.0000000000000217 |
| [6] |
Cabel L, Proudhon C, Gortais H, et al. Circulating tumor cells: clinical validity and utility[J]. Int J Clin Oncol, 2017, 22(3): 421-430. DOI:10.1007/s10147-017-1105-2 |
| [7] |
Liang DH, Hall C, Lucci A. Circulating tumor cells in breast cancer[J]. Recent Results Cancer Res, 2020, 215: 127-145. DOI:10.1007/978-3-030-26439-0_7 |
| [8] |
Merugu S, Chen LD, Gavens E, et al. Detection of circulating and disseminated neuroblastoma cells using the ImageStream flow cytometer for use as predictive and pharmacodynamic biomarkers[J]. Clin Cancer Res, 2020, 26(1): 122-134. DOI:10.1158/1078-0432.CCR-19-0656 |
| [9] |
Pudela C, Balyasny S, Applebaum MA. Nervous system: embryonal tumors: neuroblastoma[J]. Atlas Genet Cytogenet Oncol Haematol, 2020, 24(7): 284-290. DOI:10.4267/2042/70771 |
| [10] |
Park JR, Kreissman SG, London WB, et al. Effect of tandem autologous stem cell transplant vs single transplant on event-free survival in patients with high-risk neuroblastoma: a randomized clinical trial[J]. JAMA, 2019, 322(8): 746-755. DOI:10.1001/jama.2019.11642 |
| [11] |
马越, 王珊, 李长春, 等. 神经母细胞瘤并骨转移患儿临床特征及预后相关因素的单中心分析[J]. 临床小儿外科杂志, 2022, 21(2): 115-120. Ma Y, Wang S, Li CC, et al. Single-center analysis of clinical features and prognosis of neuroblastoma children with bone metastasis[J]. J Clin Ped Sur, 2022, 21(2): 115-120. DOI:10.3760/cma.j.cn.101785-202105011-004 |
| [12] |
马潇, 袁晓军, 魏蒙. 神经母细胞瘤循环肿瘤细胞分离与鉴定方法的建立及临床应用[J]. 中国小儿血液与肿瘤杂志, 2018, 23(2): 79-84. Ma X, Yuan XJ, Wei M. Establishment and clinical application for isolation and identification of circulating tumor cells in neuroblastoma[J]. J China Pediatr Blood Cancer, 2018, 23(2): 79-84. DOI:10.3969/j.issn.1673-5323.2018.02.005 |
| [13] |
杜诗蓓, 金倩涯, 马潇, 等. 循环肿瘤细胞对神经母细胞瘤转移的诊断价值及疾病进展的预测价值[J]. 中国小儿血液与肿瘤杂志, 2019, 24(5): 258-262. Du SB, Jin QY, Ma X, et al. The diagnostic value of circulating tumor cells for metastatic neuroblastoma and its predictive value for disease progression[J]. J China Pediatr Blood Cancer, 2019, 24(5): 258-262. DOI:10.3969/j.issn.1673-5323.2019.05.007 |
| [14] |
Liu XQ, Zhang ZZ, Zhang BB, et al. Circulating tumor cells detection in neuroblastoma patients by EpCAM-independent enrichment and immunostaining-fluorescence in situ hybridization[J]. EBioMedicine, 2018, 35: 244-250. DOI:10.1016/j.ebiom.2018.08.005 |
| [15] |
Mitra A, Satelli A, Xia XQ, et al. Cell-surface Vimentin: a mislocalized protein for isolating csVimentin+ CD133- novel stem-like hepatocellular carcinoma cells expressing EMT markers[J]. Int J Cancer, 2015, 137(2): 491-496. DOI:10.1002/ijc.29382 |
| [16] |
Trigg RM, Shaw JA, Turner SD. Opportunities and challenges of circulating biomarkers in neuroblastoma[J]. Open Biol, 2019, 9(5): 190056. DOI:10.1098/rsob.190056 |
| [17] |
Kuroda T, Honna T, Morikawa N, et al. Tumor cell dynamics and metastasis in advanced neuroblastoma[J]. Pediatr Surg Int, 2005, 21(11): 859-863. DOI:10.1007/s00383-005-1503-9 |
| [18] |
Kuroda T, Morikawa N, Matsuoka K, et al. Prognostic significance of circulating tumor cells and bone marrow micrometastasis in advanced neuroblastoma[J]. J Pediatr Surg, 2008, 43(12): 2182-2185. DOI:10.1016/j.jpedsurg.2008.08.046 |
| [19] |
Kuroda T. Cellular kinetics of neuroblastoma and the role of surgery[J]. Pediatr Surg Int, 2011, 27(9): 913-917. DOI:10.1007/s00383-011-2949-6 |
 2023, Vol. 22
2023, Vol. 22


