先天性肺发育畸形(congenital lung malformations, CLMs)包括先天性肺气道畸形(congenital pulmonary airway malformation, CPAM)、支气管隔离肺(broncho-pulmonary sequestration, BPS)、先天性高气道阻塞综合征、支气管源性囊肿和先天性肺叶气肿(congenital lobar emphysema, CLE)等,是一组气道、肺实质及肺血管发育异常的先天性疾病。其中CPAM及BPS最常见,多数患儿于生后3~6个月接受手术治疗,预后良好[1]。产前超声检查常采用先天性肺气道畸形体积比(congenital pulmonary airway malformation-volume ratio, CVR)评估病变并预测疾病进展。目前多数中心认为孕中期CVR大于1.6与围产期胎儿不良结局相关[2-4]。2019年1月至2022年12月首都儿科研究所附属儿童医院新生儿外科门诊共接受拟诊CLMs胎儿产前咨询61例,其中12例于新生儿期出现不同程度呼吸困难,经手术治疗后预后良好。本研究回顾性分析12例CLMs患儿临床资料,探讨CLMs患儿的产前诊断特点以及新生儿期手术干预指征。
资料与方法 一、研究对象2019年1月至2022年12月本院共有61例拟诊CLMs胎儿,均建档并接受产前咨询。其中12例出生后出现不同程度呼吸困难,经绿色通道转运至本院新生儿外科,并于新生儿期接受手术治疗。12例中男10例,女2例;足月儿9例,早产儿3例,最小胎龄32+5周;平均出生体重3 135.42 g,最低出生体重2 200 g。手术指征:新生儿期由于胸腔占位导致呼吸困难,经积极保守治疗不能缓解症状者。病例纳入标准:①产前检查拟诊CLMs胎儿,就诊本院新生儿外科并建档,接受产前咨询;②患儿出生28 d内,在本院实施手术治疗。排除标准:出生后3 d内出现感染,或因严重心脏结构畸形等其他因素导致新生儿期呼吸困难。
二、研究方法收集并分析12例产前拟诊CLMs患儿的超声资料,包括诊断孕周、诊断分型、最大CVR、末次超声CVR、孕期干预方式,以及出生后临床资料,如呼吸支持、术前处理措施、影像学检查结果(包括胸部增强CT)、手术日龄、手术方式、术后呼吸机使用时间、术后并发症、病理结果。
结果 一、12例CLMs患儿产前诊断情况12例患儿均获产前诊断,其中CPAM 9例(Ⅰ型2例、Ⅱ型3例、Ⅲ型4例),BPS 2例,CLE 1例。产前诊断时间:11例为孕中期(孕20~24周),1例为孕晚期(孕37周)。CPAM产前超声影像特点:胸腔内高回声囊性或囊实性肿物,由肺动脉供血,肺脏受压,纵隔移位,伴胸腔积液、腹腔积液或羊水过多。BPS产前超声影像特点:一侧胸腔内边界清晰高回声致密影,彩色多普勒显示供血来源于主动脉。CLE产前超声与CPAM相似。CVR最大值为0.68~5.00。胸/腹腔积液8例,羊水过多3例。产前干预方法:孕中期激素治疗1例,孕晚期羊水穿刺引流1例,瘤体穿刺引流1例。产前接受羊水穿刺基因检测2例。受超声仪器以及检查医师经验影响,部分患儿未获得最大CVR数值监测,孕晚期转诊至产前诊断中心完成检测。12例CLMs患儿产前一般资料见表 1。
| 表 1 12例CLMs患儿产前一般资料 Table 1 Prenatal general profiles of 12 CLMs children |
|
|
12例患儿出生后出现不同程度呼吸困难,转运途中予持续高流量吸氧3例,转运呼吸机支持9例,移动暖箱保温,间断清理气道分泌物,监测心率及经皮血氧饱和度。患儿术前均不能脱氧,需呼吸支持9例。转入后完善超声及胸部增强CT检查,术前诊断CPAM 6例,BPS 4例,CLE 2例。术前合并新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS) 1例,予肺表面活性物质(pulmonary surfactant, PS)气管内治疗;持续肺动脉高压(persistent pulmonary hypertension, PPHN)2例,予一氧化氮(nitrogen monoxide, NO)吸入治疗;患侧张力性气胸2例,予胸腔闭式引流;术前囊肿压迫严重,行穿刺引流1例。见表 2。
| 表 2 12例CLMs患儿出生后基本情况 Table 2 Basic postnatal profiles of 12 CLMs children |
|
|
12例患儿术前无一例肺部感染,排除先天性心脏病、肺动脉高压,且NRDS得到有效控制后,于新生儿期实施手术,平均手术日龄10 d。2例合并张力性气胸于出生后第1、6天手术,7例难以脱离呼吸支持于生后第7天手术,2例拟诊CLE及1例拟诊BPS患儿胸部CT提示占位效应致纵隔移位加重,分别于生后第18、26、14天手术。6例于胸腔镜下手术切除病灶,6例因占位巨大、微创手术操作空间受限而中转开放手术。术后予呼吸支持9例,1例术后出现少量气胸,经保守治疗3周痊愈。所有患儿术后无一例出血、感染、复发等出现。术后病理检查结果:CPAM 6例,BPS 4例,肺间质肿瘤2例。1例术后出现漏斗胸,于3岁时手术。12例CLMs患儿手术情况见表 3。典型病例照片见图 1至图 5。
| 表 3 12例CLMs患儿手术治疗情况 Table 3 Surgical treatment status of 12 CLMs children |
|
|

|
图 1 1例先天性肺气道畸形患儿手术前后CT检查情况及术后大体病理图 Fig.1 Case of CPAM (1A1B preoperative CT, 1C gross pathology, 1D postoperative CT) 注 A:术前CT;B: 术后CT;C:术后大体病理图;D:术后CT |
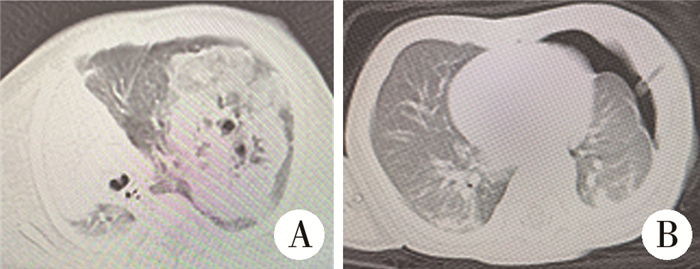
|
图 2 1例术前拟诊先天性肺气道畸形、术后病理确诊肺间质肿瘤患儿手术前后CT检查情况 Fig.2 Case 2 of CPAM, postoperative pathological diagnosis of pulmonary interstitial tumor 注 A:术前CT;B:术后CT |
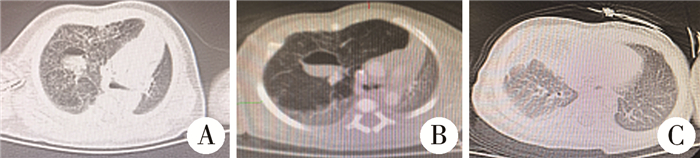
|
图 3 1例术前拟诊先天性肺叶气肿、术后病理确诊先天性肺气道畸形患儿CT检查情况 Fig.3 Case 5 of CLE and CPAM was confirmed by postoperative pathology 注 A:出生后第3天CT;B:出生后第14天CT;C:手术后CT |
|
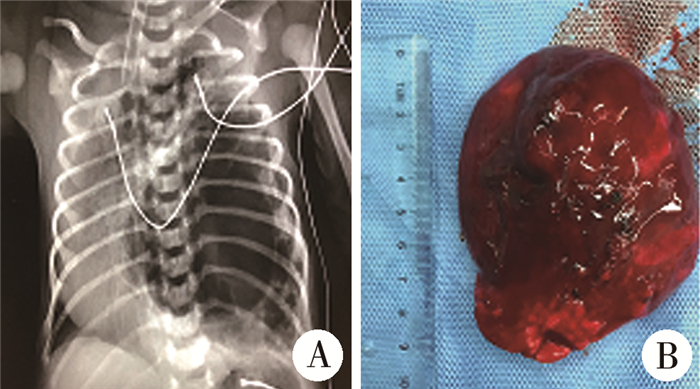
图 4 1例左肺上叶巨大先天性肺气道畸形合并气胸患儿术前胸片及术后大体病理图 Fig.4 Case 10 of giant CPAM in left upper lung lobe with pneumothorax (4A preoperative chest radiograph, 4B gross pathology) 注 A:术前胸片;B:术后大体病理图 |
|
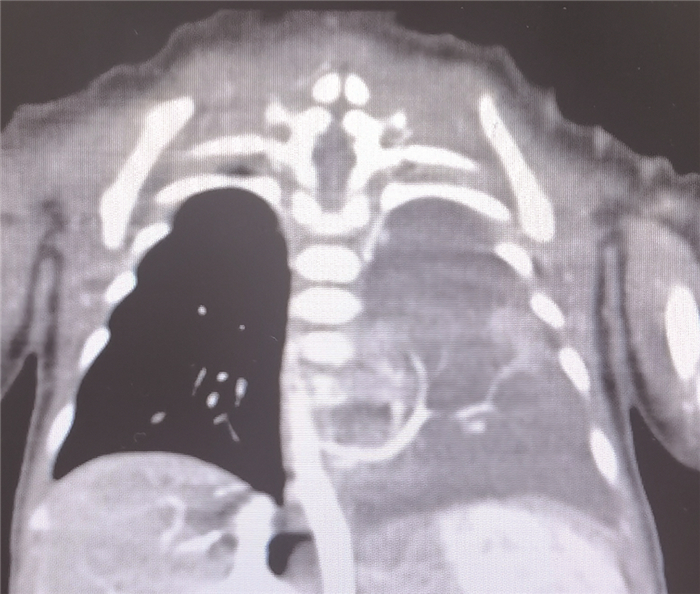
图 5 1例支气管隔离肺患儿术前CT重建图 Fig.5 Case 11 of BPS: preoperative CT reconstruction |
先天性肺气道畸形(CPAM)及支气管隔离肺(BPS)是临床常见的先天性肺发育畸形。多数病例于孕18~22周获得诊断。CPAM的典型产前超声征象是胸腔内高回声囊性或囊实性肿物,由肺动脉供血。BPS表现为边界清晰的高回声致密影,彩色多普勒超声显示供血来源于主动脉。越来越多的CPMA及BPS预后良好,但仍有少数并发纵隔移位、胎儿水肿,可能出现宫内或生后死亡[4]。目前尚无产前诊断先天性肺发育畸形的围产期管理指南,对于这部分患儿,产前由新生儿外科、产科、影像科、遗传科等多学科团队协作,对畸形的诊断与预后进行评估,确定病情危重程度,制定个性化诊疗方案,生后选择恰当的手术时机尤为重要。
一、产前超声CVR的意义目前在国内外产前超声检查中,广泛使用CVR作为胎儿围产期结局的重要预测因子。CVR计算公式为瘤体长(cm)×宽(cm)×高(cm)×0.523÷胎儿头围(cm)。以往文献报道,当CVR>1.6提示存在“高风险性”因素[5-6]。因而临床上很多孕妇被建议引产。近年来研究显示,与胎儿水肿相关的最大CVR为2.25[7]。本组12例患儿孕中期最大CVR为0.68~5.00不等。7例最大CVR大于1.6,其中6例大于2.25,而孕期出现胎儿水肿病例仅1例。30周后随孕周增加,CVR不同程度下降,预后良好。我们认为,单纯将CVR作为终止妊娠的单一判断指标并不全面,可能会使部分预后良好的胎儿失去生存机会,其作为胎儿水肿预警较为合理;同时可为分娩时新生儿窒息复苏及新生儿期手术做出预警,提高临床医师风险意识,做好产房内急救准备。由于妊娠期大部分胎儿的CVR随孕周的增长而呈先增长、后降低趋势,不同阶段CVR的风险阈值可能不同[8]。当CVR大于1.6而未出现胎儿水肿时,需密切监测随访。
二、产前宫内干预时机与方案在密切监测孕期超声变化的基础上,一旦出现胎儿水肿,宫内干预治疗很有必要。文献报道对于高危CPAM胎儿[CVR>1.6和(或)胎儿水肿]应用类固醇激素可以获得良好预后[9]。而对激素治疗失败的胎儿, 大囊型囊肿可致胎儿水肿,可予经羊膜穿刺减压或放置胸羊膜分流管。本组有1例产前超声拟诊CPAM经激素治疗效果不明显,于孕30周时瘤体增大至8 cm,最大CVR升至5.0,继而出现胎儿水肿(伴胸、腹腔积液,羊水增多),行囊肿穿刺引流、羊水穿刺引流,CVR降至2.5,胎儿水肿得到一定程度缓解,有效延长孕周至32+5周,为分娩后手术治疗创造了机会。我们认为,在孕期规律影像学监测中,对囊泡液增加、囊肿体积增大导致胎儿瘤体迅速增长者,行羊膜腔-囊肿穿刺引流效果良好。微囊型更适合激素治疗,而对于大囊型病例激素治疗效果不明显,瘤体穿刺引流效果更好,这与文献报道相符[9]。
三、新生儿期手术时机的判断先天性肺发育畸形新生儿期手术时机通常取决于患儿出生后临床症状[9]。本组患儿均于新生儿期出现不同程度呼吸困难。2例因自发性气胸,急诊行开胸肺囊腺瘤切除术。术中证实瘤体为大囊型伴破损造成严重气胸。7例需持续呼吸支持,于生命体征稳定5~10 d后手术,3例生后2~3周出现进行性加重的呼吸困难,予手术治疗。我们认为,对于新生儿期瘤体破损造成的张力性气胸,首选胸腔闭式引流缓解症状;对于破损严重、持续引流不能维持生命体征稳定者,应急诊手术抢救生命;对于病灶巨大,压迫心肺需要呼吸支持者,在解除其他导致呼吸困难的病因、生命体征稳定的基础上,应尽早手术治疗。对于新生儿期症状进行性加重,经积极控制感染等症状无缓解,影像学检查纵隔移位加重者,应积极手术治疗。术后病理检查应与先天性大叶性肺气肿鉴别。对于绝大多数新生儿期无症状的BPS,可动态观察、择期手术治疗。如患儿由于占位导致呼吸困难,影像学检查提示滋养血管粗大、病变血供丰富、瘤体增大迅速,建议尽早手术,缓解症状。
四、新生儿期呼吸系统合并症的处理由于CLMs这类疾病孕期可能出现羊水过多致胎儿早产倾向,分娩后需警惕NRDS,及时使用PS,注意与占位压迫所致呼吸困难相鉴别,避免非必要的新生儿期手术。此外,患儿分娩后从胎儿期循环转为新生儿期,可能存在轻重不一的PPHN。我们的经验是监测上下肢经皮氧饱和度的差异,必要时完成超声心动图检查。对于明确存在PPHN者,及早于呼吸机辅助通气下行NO吸入治疗,必要时可口服西地那非,持续静脉泵入曲前列尼尔。待肺动脉高压缓解后,重新评估患儿呼吸情况及胸部占位情况,选择恰当的手术时机。
五、对新生儿期无症状者的建议由于孕晚期CPAM可能自行减小甚至消退,因而产前应持续超声随访[10]。亦有文献分析妊娠后期,部分CPAM的超声回声接近正常肺组织,而非真正意义上的消退[11]。有研究证明,无症状患儿病理检测仍可以找到急慢性炎症证据[11]。对于新生儿期无症状者,我们建议在超声不能确诊的前提下,于生后6周内完成第1次CT检查,明确诊断、分型、病灶范围,于生后3~6个月手术,从而降低术后并发症发生率。本中心产前咨询61例CLMs患儿,49例新生儿期病情平稳,1个月后接受胸部CT检查;45例月龄3~6个月时接受胸腔镜手术治疗,效果良好。其余4例CT未发现明显异常。
综上,随着先天性肺发育不良产前检出率的增加,产前高质量超声监测可为胎儿期干预时机和方式提供依据,同时可作为新生儿期手术预警。对于新生儿期出现症状的患儿,准确识别病因,正确处理和选择恰当的手术时机、手术方式,可以获得良好预后。适时的CT检查是重要的判断手段。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 王莹负责研究的设计、实施和起草文章;王莹、刘超、李景娜、魏延栋、张艳霞、吴涛负责病例数据收集及分析;马立霜负责研究实施,并对文章知识性内容进行审阅
| [1] |
Stocker LJ, Wellesley DG, Stanton MP, et al. The increasing incidence of foetal echogenic congenital lung malformations: an observational study[J]. Prenat Diagn, 2015, 35(2): 148-153. DOI:10.1002/pd.4507 |
| [2] |
Kunisaki SM, Saito JM, Fallat ME, et al. Development of a multi-institutional registry for children with operative congenital lung malformations[J]. J Pediatr Surg, 2020, 55(7): 1313-1318. DOI:10.1016/j.jpedsurg.2019.01.058 |
| [3] |
中华医学会小儿外科学分会普胸外科学组, 中国医疗保健国际交流促进会妇儿医疗保健分会. 先天性肺气道畸形诊疗中国专家共识(2021版)[J]. 中华小儿外科杂志, 2021, 42(8): 679-687. Section of General Thoracic Surgery, Branch of Pediatric Surgery, Chinese Medical Association, Branch of Women and Children's Medical Care, China International Exchange and Promotion Association for Medical and Health Care. National Expert Consensus on Diagnosing & Treating Congenital Pulmonary Airway Malformations in China (Edition 2021)[J]. Chin J Pediatr Surg, 2021, 42(8): 679-687. DOI:10.3760/cma.j.cn421158-20210112-00021 |
| [4] |
Morini F, Zani A, Conforti A, et al. Current management of congenital pulmonary airway malformations: a "European pediatric surgeons' association" survey[J]. Eur J Pediatr Surg, 2018, 28(1): 1-5. DOI:10.1055/s-0037-1604020 |
| [5] |
Shulman R, Sparks TN, Gosnell K, et al. Fetal congenital pulmonary airway malformation: the role of an objective measurement of cardiomediastinal shift[J]. Am J Perinatol, 2019, 36(3): 225-232. DOI:10.1055/s-0038-1669909 |
| [6] |
Stoiber B, Moehrlen U, Kurmanavicius J, et al. Congenital lung lesion: prenatal course, therapy and predictors of perinatal outcome[J]. Ultraschall Med, 2017, 38(2): 158-165. DOI:10.1055/s-0035-1553261 |
| [7] |
Kunisaki SM, Saito JM, Fallat ME, et al. Fetal risk stratification and outcomes in children with prenatally diagnosed lung malformations: results from a multi-institutional research collaborative[J]. Ann Surg, 2022, 276(5): e622-e630. DOI:10.1097/SLA.0000000000004566 |
| [8] |
Peters NCJ, Hijkoop A, Hermelijn SM, et al. Prediction of postnatal outcome in fetuses with congenital lung malformation: 2-year follow-up study[J]. Ultrasound Obstet Gynecol, 2021, 58(3): 428-438. DOI:10.1002/uog.23542 |
| [9] |
Hegde BN, Tsao K, Hirose S. Management of congenital lung malformations[J]. Clin Perinatol, 2022, 49(4): 907-926. DOI:10.1016/j.clp.2022.08.003 |
| [10] |
Aziz KB, Jelin AC, Keiser AM, et al. Obstetrician patterns of steroid administration for the prenatal management of congenital pulmonary airway malformations[J]. J Neonatal Perinatal Med, 2021, 14(2): 213-222. DOI:10.3233/NPM-200526 |
| [11] |
Griggs C, Schmaedick M, Gerall C, et al. Vanishing congenital lung malformations: what is the incidence of true regression?[J]. J Neonatal Perinatal Med, 2022, 15(1): 105-111. DOI:10.3233/NPM-210740 |
 2023, Vol. 22
2023, Vol. 22


