2. 湖南省儿童医院药学部,长沙 410007
2. Department of Pharmacy, Hunan Children's Hospital, Changsha 410007, China
神经细胞焦亡是脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)过程中导致神经细胞死亡的重要原因[1]。炎症反应、氧化应激等损伤是激活细胞焦亡的经典途径,抑制神经细胞炎症反应和氧化应激可减轻神经细胞缺血/再灌注损伤[2]。醒脑静注射液是由冰片、人工麝香、郁金及栀子四味中药提取的复方制剂,临床常用于治疗脑梗死、脑出血、昏迷等疾病[3-4]。前期研究表明醒脑静注射液可通过抑制炎症反应和降低氧化应激水平,显著改善脑神经功能[5-6]。本研究选用与正常神经细胞形态、生理生化功能类似的人神经母细胞瘤细胞(SH-SY5Y)进行研究,构建氧糖剥夺/再灌注(oxygen and glucose deprivation/reperfusion, OGD/R)模型,以模拟体内CIRI过程[7]。从核因子E2相关转录因子2/NOD样受体热蛋白结构域相关蛋白3/GSDMD(nuclear factor-E2-related factor 2/NOD-like receptor thermal protein domain associated protein 3/gasdermin D, Nrf2/NLRP3/GSDMD)介导的氧化、炎症信号通路探究醒脑静注射液抗SH-SY5Y细胞损伤的作用机制,明确醒脑静注射液抗OGD/R诱导的SH-SY5Y细胞焦亡与调控Nrf2/NLRP3/GSDMD抗氧化信号通路之间的关系。
资料与方法 一、实验材料SH-SY5Y细胞株(编号:SCSP-5029)购于中国科学院典型培养物保委员会细胞库;醒脑静注射液购于河南天地药业股份有限公司;Hoechst 33342和碘化丙啶(propidium iodide, PI)双染试剂盒(CA1120)和3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, MTT, M8180]购于北京索莱宝科技有限公司;pro-IL-1β抗体(12703)购于Cell Signaling Technology (CST)公司;β-actin抗体购于武汉博士德生物公司;GSDMD抗体(AF4012)购于Affinity公司;白介素18(interleukin 18, IL-18)(EK0864)和IL-1β(EK0329)酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)测定试剂盒购于武汉博士德生物公司;BeyoECL Plus化学发光试剂盒(P0018S)、乳酸脱氢酶(lactate dehydrogenase, LDH)、放射免疫沉淀法裂解液、二喹啉甲酸(bicinchoninic acid, BCA)法蛋白定量试剂盒、半胱氨酸蛋白酶-1(caspase-1)抗体(AF1681)、NLRP3抗体(AF2155)购于上海碧云天生物技术有限公司;ML385(S8790)购于Selleck公司。
二、实验方法 (1) 细胞培养SH-SY5Y细胞用含10%胎牛血清(fetal bovine serum, FBS)的Dulbecco's改良培养基(Dulbecco's modified eagle medium, DMEM)在37 ℃、5%CO2恒温培养箱中培养48 h后,取对数生长期的细胞进行实验。
(2) 细胞活力的检测建立ODG/R模型。除去SH-SY5Y细胞完全培养液,用D-Hanks液清洗3次,更换无糖培养基,加入CoCl2溶液(终浓度为400 μmol/L)。于37 ℃、5%CO2恒温培养箱中培养6 h,后更换为完全培养液(含10%FBS的高糖培养基),继续培养24 h。分别使用浓度为2.5 μL/mL、5 μL/mL、10 μL/mL、20 μL/mL的醒脑静注射液预先处理SH-SY5Y细胞24 h,对照组进行常规培养,各组细胞培养24 h后,使用MTT法检测SH-SY5Y细胞活力。
(3) 细胞分组及给药将SH-SY5Y细胞随机分为对照组、OGD/R组、醒脑静注射液+OGD/R组以及醒脑静注射液+OGD/R+Nrf2抑制剂组共4组,每组实验进行6次(n=6)。对照组不予任何处理;OGD/R组进行OGD/R建模(前已述及);醒脑静注射液+OGD/R组、醒脑静注射液+OGD/R+Nrf2抑制剂组在建立OGD/R模型前,分别使用10 μL/mL醒脑静注射、10 μL/mL醒脑静注射+2 μmol/L ML385预处理SH-SY5Y细胞。
(4) ELISA试验检测细胞培养上清液中IL-18和白介素-1β(interleukin 1 beta, IL-1β)含量,收集处于对数生长期的各组SH-SY5Y细胞,将细胞接种于24孔板内。细胞给药处理完毕后,取各组细胞培养上清液,12 000转/min离心5 min,按照ELISA试剂盒操作说明测定细胞培养上清中IL-18和IL-1β的含量。
(5) 细胞乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒法收集处于对数生长期的各组SH-SY5Y细胞,将细胞接种于96孔板内,每个样本设6个复孔。细胞给药处理完毕后,将细胞培养板用多孔板离心机离心5 min,分别取各孔的上清液120 μL,加入新的96孔板中。各孔分别加入60 μL LDH检测工作液,混匀后室温避光孵育30 min,然后在490 nm波长下测定吸光度。使用大于等于600 nm的任一波长作为参考波长进行双波长测定,计算LDH的渗出率。
(6) Hochest/PI染色观察细胞膜受损情况收集处于对数生长期的各组SH-SY5Y细胞,将细胞接种于24孔板内。细胞给药处理完毕后,各组细胞中依次加入5 μL Hoechst 33342染色液和5 μL PI染色液,4 ℃环境下孵育30 min。染色后用磷酸盐缓冲盐水(phosphate buffered saline, PBS)洗涤一次,在荧光显微镜下观察并拍照。当细胞膜出现破损时,Hoechst 33342染液可穿透完整的细胞膜,结合DNA可使细胞核显蓝光;PI染液仅能穿透受损的细胞膜,结合DNA和RNA可使细胞核显红光。
(7) Western blot检测焦亡相关蛋白收集处于对数生长期的各组SH-SY5Y细胞,加入适量放射免疫沉淀试验(radioimmunoprecipitation assay, RIPA)蛋白裂解液,4 ℃环境下冰浴30 min,12 000转/min离心15 min。取上清液,采用BCA法检测蛋白浓度。配制10%十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),每个凝胶孔中加入25 μg蛋白样品,电泳完成后将蛋白转印至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)。5%脱脂奶粉室温下封闭非特异性抗原1 h,加一抗(β-actin、GSDMD、NLRP3、pro-IL-1β、caspase-1和Nrf2抗体,1 ∶ 500稀释)4 ℃孵育过夜。用TBS-T洗3次后,加入辣根过氧化物酶标记的二抗(1 ∶ 5000稀释)孵育1 h;再用TBS-T冲洗3次后,采用BeyoECL Plus化学发光液显影成像。
三、统计学处理采用SPSS 20.0进行统计学分析。正态分布的计量资料采用x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(整体差异有统计学意义时,两两比较采用LSD法);P < 0.05表示差异具有统计学意义。
结果 一、醒脑静注射液对OGD/R诱导的SH-SY5Y细胞存活率的影响OGD/R组SH-SY5Y细胞存活率明显低于对照组,差异有统计学意义[(40.16±3.39) %比(101.3±1.54),P < 0.001]。2.5 μL/mL、5 μL/mL、10 μL/mL、20 μL/mL的醒脑静注射液处理的细胞存活率分别为(39.77±15.76)%、(43.65±13.73)%、(63.69±11.28) %、(63.12±8.21) %;2.5 μL/mL、5 μL/mL醒脑静注射液处理的细胞存活率与对照组比较,差异均无统计学意义(P > 0.05);10 μL/mL、20 μL/mL醒脑静注射液处理的细胞存活率明显高于对照组,差异有统计学意义(P < 0.01);10 μL/mL、20 μL/mL醒脑静注射液处理的细胞存活率比较,差异无统计学意义(P > 0.05);因此本研究选择10 μL/mL醒脑静注射液处理的细胞进行后续实验。
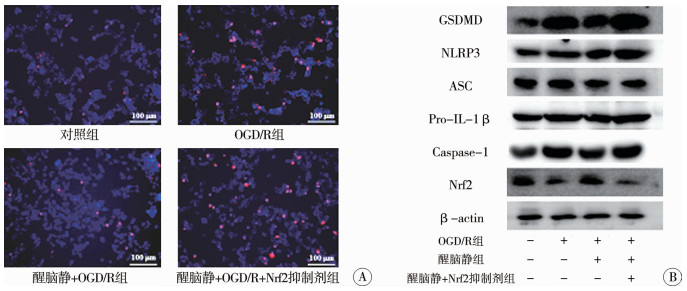
二、Nrf2抑制剂逆转醒脑静注射液对OGD/R诱导后SH-SY5Y细胞修复与对照组比较,OGD/R组细胞膜破裂程度、LDH、IL-18、IL-1β分泌、GSDMD、NLRP3、pro-IL-1β、caspase-1蛋白表达明显升高,Nrf2蛋白表达明显降低(P < 0.01)。与OGD/R组比较,醒脑静注射液组细胞膜破裂程度、LDH、IL-18、IL-1β分泌、GSDMD、NLRP3、pro-IL-1β、caspase-1蛋白表达明显降低,Nrf2蛋白表达明显升高(P < 0.05)。与醒脑静注射液组比较,醒脑静注射液+OGD/R+Nrf2抑制剂组细胞膜破裂程度、LDH、IL-18、IL-1β分泌、GSDMD、NLRP3、pro-IL-1β、caspase-1蛋白表达水平明显增加,Nrf2蛋白表达明显降低(P < 0.01)。见图 1,表 1。
|
图 1 醒脑静注射液对SH-SY5Y细胞Hoechst染色和焦亡相关蛋白表达的影响 Fig.1 Effects of Xingnaojing Injection on Hoechst stain and pyroxis-related protein expression in SH-SY5Y cellss 注 A.Hochest/PI染色观察细胞膜受损程度;B.Western blot检测焦亡相关蛋白表达 |
| 表 1 四组SH-SY5Y细胞LDH、IL-18、IL-1β分泌、ASC、焦亡相关蛋白、Nrf2蛋白表达比较(x±s) Table 1 Comparison of LDH, IL-18, IL-1β secretion, ASC, pyroptosis related protein and Nrf2 protein expression in SH-SY5Y cells of 4 groups(x±s) |
|
|
CIRI是脑血管疾病致残、致死的重要原因,研究发现CIRI在发生、发展过程中,神经细胞焦亡是导致神经细胞死亡的重要途径。本研究采用SH-SY5Y细胞建立OGD/R细胞模型,发现SH-SY5Y细胞存活率下降。CIRI缺血组织恢复血供后会出现一种非特异性损伤级联反应,主要涉及炎症反应、氧化应激、钙超载和兴奋性氨基酸毒性等多种复杂的病理生理过程,可激活凋亡、坏死、自噬、焦亡及铁死亡等多种细胞死亡途径,最终诱导神经细胞死亡。因此,研究CIRI诱导神经细胞死亡的机制可为探索CIRI的治疗提供新方向与新靶点。
细胞焦亡是一种与炎症反应密切相关的细胞死亡形式,caspase-1介导的经典细胞焦亡途径参与了CIRI的发生发展[8]。焦亡细胞主要表现为细胞不断胀大直至细胞膜破裂,释放大量细胞内容物(LDH、IL-18、IL-1β等)[9]。NLRP3炎症小体是IL-18和IL-1β成熟和分泌的重要平台,NLRP3炎症小体活化可促进caspase-1发生自身剪切和成熟,活化的caspase-1切割GSDMD形成GSDMD-N片段,随后GSDMD-N促使细胞膜表面形成孔道,导致细胞肿胀破裂[10]。另外活化的caspase-1还可将pro-IL-18和pro-IL-1β裂解为成熟的IL-18和IL-1β,并将IL-18、IL-1β释放至细胞外,从而加重炎症反应[11]。Hoechst/PI染色显示的细胞膜破裂、LDH、IL-18、IL-1β的分泌及caspase-1的活化已被广泛应用于检测焦亡的发生。本研究结果表明,SH-SY5Y细胞在OGD/R诱导后细胞存活率下降,而IL-18、IL-1β、LDH分泌、Hoechst/PI红色荧光表达、GSDMD、NLRP3、pro-IL-1β以及caspase-1蛋白表达均增高,提示细胞焦亡参与了OGD/R诱导后神经细胞损伤。
氧化应激也是CIRI级联机制中的重要环节之一。CIRI通过破坏细胞内原本的氧化还原动态平衡,促使过量自由基无法被及时清除,诱导细胞发生氧化应激和死亡[12]。Nrf2是细胞拮抗氧化应激反应过程中主要的转录激活因子,在防御外源性氧化应激过程中起核心作用。在非应激状态下,Nrf2可调控许多抗氧化基因的转录或抗氧化酶的表达水平[12]。研究表明,Nrf2介导的氧化应激保护作用对CIRI后神经细胞焦亡具有显著的负调控作用[4]。此外,Liao等[13]发现丹参酮冰片酯通过激活Nrf2信号通路,减轻了脑缺血再灌注诱导的神经炎症。Xiao等[14]报道黄芪甲苷Ⅳ通过激活Nrf2信号通路,抑制NLRP3/GSDMD介导的神经细胞焦亡,进而发挥对脑缺血再灌注损伤的保护作用。Nrf2除了能够介导氧化应激,还可能通过调节NLRP3/GSDMD炎症通路中关键蛋白表达,降低脑缺血再灌注后神经细胞焦亡水平。本研究结果也表明SH-SY5Y细胞在OGD/R处理后细胞存活率下降,抗氧化信号通路关键分子Nrf2蛋白表达降低,提示氧化应激参与了OGD/R诱导后神经细胞损伤。
现代药理学研究表明,抗炎症反应与抗氧化应激是醒脑静注射液发挥抗CIRI后神经细胞死亡的重要机制[5]。本研究结果显示,醒脑静注射液能够提高OGD/R后细胞存活率,减少IL-18、IL-1β、LDH分泌,降低Hoechst/PI红色荧光表达以及GSDMD、NLRP3、pro-IL-1β、caspase-1蛋白表达,表明醒脑静注射液具有抑制神经细胞焦亡的效应。此外,醒脑静注射液能够上调OGD/R后细胞Nrf2蛋白表达,表明醒脑静注射液可能通过激活Nrf2蛋白抑制神经细胞损伤。进一步联用Nrf2抑制剂干预OGD/R诱导后细胞模型,发现Nrf2抑制剂能够逆转醒脑静注射液对OGD/R诱导SH-SY5Y细胞的IL-18、IL-1β、LDH分泌,Hoechst/PI红色荧光表达以及GSDMD、NLRP3、pro-IL-1β、caspase-1蛋白表达的抑制作用。以上结果表明,醒脑静注射液通过激活Nrf2/NLRP3/GSDMD信号通路,发挥对OGD/R诱导神经细胞焦亡的保护作用。
综上所述,醒脑静注射液通过激活Nrf2/NLRP3/GSDMD信号通路,抑制氧糖剥夺/再灌注损伤诱导的SH-SY5Y细胞焦亡。本研究首次发现醒脑静注射液通过调控Nrf2/NLRP3/GSDMD信号通路,发挥抗细胞焦亡的作用,拓展了醒脑静注射液抗CIRI的新机制。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文海韬负责研究的设计、实施和起草文章;文海韬、安喆妮、陈小燕进行病例数据收集及分析;文海韬、吴水华负责研究设计与酝酿,并对文章知识性内容进行审阅。
| [1] |
Zhao J, Piao XY, Wu Y, et al. Cepharanthine attenuates cerebral ischemia/reperfusion injury by reducing NLRP3 inflammasome-induced inflammation and oxidative stress via inhibiting 12/15-LOX signaling[J]. Biomed Pharmacother, 2020, 127: 110151. DOI:10.1016/j.biopha.2020.110151 |
| [2] |
Wei YY, Lan BD, Zheng T, et al. GSDME-mediated pyroptosis promotes the progression and associated inflammation of atherosclerosis[J]. Nat Commun, 2023, 14(1): 929. DOI:10.1038/s41467-023-36614-w |
| [3] |
吴京霓, 刘瑞敏, 许丹妮, 等. 基于GC-MS技术及网络药理学探讨醒脑静注射液入脑成分抗脑缺血损伤的作用机制[J]. 中草药, 2021, 52(3): 808-820. Wu JN, Liu RM, Xu DN, et al. Anti-cerebral ischemia mechanisms of brain absorption components of Xingnaojing Injection based upon GC-MS and network pharmacology[J]. Chin Tradit Herb Drugs, 2021, 52(3): 808-820. DOI:10.7501/j.issn.0253-2670.2021.03.024 |
| [4] |
Zhou ZR, Zhao YH, Sun R, et al. Effects of Xingnaojing on serum high-sensitivity c-reactive protein and neuron-specific enolase in patients with acute cerebral hemorrhage: a protocol of systematic review and meta-analysis[J]. Medicine (Baltimore), 2020, 99(45): e21379. DOI:10.1097/MD.0000000000021379 |
| [5] |
王振凤, 田克姚, 刘南海. 醒脑静注射液对MCAO大鼠神经功能、神经细胞炎症及氧化应激损伤的影响[J]. 中国现代医生, 2020, 58(36): 36-39. Wang ZF, Tian KY, Liu NH. Effects of Xingnaojing Injection on nerve function, nerve cell inflammation and oxidative stress injury in MCAO rats[J]. China Mod Dr, 2020, 58(36): 36-39. |
| [6] |
卢志刚, 黄家彬, 刘芸, 等. 醒脑静注射液对急性脑梗死Keap1-Nrf2/ARE氧化应激通路的影响[J]. 广东医学, 2016, 37(20): 3127-3129. Lu ZG, Huang JB, Liu Y, et al. Effect of Xingnaojing Injection on the Keap1-Nrf2/ARE oxidative stress pathway in acute cerebral infarction[J]. Guangdong Med J, 2016, 37(20): 3127-3129. DOI:10.3969/j.issn.1001-9448.2016.20.043 |
| [7] |
王文杰, 路娇娇, 马凯丰, 等. 刺五加提取物对人神经细胞SH-SY5Y氧糖剥夺再灌注损伤的保护作用研究[J]. 世界科学技术-中医药现代化, 2022, 24(5): 1772-1780. Wang WJ, Lu JJ, Ma KF, et al. Protective effect of Acanthopanax senticosus extract on SH-SY5Y cells after oxygen and glucose deprivation reperfusion injury[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2022, 24(5): 1772-1780. DOI:10.11842/wst.20211115008 |
| [8] |
Shi M, Chen J, Liu TX, et al. Protective effects of remimazolam on cerebral ischemia/reperfusion injury in rats by inhibiting of NLRP3 inflammasome-dependent pyroptosis[J]. Drug Des Devel Ther, 2022, 16: 413-423. DOI:10.2147/DDDT.S344240 |
| [9] |
Yang KL, Bao TT, Zeng JS, et al. Research progress on pyroptosis-mediated immune-inflammatory response in ischemic stroke and the role of natural plant components as regulator of pyroptosis: a review[J]. Biomed Pharmacother, 2023, 157: 113999. DOI:10.1016/j.biopha.2022.113999 |
| [10] |
de Sá KSG, Amaral LA, Rodrigues TS, et al. Gasdermin-D activation promotes NLRP3 activation and host resistance to Leishmania infection[J]. Nat Commun, 2023, 14(1): 1049. DOI:10.1038/s41467-023-36626-6 |
| [11] |
Yanpiset P, Maneechote C, Sriwichaiin S, et al. Gasdermin D-mediated pyroptosis in myocardial ischemia and reperfusion injury: cumulative evidence for future cardioprotective strategies[J]. Acta Pharm Sin B, 2023, 13(1): 29-53. DOI:10.1016/j.apsb.2022.08.007 |
| [12] |
Sun Y, Yang X, Xu LJ, et al. The role of Nrf2 in relieving cerebral ischemia-reperfusion injury[J]. Curr Neuropharmacol, 2023, 21(6): 1405-1420. DOI:10.2174/1570159X21666221129100308 |
| [13] |
Liao S, Wu JN, Liu RM, et al. A novel compound DBZ ameliorates neuroinflammation in LPS-stimulated microglia and ischemic stroke rats: role of Akt(Ser473)/GSK3β(Ser9)-mediated Nrf2 activation[J]. Redox Biol, 2020, 36: 101644. DOI:10.1016/j.redox.2020.101644 |
| [14] |
Xiao L, Dai ZW, Tang WJ, et al. Astragaloside Ⅳ alleviates cerebral ischemia-reperfusion injury through NLRP3 inflammasome-mediated pyroptosis inhibition via activating Nrf2[J]. Oxid Med Cell Longev, 2021, 2021: 9925561. DOI:10.1155/2021/9925561 |
 2023, Vol. 22
2023, Vol. 22


