2. 首都儿科研究所附属儿童医院普通(新生儿)外科,北京 100020;
3. 北京积水潭医院小儿骨科,北京 100035
2. Department of General Surgery, Capital Institute of Pediatrics, Beijing 100020, China;
3. Department of Pediatric Orthopedics, Beijing Jishuitan Hospital, Beijing 100035, China
卵巢颗粒细胞瘤(ovarian granulosa cell tumor, OGCT)是一种具有颗粒细胞形态特征和内分泌功能的卵巢性索间质肿瘤,占所有卵巢癌的2% ~5%[1]。根据其临床和组织病理学特征分为幼年型颗粒细胞肿瘤(juvenile granulosa cell tumors, JGCT)和成年型颗粒细胞肿瘤(adult granulosa cell tumor, AGCT)。多发内生软骨瘤是一种罕见的非遗传性良性肿瘤,该病由Ollier于1899年首先报道,又称Ollier病(Ollier's disease, OD),患病率约1/100 000[2]。目前国外文献报道卵巢颗粒细胞瘤合并内生软骨瘤仅十余例,国内尚无相关报道。本研究对北京积水潭医院收治的1例卵巢幼年型颗粒细胞瘤合并多发内生软骨瘤病例进行回顾性分析,并进行相关文献复习,以提高临床医师对该病的认识。
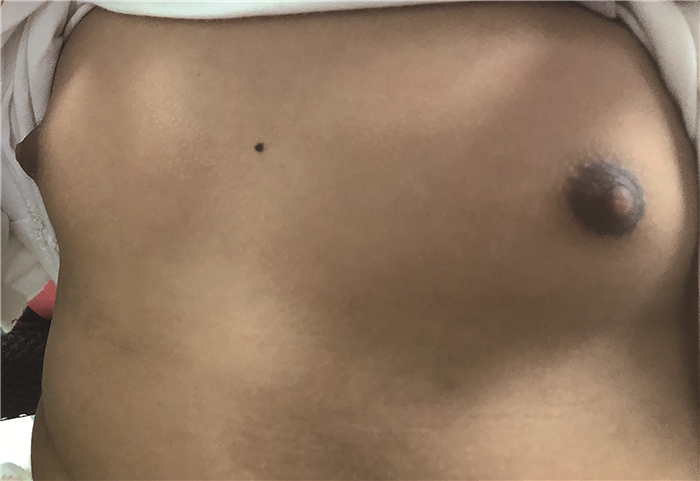
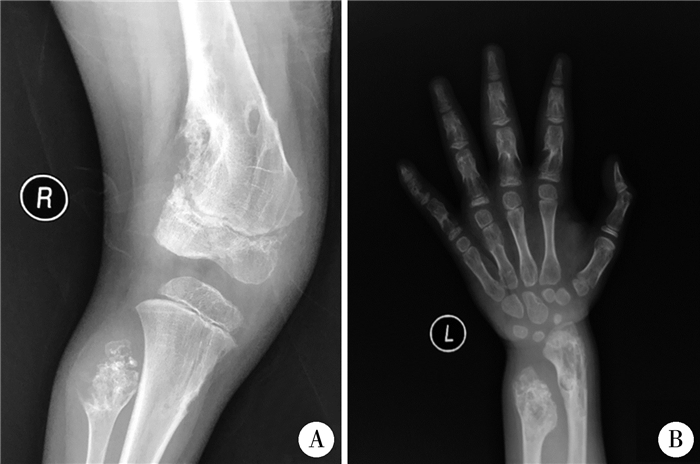
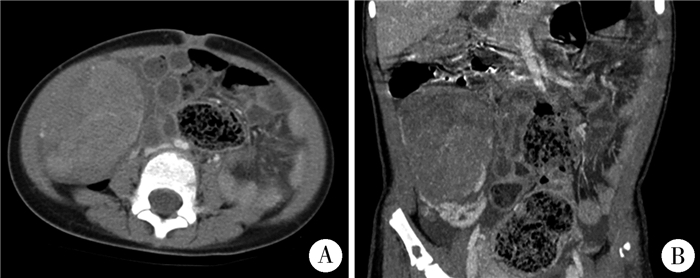
资料与方法 一、本例患儿临床资料患儿女,4岁6个月,2020年9月因发现双侧乳房增大2个月就诊。主要临床表现为双侧乳房增大,伴外阴分泌物。既往于2019年10月9日在北京积水潭医院小儿骨科诊断多发内生软骨瘤、右膝外翻畸形,行右股骨远端病灶刮除术+人工骨植入术。查体:腹软,右下腹触及一实性肿物,大小约80 mm×80 mm,质韧,活动度差,无压痛;四肢多发骨性隆起,质硬,无活动度,无波动性,皮肤无异常。四肢肌张力正常,肌力Ⅴ级。性发育情况:乳房Tanner分期:左侧为Ⅲ期,右侧为Ⅱ期,乳头色素沉着明显(图 1),阴毛Ⅰ期,大阴唇增大,可见淡黄色分泌物,未见血性物,腋毛Ⅰ期。性激素检查:卵泡刺激素(follicular stimulating hormone, FSH) 0.1 IU/L, 黄体生成素(luteinizing hormone, LH)<0.1 IU/L, 雌二醇(estradiol, E2) 1 211 pmol/L, 睾酮(testosterone, T) 0.862 nmol/L, 泌乳素(prolactin, PRL) 43.99 ng/mL, 孕酮(progesterone, PROG) 1.09 nmol/L,β-人绒毛膜促性腺激素(human chorionic gonadotropin, β-HCG)<0.1 nmol/L。盆腔超声可见右下腹一囊实性中等回声物,大小约81 mm×76 mm×57 mm,边界清晰,以实性为主,可见少量囊性暗区。四肢X线片见右股骨远端及胫腓骨骨质破坏、骨皮质膨胀中断、局部密度混杂不均。双肱骨远端及左尺桡骨下段骨质破坏,局部密度混杂不均,双尺骨鹰嘴骨皮质不规整(图 2)。腹部CT见右下腹团状软组织占位,大小约78 mm×55 mm×74 mm,边界尚清晰,腹腔见积液(图 3)。患儿临床信息的采集已征得患儿监护人知情同意并签署知情同意书,本研究已通过北京积水潭医院伦理委员会审核批准(202201—30)。
|
图 1 1例4岁6个月女性卵巢幼年型颗粒细胞瘤合并多发软骨瘤患儿双侧乳房照片 Fig.1 Asymmetrical breast development with apparent chromatosis |
|
图 2 1例4岁6个月女性卵巢幼年型颗粒细胞瘤合并多发软骨瘤患儿X线平片 Fig.2 Plain bone radiography of Ollier's disease 注 A:右股骨、右胫腓骨骨质破坏、局部密度混杂不均;B左尺桡骨下段、指骨骨质破坏 |
|
图 3 1例4岁6个月女性卵巢幼年型颗粒细胞瘤合并多发软骨瘤患儿腹部CT检查结果 Fig.3 Abdominal CT revealed right lower abdominal soft tissue mass 注 右下腹团状软组织占位,约78 mm×55mm×74 mm大小,边界尚清晰,增强扫描呈不均匀强化 |
患儿静脉吸入麻醉后取仰卧位,建立气腹并放置Trocar及腹腔镜器械探查,见右下腹实性肿物,大小约90 mm×80 mm×60 mm,包膜血供丰富,输卵管伞充血、水肿,子宫充血水肿,右侧未见正常卵巢组织。电钩及超声刀完整切除右侧卵巢肿物及附件。探查左侧卵巢、输卵管伞结构无明显异常。将肿物完整取出。查腹腔内无活动性出血,逐层缝合伤口,结束手术。
二、文献检索检索PubMed和万方数据库1977—2021年公开发表的卵巢颗粒细胞瘤合并多发内生软骨瘤的相关文献,检索词为“ovarian granulosa cell tumor”“Ollier's disease”。
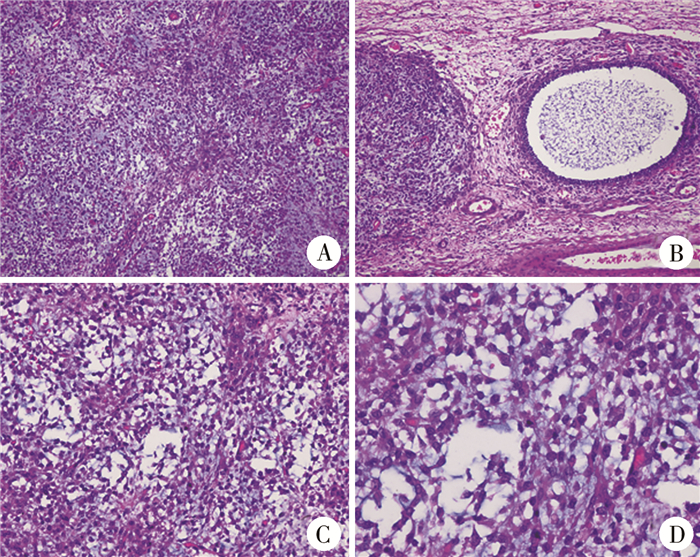
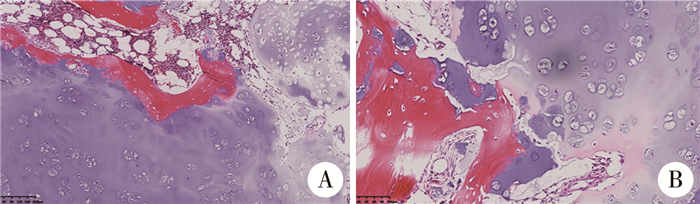
结果 一、本例患儿诊断与治疗结果病理检查结果:肉眼见右侧卵巢肿物部分区域黏液变性,大小约100 mm×75 mm×42 mm,大部分区域包膜完整,同侧输卵管未累及。镜下见瘤细胞大小、体积均匀一致。胞质丰富,嗜酸性或呈空泡状,细胞核深染,可见大小形态不一、边界清楚、圆形或不规则形状滤泡,滤泡被覆一至多层颗粒细胞,腔内含嗜碱性液体,实性区瘤细胞弥漫排列,周围间质中有泡膜细胞。形态及免疫组化染色符合卵巢幼年型颗粒细胞瘤。免疫组化染色结果:Vimentin(+),AE1/AE3(少量弱+),CK7(-),EMA(-),CD117(散在+),ER(-),PR(+),CD99(+),a-Inhibin(个别+),CD56(+),CD30(-),PLAP(-),SALL4(-),OCT3/4(-),HCG(-),Ki67(约30%+),CK8(-),SMA(+),Desmin(-),S-100(-)(图 4)。腹水涂片未见恶性细胞。根据国际妇产联合会(International Federation of Obstetrics and Gynecology,FIGO)分期为ⅠA期。骨骼多发肿物送病理检查,可见肿瘤性软骨局灶浸润破坏宿主骨,符合内生软骨瘤(图 5)。
|
图 4 1例4岁6个月女性卵巢幼年型颗粒细胞瘤患儿病理检查结果 Fig.4 Histopathological examination of JGCT 注 A:瘤细胞大小、体积较均匀(HE染色,×100);B:边界清楚、圆形或不规则形状滤泡,滤泡被覆一至多层颗粒细胞,腔内含嗜碱性液体(HE染色,×100);C(HE染色,×200)和D(HE染色,×400):实性区瘤细胞弥漫排列,周围间质中有泡膜细胞 |
|
图 5 1例4岁6个月女性多发内生软骨瘤患儿病理形态学结果 Fig.5 Histopathological examination of OD 注 A(HE染色×100)和B(HE染色×200):肿瘤性软骨局灶浸润破坏宿主骨 |
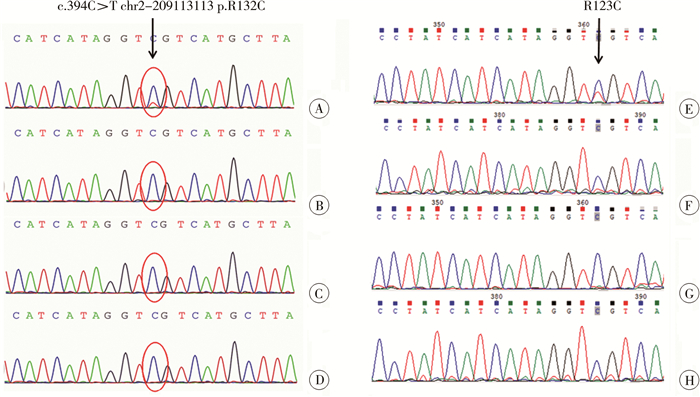
基因检测结果:取卵巢幼年型颗粒细胞瘤组织行全外显子基因检测,在脑胶质瘤易感相关基因IDH1存在一处体细胞嵌合变异,变异位点:c.394C>T chr2-209113113 p.R132C,合子型:杂合68/27 0.28。家系验证显示为新生变异(患儿血样未发现此位点变异),患儿父母IDH1基因变异均未携带。取多发内生软骨瘤组织样本采用Sanger测序对IDH1基因突变位点进行验证检测,提示IDH1基因存在与卵巢幼年型颗粒细胞瘤组织同样的突变位点,皮肤组织、肌肉组织和口腔黏膜样本在检测范围内未检出此突变(图 6)。
|
图 6 基因检测提示卵巢肿物组织及内生软骨瘤组织IDH1基因体细胞嵌合变异位点:c.394C>T chr2-209113113 p.R132C Fig.6 A c.394C>T chr2-209113113 p.R132C mutation of IDH1 gene was detected in both ovarian juvenile granulosa cell tumors and endchondroma 注 A:患儿卵巢肿瘤组织;B:患儿外周血;C:患儿父亲外周血;D:患儿母亲外周血;E:患儿内生软骨瘤组织;F:患儿皮肤组织;G:患儿肌肉组织;H:患儿口腔黏膜组织 |
随访结果:术后1周复查性激素:FSH 0.1 IU/L,LH<0.1 IU/L,E2 70.83 pmol/L,T<0.087 nmol/L,PRL 20.54 ng/mL,PROG 0.97 nmol/L。术后3个月随访,患儿双侧增大乳房已明显回缩,乳晕颜色变浅,大阴唇无增大。盆腔超声提示卵巢幼年型颗粒细胞瘤无复发。多发内生软骨瘤于术后1年随访,右股骨X线平片显示无复发。
二、文献检索结果截至2021年12月,仅有10例病例被报道,结合本例共11例,见表 1。11例患儿发病年龄从6个月至36岁不等,OD与JGCT发病先后无规律,有二者发生在肢体同一侧,也有OD发生在肢体一侧,JGCT发生在另一侧。青春期前发病的JGCT以外周性性早熟为主要表现,青春期及以后发病者多表现为月经异常、腹胀、腹部肿物。针对内生软骨瘤,9例予手术切除病变组织,1例保守治疗,1例右腿膝盖以下肢体及右中指截骨。针对JGCT,9例切除病变侧卵巢及输卵管,2例手术切除肿瘤后行化疗治疗。除2例发生软骨肉瘤恶变外,其余9例均为良性病变,随访3个月至7年无一例复发。
| 表 1 11例卵巢幼年型颗粒细胞瘤合并多发内生软骨瘤患儿临床资料 Table 1 Review of juvenile granulosa cell tumor (JGCT) associated with multiple enchondromatosis |
|
|
Scully[13]于1977年首次提出JGCT,约占颗粒细胞瘤的5%,由于肿瘤细胞可以分泌雌激素,临床表现为外周性性早熟,如乳房增大、阴阜发育、阴毛腋毛生长等,甚至出现无排卵性月经,部分病例还出现身高、骨龄过度超前发育。卵巢肿瘤快速生长,甚至扭转破裂引起急腹症症状及体征,如发热、腹水等[14]。在免疫组化方面,JGCT对α-inhibin、calretinin、SF-1免疫阳性,常表达vimentin、WT-1、CD56、CD99、CD10、SMA、S100、cytokaretin,很少表达EMA[15]。本例患儿为学龄前期女童,以性早熟起病,血雌激素及泌乳素明显升高,卵巢肿物组织HE形态符合JGCT组织学特点,免疫组化提示Vimentin(+),CD99(+),a-Inhibin(个别+),CD56(+),AE1/AE3(少量弱+),SMA(+),EMA(-),符合卵巢幼年型颗粒细胞瘤诊断。患儿术后1周性激素水平已恢复正常,乳房逐渐回缩至青春期前状态,乳晕色素沉着逐渐变浅,支持卵巢幼年型颗粒细胞肿瘤为外周性性早熟的病因。
本例JGCT患儿根据FIGO分期判定为IA期,主要采取手术切除右侧卵巢及附件,无需辅助放疗、化疗。回顾文献中相关病例报道,大部分以单侧切除患侧卵巢及附件为主,整体预后良好。由于卵巢JGCT发病率极低、组织学类型多样、生物学行为复杂,很难确定其最佳治疗方案。明确肿瘤分期是制定手术方案及评估预后的前提。除剖腹探查外,分期评估还应包括对侧卵巢活检和腹膜细胞学检查。手术是JGCT主要治疗手段,通常采取单侧输卵管- 卵巢切除术以保留生育功能,不推荐进行对侧卵巢楔形活组织检查和淋巴清扫,因为性索间质肿瘤较少发生淋巴结转移[16]。李治憙等[17]也认为手术是有效治疗小儿卵巢肿瘤、改善恶性卵巢肿瘤患儿预后的重要方法。放疗与化疗对JGCT的治疗价值尚不清楚[14]。血清抑制素可作为颗粒细胞瘤的特异性标志物,也是检测复发的可靠标志物。
多发内生软骨瘤多在儿童早期出现,主要表现为多部位软骨发育异常,四肢可触及无痛性肿块。发病机制不明,可能是由于软骨组织异位岛的增殖或骨骺板无法成熟,导致正常软骨骨化失败,进而形成骨骼中残留软骨样增生[18]。近年来,IDH基因杂合突变已被证明是软骨瘤发展的关键事件[2]。治疗方法包括保守治疗、单纯病灶刮除术和病灶刮除术+植骨术; 无临床症状时无需治疗,保守观察即可; 当短时间内生长加快或出现局部肿胀甚至病理性骨折时往往需要进行手术治疗[19]。
JGCT合并OD的发病关联机制目前尚未明确,多位学者认为疾病起源于广泛性中胚层发育不良[9-10]。在胚胎发育早期,外侧板中胚层最终形成骨骼的长骨,而相邻中胚层形成性腺。因此,中胚层发育进程异常可能导致多发内生软骨瘤和卵巢颗粒细胞瘤。本院收治患儿卵巢幼年型颗粒细胞瘤组织及外周血、患儿父母外周血全外显子基因检测结果提示患儿卵巢幼年型颗粒细胞瘤组织中IDH1基因存在一处体细胞嵌合变异,变异位点:c.394C>T chr2-209113113 p.R132C,患儿血样及其父母此位点变异均未携带该变异位点。Sanger测序验证突变位点提示患儿内生软骨瘤组织IDH1基因存在与卵巢幼年型颗粒细胞瘤同样突变位点,进一步提示IDH1基因突变可能是两种肿瘤发病的关键因素。国外有研究指出IDH1基因突变已在85%的多发内生软骨瘤患者中被描述[20]。IDH基因的杂合突变与多发内生软骨瘤有关,主要是IDH1 (占98%)和IDH2 (占2%),这些突变表达出一种类似于纤维发育不良和骨软骨瘤的肿瘤嵌合体[21]。因此,卵巢颗粒细胞瘤合并多发内生软骨瘤罕见,治疗以手术为主,IDH1基因突变可能在二者发病中起到一定关联作用,但仍需进一步探究。
虽然在现有JGCT合并OD的病例报道中,大部分患者预后良好,但有报道OD的恶变率在5% ~50%之间,儿童应每6~12个月定期进行临床筛查,每2~3年进行一次已知软骨瘤病变的平片检查,以便早期发现需要手术治疗的骨骼生长异常[22]。大多数JGCT发生在早期,预后良好,但其复发率较高[14]。因此,患儿术后定期随访对提高生存率至关重要。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 张金、万乃君负责研究设计、数据收集、文章撰写与修改;马立霜、刘超、张艳霞、吕学敏负责标本收集、文献检索
| [1] |
Kilinc YB, Sari L, Toprak H, et al. Ovarian granulosa cell tumor: a clinicoradiologic series with literature review[J]. Curr Med Imaging, 2021, 17(6): 790-797. DOI:10.2174/1573405616666201228153755 |
| [2] |
Diezi M, Zambelli PY, Superti-Furga A, et al. Cancer surveillance in children with Ollier disease and Maffucci syndrome[J]. Am J Med Genet A, 2021, 185(4): 1338-1340. DOI:10.1002/ajmg.a.62078 |
| [3] |
Tamimi HK, Bolen JW. Enchondromatosis (Ollier's disease) and ovarian juvenile granulosa cell tumor[J]. Cancer, 1984, 53(7): 1605-1608. DOI:10.1002/1097-0142(19840401)53:7<1605::aid-cncr2820530731>3.0.co;2-n |
| [4] |
Pounder DJ, Iyer PV, Davy ML. Bilateral juvenile granulosa cell tumours associated with skeletal enchondromas[J]. Aust N Z J Obstet Gynaecol, 1985, 25(2): 123-126. DOI:10.1111/j.1479-828x.1985.tb00624.x |
| [5] |
Vaz RM, Turner C. Ollier disease (enchondromatosis) associated with ovarian juvenile granulosa cell tumor and precocious pseudopuberty[J]. J Pediatr, 1986, 108(6): 945-947. DOI:10.1016/s0022-3476(86)80936-2 |
| [6] |
Velasco-Oses A, Alonso-Alvaro A, Blanco-Pozo A, et al. Ollier's disease associated with ovarian juvenile granulosa cell tumor[J]. Cancer, 1988, 62(1): 222-225. DOI:10.1002/1097-0142(19880701)62:1<222::aid-cncr2820620134>3.0.co;2-w |
| [7] |
Asirvatham R, Rooney RJ, Watts HG. Ollier's disease with secondary chondrosarcoma associated with ovarian tumour.A case report[J]. Int Orthop, 1991, 15(4): 393-395. DOI:10.1007/BF00186886 |
| [8] |
Tanaka Y, Sasaki Y, Nishihira H, et al. Ovarian juvenile granulosa cell tumor associated with Maffucci's syndrome[J]. Am J Clin Pathol, 1992, 97(4): 523-527. DOI:10.1093/ajcp/97.4.523 |
| [9] |
Gell JS, Stannard MW, Ramnani DM, et al. Juvenile granulosa cell tumor in a 13-year-old girl with enchondromatosis (Ollier's disease): a case report[J]. J Pediatr Adolesc Gynecol, 1998, 11(3): 147-150. DOI:10.1016/s1083-3188(98)70135-4 |
| [10] |
Rietveld L, Nieboer TE, Kluivers KB, et al. First case of juvenile granulosa cell tumor in an adult with Ollier disease[J]. Int J Gynecol Pathol, 2009, 28(5): 464-467. DOI:10.1097/PGP.0b013e3181a05af4 |
| [11] |
Burgetova A, Matejovsky Z, Zikan M, et al. The association of enchondromatosis with malignant transformed chondrosarcoma and ovarian juvenile granulosa cell tumor (Ollier disease)[J]. Taiwan J Obstet Gynecol, 2017, 56(2): 253-257. DOI:10.1016/j.tjog.2017.02.002 |
| [12] |
Jalaeefar A, Shirkhoda M, Sharifi A, et al. Granulosa cell tumor of the ovary accompanying with Ollier's disease: first case of contralateral presentations[J]. J Obstet Gynaecol India, 2020, 70(1): 81-85. DOI:10.1007/s13224-019-01243-1 |
| [13] |
Scully RE. Ovarian tumors.A review[J]. Am J Pathol, 1977, 87(3): 686-720. |
| [14] |
Merras-Salmio L, Vettenranta K, Möttönen M, et al. Ovarian granulosa cell tumors in childhood[J]. Pediatr Hematol Oncol, 2002, 19(3): 145-156. DOI:10.1080/088800102753541297 |
| [15] |
Lim D, Oliva E. Ovarian sex cord-stromal tumours: an update in recent molecular advances[J]. Pathology, 2018, 50(2): 178-189. DOI:10.1016/j.pathol.2017.10.008 |
| [16] |
林宏, 刘岿然, 冯子懿. 卵巢幼年型颗粒细胞瘤诊断及治疗的研究进展[J]. 医学综述, 2018, 24(19): 3802-3806. Lin H, Liu KR, Feng ZY. Research advances in the diagnosis and treatment of juvenile granulosa cell tumor of ovary[J]. Medical Recapitulate, 2018, 24(19): 3802-3806. DOI:10.3969/j.issn.1006-2084.2018.19.012 |
| [17] |
李治熹, 蒋文军, 曹李明, 等. 小儿卵巢肿瘤56例临床分析[J]. 临床小儿外科杂志, 2016, 15(5): 485-487. Li ZX, Jiang WJ, Cao LM, et al. Clinical analysis of ovarian tumors in children: a report of 56 cases[J]. J Clin Ped Sur, 2016, 15(5): 485-487. DOI:10.3969/j.issn.1671-6353.2016.05.020 |
| [18] |
Angelini A, Baracco R, Dolci A, et al. Limb lengthening for deformities in Ollier's disease: a systematic review[J]. Eur J Orthop Surg Traumatol, 2020, 30(8): 1325-1332. DOI:10.1007/s00590-020-02692-5 |
| [19] |
杨虎, 卢荟. 内生软骨瘤综合诊治进展[J]. 浙江中西医结合杂志, 2016, 26(9): 877-880. Yang H, Lu H. Recent advances in the diagnosis and treatment of enchondroma[J]. Zhejiang J Integr Tradit Chin West Med, 2016, 26(9): 877-880. DOI:10.3969/j.issn.1005-4561.2016.09.044 |
| [20] |
Bruce-Brand C, Govender D. Gene of the month: IDH1[J]. J Clin Pathol, 2020, 73(10): 611-615. DOI:10.1136/jclinpath-2020-206813 |
| [21] |
Kumar A, Jain VK, Bharadwaj M, et al. Ollier disease: pathogenesis, diagnosis, and management[J]. Orthopedics, 2015, 38(6): e497-e506. DOI:10.3928/01477447-20150603-58 |
| [22] |
El Abiad JM, Robbins SM, Cohen B, et al. Natural history of Ollier disease and Maffucci syndrome: patient survey and review of clinical literature[J]. Am J Med Genet A, 2020, 182(5): 1093-1103. DOI:10.1002/ajmg.a.61530 |
 2023, Vol. 22
2023, Vol. 22


