2. 苏州大学附属儿童医院普外科,苏州 215025
2. Department of Pediatric Surgery, Children's Hospital of Soochow University, Suzhou 215025, China
新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿时期特有的累及肠道组织的炎症坏死性疾病,多见于早产儿和低出生体重儿[1]。近年来新生儿疾病的诊疗水平不断提高,但相较于其他新生儿疾病,NEC的病死率仍然较高,因此进一步探究NEC的病理生理过程尤为重要[2-3]。NEC是一种多因素疾病,其危险因素包括早产、非母乳营养和微生物定植,但具体发病机制尚未完全明确[4]。优良的动物模型有利于研究者针对疾病的病因、病理生理、诊治和预防进行深入研究。但目前NEC动物模型的建立方法仍存在较大争议。本研究通过比较4种NEC动物模型的建立方法,旨在明确一种相对简便且与NEC患儿临床特征相似度更高的方法,以帮助研究人员更好地探索NEC的发病机制,改善NEC患儿的预后。
资料与方法 一、实验材料 (一) 实验动物与模型建立从昭衍(苏州)新药研究中心有限公司[生产许可证号:SCXK(苏)2018 — 0006]购买5日龄无特定病原体(specific pathogen free, SPF)级C57BL/6新生小鼠,在苏州大学附属儿童医院儿科临床研究所的动物实验中心适应性喂养2 d(即小鼠达7日龄)后开始造模。分组方案如下:将54只7日龄新生小鼠随机分为对照组(Ctrl组,10只)、缺氧+人工喂养组(HF组,10只)、缺氧+人工喂养+冷刺激组(Cold组,12只)、缺氧+人工喂养+脂多糖(lipopolysaccharide, LPS)组(LPS组,11只)和缺氧+人工喂养+NEC患儿肠内细菌组(Bac组,11只)。
造模条件:①缺氧:每日早晚固定时间将小鼠置于缺氧环境(95%N2+5%O2),每日2次,每次10 min;②人工喂养:将配制好的高渗配方奶(3 g牛奶粉和2 g羊奶粉溶于10 mL纯水)经口置入胃管,以管饲高渗配方奶的方式进行人工喂养,每次剂量为40 μL/g小鼠体重,每日3次;③冷刺激:每日早晚固定时间对小鼠进行低温刺激(4℃),每日2次, 每次10 min;④LPS:在造模第2、3天的第2次人工喂养配方奶中加入LPS(4 μg/g);⑤NEC患儿肠内细菌:在喂养的配方奶中加入3例严重NEC患儿的粪便原浆(1 mL配方奶中加入12.5 μL粪便原浆)。Ctrl组不予干预,继续由母鼠喂养。整个造模周期为96 h。
(二) 主要试剂与仪器牛奶粉(美国雅培公司),羊奶粉(美国倍酷公司),LPS(美国Sigma公司),TUNEL和cleaved-caspase3 (CC3)(武汉赛维尔生物科技有限公司),RIPK1抗体(武汉三鹰生物技术有限公司),PARP1、β-catenin和β-actin抗体(美国CST公司),Occludin抗体(英国Abcam公司),RIPA裂解液(碧云天生物科技公司),All-In-One 5X RT MasterMix(加拿大ABM公司),24GY型静脉留置针(美国BD公司),希玛AR8100氧浓度测试仪,实验动物缺氧仓。
二、实验方法 (一) 观察小鼠一般情况将小鼠分组编号并称量体重,之后于每日实验开始前称量体重。造模期间仔细观察5组小鼠的状态,包括活动性、皮肤颜色、反应能力、腹部膨隆、腹泻、大便性状、呕吐等;记录小鼠在造模期间的具体死亡时间与数量。
(二) 肠道大体与病理学检测96 h造模结束后,麻醉小鼠,沿腹中线纵向切开小鼠腹部,分离盲肠及回肠,观察各组小鼠的肠管外形、颜色以及肠壁是否有串珠样积气、坏死等。用磷酸缓冲盐溶液(phosphate balanced solution, PBS)冲洗肠道后剪取约1 cm回肠末端标本,用4%多聚甲醛固定。固定后的组织放入脱水盒中依次用99%、85%、75%浓度酒精进行组织脱水,然后加入液体石蜡制作蜡块,于包埋机内将浸好蜡的组织包埋,石蜡切片机切片,厚度约4 um。最后行苏木精-伊红(hematoxylin-eosin stain, HE)常规染色,于显微镜下观察并进行肠道病理损伤评分。评分参考Nadler评分系统,组织学评分≥2分判定为NEC样肠道损伤[5]。
(三) 肠道多核苷酸链断裂(terminal deoxynucleotidyltransferase-mediated dUTP nick-end labeling,TUNEL)检测石蜡切片脱蜡后按照赛维尔公司提供的tunel试剂盒操作步骤进行染色,封片后在荧光显微镜下观察tunel染色结果。
(四) 蛋白印迹法检测取新鲜回肠末端标本加入适量含磷酸酶和蛋白酶抑制剂的蛋白裂解液(Radio-Immunoprecipitation Assay,RIPA)充分低温研磨,冰上静置裂解30 min,离心,留上清液,加入相应量的蛋白上样缓冲液,100℃金属浴10 min使蛋白充分变性。根据蛋白含量进行上样、电泳、转膜、封闭、一抗二抗孵育,最后浸泡于显色液显影,并用Image J软件分析蛋白表达量。
(五) 免疫荧光检测回肠末端标本石蜡切片脱蜡后进行抗原修复,在组织周围画圈防止抗体丢失,用血清封闭30 min后加入一抗,于4℃湿盒孵育过夜,PBS清洗后加入二抗,避光孵育45 min,PBS清洗后用4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole,DAPI)避光染核5 min。加入荧光淬灭剂后立即封片,使用荧光显微镜观察染色结果。
(六) 实时荧光定量PCR(qRT-PCR)使用Trizol法提取回肠末端标本总RNA,根据All-In-One 5X RT MasterMix操作说明书步骤合成cDNA,PCR反应采用三步法扩增,用2-△△Ct分析各基因的mRNA水平。各引物序列如下:IL-6:(F)5'-CTGCAAGAGACTTCCATCCAG-3',(R)5'-AGTGGTATAGACAGGTCTGTTGG-3';TNF-α:(F)5'-CAGGCGGTGCCTATGTCTC-3',(R)5'-CGATCACCCCG-AAGTTCAGTAG-3';MCP1:(F)5'-TTAAAAACCTGGATCGGAACCAA-3',(R)5'-GCATTAGCTTCAGATTTACGGGT-3';β-actin:(F)5'-AGAGGGAAATCGTG- CGTGAC-3',(R)5'-CAATAGTGATGACCTGGCCGT-3'。
三、统计学处理应用Graphpad Prism 8进行统计学分析。服从正态分布和方差齐性的计量资料以x±s表示,多组间比较采用单因素方差分析,整体差异有统计学意义的基础上两两组间比较采用LSD-t检验;非正态分布的计量资料以M(Q1,Q3)表示,多组间比较采用Kruskal-Wallis H检验,整体差异有统计学意义的基础上两两组间比较采用Mann-Whitney U检验。存活率采用Log-Rank检验,生存曲线采用Kaplan-Meier分析。P<0.05为差异有统计学意义。
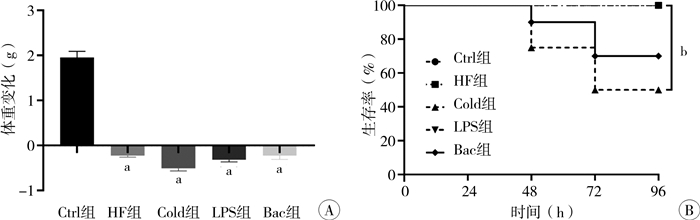
结果 一、一般情况与生长状况造模期间,与Ctrl组相比,HF组、Cold组、LPS组和Bac组小鼠造模期间均有不同程度精神萎靡,活动量减少,蜷缩抽搐,腹胀腹泻,偶有血便,腹部皮肤略苍白,皮下脂肪减少;HF组症状相对较轻,Cold组、LPS组和Bac组症状相对较重。造模结束后各造模组小鼠体重均明显减轻[HF组为(-0.224±0.113)g;Cold组为(-0.508±0.142)g;LPS组为(-0.317±0.14)g;Bac组为(-0.230±0.224)g],与Ctrl组相比差异均有统计学意义(P<0.001),但各造模组之间体重改变差异无统计学意义(P>0.05,图 1A)。造模期间,Ctrl组、HF组和LPS组均无小鼠死亡,存活率均为100%;而Cold组死亡6只,存活率为50%(6/12),与Ctrl组相比差异有统计学意义(P<0.05);Bac组死亡3只,存活率为72.7%(8/11),与Ctrl组相比,差异无统计学意义(P>0.05,图 1B)。
|
图 1 各NEC造模组小鼠的一般情况 Fig.1 General conditions of mice in each NEC group 注 A:各NEC造模组小鼠与Ctrl组小鼠体重比较(a表示P<0.001);B:NEC造模组小鼠与Ctrl组小鼠存活率比较(b表示P<0.05);NEC:新生儿坏死性小肠结肠炎;Ctrl:对照组;HF组:缺氧+人工喂养组;Cold组:缺氧+人工喂养+冷刺激组;LPS组:缺氧+人工喂养+脂多糖;Bac组:缺氧+人工喂养+NEC肠内细菌组 |
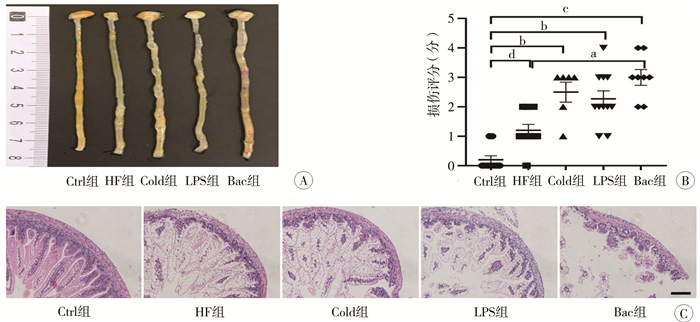
肉眼观察肠道外观,Ctrl组肠管呈淡黄色,弹性好;HF组、Cold组和LPS组肠管颜色略淡,肠壁韧性差,易破损,有不同程度的肠壁积气,以Cold组和Bac组串珠样积气最为明显。此外,Bac组肠管颜色较红,弹性差,有积气和血性渗出物(图 2A)。病理结果显示,Ctrl组绒毛结构完整无断裂,排列整齐,病理损伤平均分为0.2分;HF组绒毛水肿轻,排列较整齐,黏膜及黏膜上皮层轻度水肿,病理损伤平均分为1.2分,未达到Nadler的NEC评分标准;Cold组、LPS组、Bac组均有不同程度的绒毛断裂、脱落和消失,排列紊乱,有中度或重度黏膜下和(或)固有层分离,病理损伤平均分分别为2.5、2.3、3分,与Ctrl组相比,差异均有统计学意义(P<0.05,图 2B、图 2C)。按照Nadler双盲法将病理评分≥2分判定为NEC样肠道损伤,Cold组、LPS组和Bac组的NEC动物模型成功率分别为83.3%、81.8%和100%。
|
图 2 各组小鼠肠道的宏观大体标本和病理切片对比 Fig.2 Comparison of macroscopic specimens and pathological sections of murine intestine in each group 注 A:各组小鼠肠道的形态对比;B、C:各组肠道组织损伤评分及病理结果(HE染色×200,标尺为100 μm),a表示P<0.05;b表示P<0.01;c表示P<0.001;d表示P>0.05;Ctrl:对照组;HF组:缺氧+人工喂养组;Cold组:缺氧+人工喂养+冷刺激组;LPS组:缺氧+人工喂养+脂多糖;Bac组:缺氧+人工喂养+NEC肠内细菌组 |
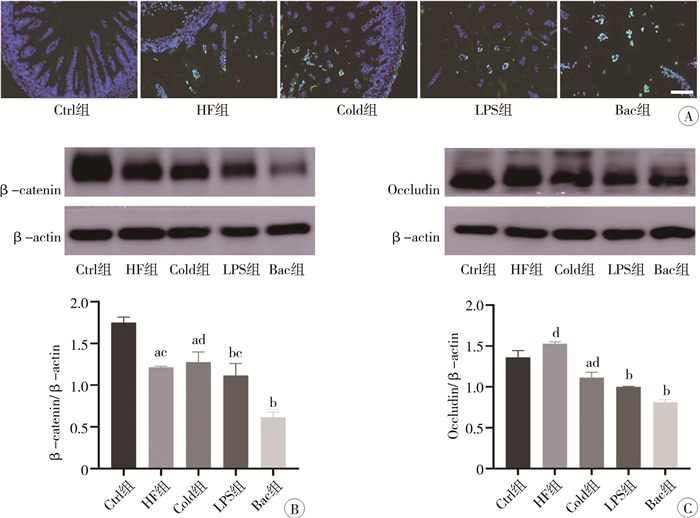
TUNEL法检测各组肠道细胞死亡结果显示,绒毛尖端TUNEL阳性细胞数最多,表明肠上皮尖端损伤最严重(图 3A)。与Ctrl组相比,肠道上皮屏障的黏附连接蛋白β-catenin在各NEC造模组的表达均下降,差异有统计学意义(P<0.05);其中Bac组β-catenin蛋白表达下降最明显,与HF组、Cold组和LPS组相比,差异有统计学意义(P<0.05,图 3B)。与Ctrl组相比,Cold组、LPS组和Bac组肠道上皮屏障的紧密连接蛋白Occludin表达下降,差异有统计学意义(P<0.05);Bac组的Occludin蛋白表达下降最显著,与HF组和Cold组相比,差异有统计学意义(P<0.05,图 3C)。4种造模方式中,Bac组肠道屏障损伤最严重。
|
图 3 各组小鼠肠道屏障功能障碍情况对比 Fig.3 Comparison of intestinal barrier dysfunction of mice of in each group 注 A:各组小鼠肠道的TUNEL染色(绿色,标尺为100 μm);B: 蛋白质印迹法检测肠道屏障蛋白β-连环蛋白和内参β-肌动蛋白的蛋白条带及蛋白表达量;C: 蛋白质印迹法检测肠道屏障蛋白咬合蛋白和内参β-肌动蛋白的蛋白条带及蛋白表达量(a表示与Ctrl组比较P<0.05;b表示与Ctrl组比较P<0.01;c表示与Bac组比较P<0.05;d表示与Bac组比较P<0.01);Ctrl:对照组;HF组:缺氧+人工喂养组;Cold组:缺氧+人工喂养+冷刺激组;LPS组:缺氧+人工喂养+脂多糖;Bac组:缺氧+人工喂养+NEC肠内细菌组 |
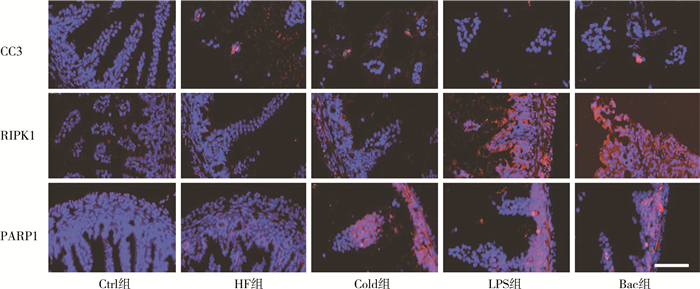
CC3、RIPK1和PARP1分别是细胞凋亡、坏死性凋亡和parthanatos细胞死亡途径的标记性分子。用免疫荧光技术检测细胞死亡途径的标记性分子表达显示,CC3在Ctrl组不表达,在各NEC造模组均表达;RIPK1和PARP1在LPS组与Bac组表达明显(图 4),Bac组和LPS组肠道坏死最严重。
|
图 4 各组小鼠肠上皮细胞死亡数量对比 Fig.4 Increased number of intestinal epithelial cell death of mice in each group 注 小鼠肠道组织CC3(细胞凋亡)、RIPK1(坏死性凋亡)和PARP1(parthanatos)免疫荧光染色(红色,×600,标尺为100 μm);Ctrl:对照组;HF组:缺氧+人工喂养组;Cold组:缺氧+人工喂养+冷刺激组;LPS组:缺氧+人工喂养+脂多糖;Bac组:缺氧+人工喂养+NEC肠内细菌组 |
检测各组肠道组织的细胞因子和趋化因子发现,与Ctrl组相比,IL-6(图 5A)和TNF-α(图 5B)以及趋化因子MCP1(图 5C)在LPS组和Bac组的表达显著升高,差异有统计学意义(P<0.05);而HF组和Cold组上述细胞因子的表达变化与Ctrl组相比,差异无统计学意义(P>0.05)。
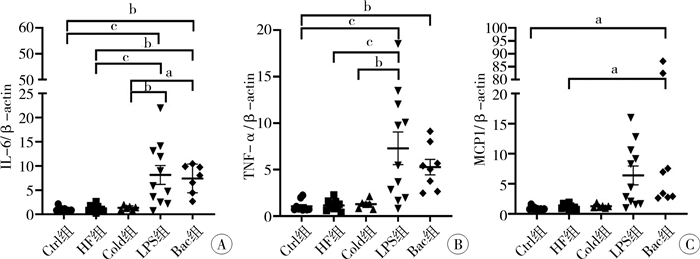
|
图 5 各组小鼠肠道组织过度炎症反应的对比 Fig.5 Comparison of excessive inflammatory response in intestinal tissue of mice in each group 注 A:qRT-PCR检测炎症因子IL-6的表达量;B:qRT-PCR检测炎症因子TNF-α的表达量;C:qRT-PCR检测趋化因子MCP1的表达量(a表示P<0.05;b表示P<0.01;c表示P<0.001);Ctrl:对照组;HF组:缺氧+人工喂养组;Cold组:缺氧+人工喂养+冷刺激组;LPS组:缺氧+人工喂养+脂多糖;Bac组:缺氧+人工喂养+NEC肠内细菌组 |
目前国际上尚无统一的NEC动物模型建立方法。本研究比较了国内外相对常见的4种NEC造模方法。实验结果显示,与其他3种造模方式相比,Bac组肠道组织学和肠道上皮屏障蛋白损伤最严重,肠上皮细胞死亡和炎症反应明显。因此与其他造模方式相比,采用含严重NEC患儿肠内细菌的高渗配方奶,辅以间断性缺氧来诱导新生小鼠发生NEC样肠道损伤是最贴近NEC患儿临床特征的一种造模方法。
造模期间,4个NEC造模组的小鼠均出现了NEC的临床特征性表现,如体重下降、吐奶、腹部膨隆、腹泻或便血、尿潴留。其中,Cold组小鼠精神萎靡,活动状态最差,体重减轻最明显,存活率最低(仅50%),这与已有的研究结果一致[6-7]。给予实验动物冷刺激能够降低肠系膜血流量,造成选择性循环缺血,最终引起NEC样肠道坏死。但并非所有暴露于缺氧或冷刺激下的早产儿都会患NEC,这可能与缺氧或冷刺激应激的次数及频率相关[8]。
本研究中Cold组小鼠一般情况较差,但肠道组织损伤没有LPS组与Bac组小鼠严重。LPS是绝大多数革兰氏阴性菌细胞壁的主要成分,通过激活TLR4可以引起肠道组织屏障修复功能受损,肠腔内细菌移位导致血管收缩,最终造成肠道缺血坏死[9]。然而,LPS并非NEC独有,它还可以诱导全身性炎症疾病(如脓毒症),且LPS并不能代表与NEC相关的所有细菌成分。以往研究发现在NEC发生之前就存在肠道菌群改变,且梭状芽胞杆菌、阪崎肠杆菌、肺炎克雷伯菌和铜绿假单胞菌均与NEC的发生有关。但由于这些微生物也常见于非NEC患者,所以它们不符合微生物与疾病发病机制之间的因果关系,即科赫法则[10-11]。这样看来,NEC属于没有统一微生物定植的疾病,单个致病病原体不会诱导NEC的发生,这与NEC是一种多因素疾病的观点不谋而合。16S rRNA基因测序结果显示,与曾经因复杂NEC行肠道吻合术的婴儿相比,NEC患儿肠内细菌中专性厌氧菌(梭菌和拟杆菌)数目增加,菌群多样性下降,所以采用严重NEC患儿的肠内细菌进行NEC动物造模更加符合NEC的病理生理过程[12]。本研究发现Bac组小鼠肠道组织韧性差,串珠状积气与坏死明显,故肠道组织损伤最为严重。
肠道组织的损伤由肠上皮细胞死亡引起。近年来,随着对细胞死亡途径分子机制的深入研究,细胞死亡方式的分类与命名被不断更新。研究表明,细胞凋亡、细胞焦亡、坏死性凋亡均参与NEC肠上皮细胞死亡[13-15]。Parthanatos是一种由PARP1介导的新型程序性细胞死亡方式[16]。本研究中,细胞凋亡、坏死性凋亡和parthanatos的标记性分子CC3、RIPK1和PARP1以及TUNEL染色在LPS组和Bac组中均明显上调,说明这两种造模方式的小鼠肠道上皮细胞死亡数目多,三种死亡方式均参与肠道组织的损伤。因此在NEC发展进程中,肠上皮细胞可能存在多种死亡途径,各途径之间可能具有协同效应,最终导致NEC肠道坏死。理想的动物模型不仅要求操作简单、结果稳定性强、成功率高,更需要与人类疾病的发病机制、病理生理及临床表现相似。本研究中Bac组的造模方法(即间断性缺氧加含有严重NEC患儿肠内细菌的配方奶喂养)可引起大部分新生小鼠出现NEC样肠道损伤,因此是较为理想的NEC动物模型建立方法。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 徐铃琪、马淑蓉、陈璐璐、周慧婷负责研究的设计、实施和起草文章、数据收集及分析;汪健负责研究设计、文章审核校对
| [1] |
周思海, 顾茜, 刘晓莉, 等. 新生儿坏死性小肠结肠炎全麻手术后苏醒延迟的相关因素分析[J]. 临床小儿外科杂志, 2021, 20(10): 968-973. Zhou SH, Gu Q, Liu XL, et al. Risk factors of delayed recovery after general anesthesia in infants with neonatal necrotizing enterocolitis[J]. J Clin Ped Sur, 2021, 20(10): 968-973. DOI:10.12260/lcxewkzz.2021.10.014 |
| [2] |
Talavera MM, Bixler G, Cozzi C, et al. Quality improvement initiative to reduce the necrotizing enterocolitis rate in premature infants[J]. Pediatrics, 2016, 137(5): e20151119. DOI:10.1542/peds.2015-1119 |
| [3] |
Liang SX, Lai PJ, Li XB, et al. Ulinastatin reduces the severity of intestinal damage in the neonatal rat model of necrotizing enterocolitis[J]. Med Sci Monit, 2019, 25: 9123-9130. DOI:10.12659/MSM.919413 |
| [4] |
邓姗姗, 朱海涛, 陈宇, 等. C57BL/6新生小鼠坏死性小肠结肠炎模型改建与评估[J]. 中华小儿外科杂志, 2018, 39(5): 376-382. Deng SS, Zhu HT, Chen Y, et al. Improvements and assessments of a neonatal murine model of necrotizing enterocolitis in C57BL/6 mice[J]. Chin J Pediatr Surg, 2018, 39(5): 376-382. DOI:10.3760/cma.j.issn.0253-3006.2018.05.012 |
| [5] |
Zani A, Cordischi L, Cananzi M, et al. Assessment of a neonatal rat model of necrotizing enterocolitis[J]. Eur J Pediatr Surg, 2008, 18(6): 423-426. DOI:10.1055/s-2008-1038951 |
| [6] |
Guven A, Gundogdu G, Vurucu S, et al. Medical ozone therapy reduces oxidative stress and intestinal damage in an experimental model of necrotizing enterocolitis in neonatal rats[J]. J Pediatr Surg, 2009, 44(9): 1730-1735. DOI:10.1016/j.jpedsurg.2009.01.007 |
| [7] |
Bell RL, Withers GS, Kuypers FA, et al. Stress and corticotropin releasing factor (CRF) promote necrotizing enterocolitis in a formula-fed neonatal rat model[J]. PLoS One, 2021, 16(6): e0246412. DOI:10.1371/journal.pone.0246412 |
| [8] |
Barlow B, Santulli TV. Importance of multiple episodes of hypoxia or cold stress on the development of enterocolitis in an animal model[J]. Surgery, 1975, 77(5): 687-690. |
| [9] |
Yazji I, Sodhi CP, Lee EK, et al. Endothelial TLR4 activation impairs intestinal microcirculatory perfusion in necrotizing enterocolitis via eNOS-NO-nitrite signaling[J]. Proc Natl Acad Sci USA, 2013, 110(23): 9451-9456. DOI:10.1073/pnas.1219997110 |
| [10] |
安宗剑, 孙勇. 新生儿肠道菌群与坏死性小肠结肠炎发病关系的研究进展[J]. 临床小儿外科杂志, 2019, 18(5): 356-360. An ZJ, Sun Y. Research advances of neonatal intestinal microbiome and necrotizing enterocolitis[J]. J Clin Ped Sur, 2019, 18(5): 356-360. DOI:10.3969/j.issn.1671-6353.2019.05.004 |
| [11] |
Morowitz MJ, Poroyko V, Caplan M, et al. Redefining the role of intestinal microbes in the pathogenesis of necrotizing enterocolitis[J]. Pediatrics, 2010, 125(4): 777-785. DOI:10.1542/peds.2009-3149 |
| [12] |
Brower-Sinning R, Zhong D, Good M, et al. Mucosa-associated bacterial diversity in necrotizing enterocolitis[J]. PLoS One, 2014, 9(9): e105046. DOI:10.1371/journal.pone.0105046 |
| [13] |
Yang YJ, Zhang T, Zhou GY, et al. Prevention of necrotizing enterocolitis through milk polar lipids reducing intestinal epithelial apoptosis[J]. J Agric Food Chem, 2020, 68(26): 7014-7023. DOI:10.1021/acs.jafc.0c02629 |
| [14] |
胡丹慧, 刘海英. 细胞焦亡(pyroptosis)参与大鼠坏死性小肠结肠炎的致病作用[J]. 细胞与分子免疫学杂志, 2018, 34(12): 1070-1074. Hu DH, Liu HY. Role of pyroptosis in the pathogenesis of necrotizing enterocolitis[J]. Chin J Cell Mol Immunol, 2018, 34(12): 1070-1074. DOI:10.13423/j.cnki.cjcmi.008718 |
| [15] |
Werts AD, Fulton WB, Ladd MR, et al. A novel role for necroptosis in the pathogenesis of necrotizing enterocolitis[J]. Cell Mol Gastroenterol Hepatol, 2020, 9(3): 403-423. DOI:10.1016/j.jcmgh.2019.11.002 |
| [16] |
Li DF, Kou YY, Gao Y, et al. Oxaliplatin induces the PARP1-mediated parthanatos in oral squamous cell carcinoma by increasing production of ROS[J]. Aging (Albany NY), 2021, 13(3): 4242-4257. DOI:10.18632/aging.202386 |
 2023, Vol. 22
2023, Vol. 22


