结节性硬化症(tuberous sclerosis, TS)是一种常染色体显性遗传病,以纤维血管瘤和不同器官(主要是中枢神经系统)的多发性肿瘤为特征。与TS相关的两种神经外科并发症分别是脑室肿瘤和顽固性癫痫。TS患儿存在3种类型的脑部病变:皮质结节、室管膜下结节(subependymal nodule, SEN)和室管膜下巨细胞星形细胞瘤(subependymal giant cell astrocytoma, SEGA),前2种为错构瘤病变,第3种被认为是良性肿瘤。虽然皮质结节可能导致癫痫,但SEGA的主要问题是脑脊液回流障碍导致梗阻性脑积水,随后出现脑积水和颅内压升高。本文报道2例TS合并SEGA患儿,对其诊疗过程、实验室检查、手术方式、预后情况进行总结,并结合文献进行回顾性分析。
病例1:患儿女,10岁。因“反复头晕、头痛1个月,加重伴呕吐7 d”收入中南大学湘雅医院。体温36.7℃,脉搏112次/分,呼吸22次/分,血压118/80 mmHg(1 mmHg=0.133 kPa),发育迟缓,智力稍低下,营养状态稍差,面部双颊粉红色丘疹呈蝶形分布,质硬,压之褪色。患儿1个月前出现阵发性头晕、头痛,无恶心呕吐,1周前头晕、头痛加重,可自行缓解,伴呕吐不适,呕吐物为胃内容物,偶为喷射状。MRI检查示双侧脑室体部可见结节状等T1、短T2信号灶,增强后不均匀强化,双侧脑室明显扩张,以右侧为甚,局部中线结构左偏,透明隔受压移位显著(图 1)。7年前患儿因频发抽搐在外院确诊为原发性癫痫,长期服用卡马西平,抽搐症状得以控制。其父亲有结节性硬化病史。患儿入院后头痛明显,予甘露醇降低颅压及静脉营养支持,完善相关检查,血常规、肝肾功能、凝血功能、输血前四项检查均未见异常,心电图、胸片无异常。予择期手术治疗,手术采用经额叶皮质造瘘,术中见肿瘤位于脑室体部,肿瘤呈灰红色,质地硬韧,边界清楚,血运中等,部分瘤体有钙化,肿瘤大小约25 mm×25 mm×30 mm,镜下行肿瘤全切术。免疫组化结果:GFAP(+),Olig2(-),Ki67 1%(+),P53(-),MGMT(-),IDH1(-),EMA(-),PR(-)。随访2年,复查CT,肿瘤无复发。术后复查MRI,未出现癫痫表现;因家属拒绝,患儿未复查脑电图。

|
图 1 结节性硬化合并室管膜下巨细胞星形细胞瘤病例1的MRI磁共振图像 Fig.1 MRI findings for case # 1 of nodular sclerosis complicated with subependymal giant cell astrocytoma 注 A:矢状位MRI增强;B:轴位MRI增强;C:冠状位MRI增强,见囊实性占位病变,边界清楚,位于右侧孟氏孔附近,诊断为结节性硬化合并室管膜下结节 |
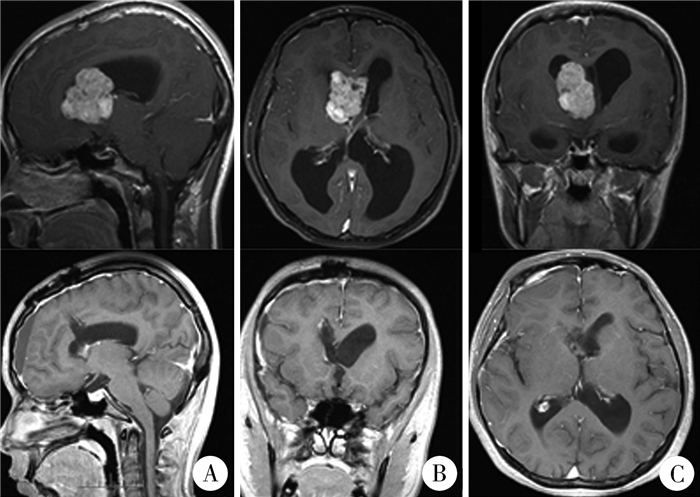
病例2:患儿女,12岁。因“反复头痛11个月,加重伴左眼视力下降1个月”收入中南大学湘雅医院。患儿11个月前无明显诱因出现阵发性头晕、头痛,无恶心呕吐,1个月前头晕、头痛加重,并伴有左眼视力下降,查体:体温36.8℃,脉搏108次/分,呼吸21次/分,血压105/78 mmHg,发育正常,智力稍低下,营养状态稍差,右侧额顶部及左侧眼睑下部有粉红色丘疹,质硬,压之褪色,左眼视力仅能感光,右侧视力1.2。MRI检查示双侧脑室体部结节状等T1、短T2信号灶,增强后不均匀强化,右侧侧脑室明显扩张,局部中线结构左偏,透明隔受压位移显著(图 2)。予择期手术治疗,手术经纵列胼胝体入路,术中见肿瘤位于脑室体部,呈灰色,质地韧,边界较清晰,血运中等,大小约40 mm×40 mm×30 mm,予肿瘤全切。免疫组化:GFAP(+),Ki67 1%(+),P53部分(+),EMA(-),IDH1(+),Olig2(+)。随访4年,复查CT,肿瘤无复发。
|
图 2 结节性硬化合并室管膜下巨细胞星形细胞瘤病例2 MRI磁共振照片 Fig.2 MRI data of nodular sclerosis complicated with subependymal giant cell astrocytoma 注 A:矢状位MRI增强;B:轴位MRI增强;C:冠状位MRI增强,显示右侧侧脑室病变呈不均匀强化,实性部位明显强化 |
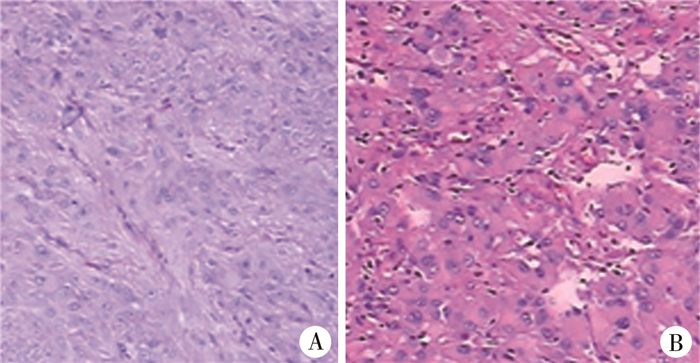
2例结节性硬化合并室管膜下巨细胞星形细胞瘤患儿病理检查图片见面图 3。
|
图 3 结节性硬化合并室管膜下巨细胞星形细胞瘤病理检查图片 Fig.3 Pathological examination of nodular sclerosis complicated with subependymal giant cell astrocytoma 注 A:病例1病理染色结果(HE染色,×400);B:病例2病理染色结果(HE染色,×400)。均可见细胞间界限尚清,细胞核呈卵圆形或椭圆形、分叶状,部分核仁清晰,细胞密度增大,细胞间见大小不等囊腔,细胞质丰富,局部毛玻璃状 |
TS是一种较常见的单基因疾病,患病率为1/100 000~1/10 000,无明显性别差异[1]。表现为多器官(心脏、肾脏、皮肤和大脑)错构瘤,中枢神经系统表现为皮质结节、室管膜下结节(subependymal nodule, SEN)、室管膜下巨细胞星形细胞瘤(subependymal giant cell astrocytoma, SEGA)和视网膜星形细胞瘤(retinal astrocytoma)。
一、临床表现SEGA是一种脑内良性肿瘤,10%~15%的结节性硬化症患儿会出现多器官错构瘤[2]。1908年Heinrich Vogt确立了TS的诊断标准,即“癫痫、智力低下和皮脂腺瘤”三联征。约70%的TS患儿可检测到皮肤损害,包括黑色素沉着斑、皮肤斑块、额头纤维斑块、面部血管纤维瘤以及甲周和甲周纤维瘤,超过80%的患儿出现癫痫发作,50% ~80%的患儿存在认知障碍[3-4]。80% ~100%的患儿出现纤维血管瘤,表现为呈蝶形分布于双颊的粉红色或淡棕色丘疹,质硬,压之可褪色,随年龄增长逐渐融合成片。部分患儿出现癫痫发作,多于2~3岁开始发病,初期可表现为抽搐。随之转化成部分性发作、神经运动性发作或全面性强直-阵挛发作,当伴有全面性强直-阵挛发作时,可导致患儿猝死[5]。当病变阻塞室间孔和第三脑室时,可引起梗阻性脑积水,导致患儿出现头痛、呕吐及视乳头水肿[6]。
二、影像学表现SEGA患儿脑内病灶通常靠近孟氏孔,最大直径大于0.5 cm,磁共振影像学检查可见明显强化[7]。MRI常表现为侧脑室不规则团块状信号,T1WI像呈短或等信号,T2WI像呈等信号或者长信号,可有多方囊变,瘤内钙化点表现为空信号,增强扫描呈显著均匀强化[8-9]。
三、病理学表现瘤体呈圆形或类圆形结节状,切面呈灰白色,质地较硬,可伴有液化、坏死或囊变;细胞大小不一、形态多样,从胞质丰富、嗜酸性玻璃样的多角形或椭圆形巨细胞,到无规则排列的较长和较小细胞,散布在纤维基质内。其中巨细胞的细胞核多偏于一侧,染色质呈细颗粒状或空泡状,多有明显的核仁,呈节细胞样。瘤组织内血管丰富,但无内皮增生现象,肿瘤间质内或周边脑组织内可见钙化灶,肿瘤细胞多表达GFAP。Hamza等[10]研究表明,主要使用影像学证据诊断SEGA(OR=0.16,95%CI: 0.12~0.21)比主要使用组织病理学证据诊断SEGA(OR=0.09,95%CI: 0.07~0.12)的意义更大。
关于SEN和SEGA是否属于两种不同的病变,亦或是同一种疾病的不同病理过程(如没有任何生长潜力的SEN处于疾病初始阶段,而具有明显生长潜力的SEGA处于疾病终末阶段)仍然存在争议。Kotulska等[11]报道2例分别接受CT和(或)MRI随访9年和2年的患儿,出现了SEN并随后转化为SGCA。Morimoto等[12]发现,在60例诊断为SEGA的患儿中,只有1例被认为起源于SEN。另外,SEN与SEGA的区分较为困难,因两者均位于室管膜下,且有相同的组织学特征,其鉴别主要依靠影像学检查和临床症状。SEGA发生在孟氏孔周围,因此发生于该处的占位性病变应警惕SEGA可能。Adriaensen等[13]对214例结节性硬化症(tuberous sclerosis comples, TSC)患儿进行研究,其中43例(20%)合并SEGA,肿瘤平均最大直径为11.4 mm(4~29 mm),本组2例平均最大直径为35 mm,赵凤毛等[14]报道6例SEN患儿病灶最大直径均<1 cm,对于病灶最大直径>1 cm者,更应考虑为SEGA。Park等[15]报道1例胎龄20周的胎儿患有TSC合并SEN,若同时满足上述临床症状时,应该高度怀疑SEGA。
四、病情监测2020年欧洲儿科神经学会专家小组认为,TSC合并SEGA的诊断标准是:病变位于尾状核丘脑沟,最大直径>1 cm;或病灶位于室管膜下,无论其数量、大小和位置如何,影像学上提示病灶持续生长,强调了肿瘤持续生长对诊断TSC合并SEGA很重要[16]。SEGA的监测依赖于年龄和肿瘤大小,Torres等[17]研究发现SEN和SEGA的生长在青春期达到顶峰,并在20~30岁停止进展。在大多数研究中,TSC合并SEGA的患儿平均年龄低于18岁。因此SEGA患儿的监测建议如下:小于20岁者每2年至少行影像学检查一次;超过20岁者影像学检查无继续生长迹象,可视为稳定病灶;超过20岁者影像学检查有生长迹象,应持续监测。肿瘤直径大于1 cm,应在6个月后再次行影像学检查。若高度怀疑SEGA,复查的时间间隔应予缩短,并考虑早期手术切除[18]。近年来,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂西罗莫司及其衍生物依维莫司亦开始用于儿童TSC合并SEGA的治疗,旨在减少TSC个体中SGCT的体积[19]。mTOR抑制剂亦能改善TSC的其他表现,包括肾血管平滑肌脂肪瘤、淋巴血管平滑肌肌瘤病和面部血管纤维瘤,因此药物治疗可作为手术治疗的补充[20]。目前,mTOR抑制剂西罗莫司及其衍生物依维莫司已被中国国家食品药品监督管理局批准应用于儿童,其不仅可使肿瘤缩小或维持稳定,而且能够有效缓解癫痫发作,对TSC患儿合并的颅内肿瘤及肺、肾等部位病变也有较好的治疗效果。已有研究证明依维莫司对TSC患儿在减少肿瘤生长和治疗难治性癫痫方面疗效显著[21]。研究报道3例TSC合并较大的颅内SEGA患儿在肿瘤切除前口服雷帕霉素或依维莫司,行mTOR抑制剂治疗后,计算机断层扫描和磁共振成像显示肿瘤变小,术中肿瘤出血易控制,肿瘤与周围脑组织分界清楚,术后肿瘤样本分析结果显示低密度血流信号以及局部坏死[22]。
五、手术治疗本文报道的2例患儿中,1例采用经额叶皮质造瘘,1例行经纵列胼胝体入路全切肿瘤;SGCT患儿的手术治疗策略也随着治疗理念的改变而改变,其中一种治疗方案旨在纠正脑积水,通过分流手术建立新的脑脊液循环通路,而不切除肿瘤。随着研究的深入,手术切除病变的优势逐渐凸显,尽管肿瘤切除不全可能导致复发,但文献报道大部分肿瘤都能做到肉眼下全切,在一些儿童中,不完全切除的残余肿瘤保持稳定。而在其他情况下,肿瘤会增大,随后需要再手术[23-24]。Sinson等[8]认为,如果肿瘤明显偏向一侧,则应经该侧额叶皮质入路;而对于双侧肿瘤、肿瘤基底附着于透明隔、肿瘤较大且侵及第三脑室时,应经胼胝体- 穹窿间入路;当肿瘤局限于一侧脑室且体积较小时,则2种入路均可。经胼胝体- 穹窿间入路可更有效地开通双侧侧脑室,并有利于脑室与蛛网膜下腔的交通,减少再行脑室- 腹腔分流术的可能性。Kotulska等[11]对57例TSC合并SEGA的患儿进行随访发现,肿瘤直径越大,术后并发症发生的风险越高。当肿瘤直径<2 cm时,手术相对安全,肿瘤完全切除者可治愈;当肿瘤直径>3 cm,位于双侧、多发或为复发肿瘤时,术后并发症的发生率达67%;而肿瘤直径>4 cm时再进行手术,术后并发症的发生率达73%。
综上,儿童TSC合并SEGA临床上并不常见,通过早期发现、早期诊断,针对个体情况制定合适的治疗计划,可获得较好的临床结局;但后期疗效及患儿生存质量仍需进一步随访研究,故建议术后患儿定期复查。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 杨少波负责文章撰写、病例数据收集及分析;赵杰负责研究设计和实施指导。
| [1] |
Joinson C, O'Callaghan FJ, Osborne JP, et al. Learning disability and epilepsy in an epidemiological sample of individuals with tuberous sclerosis complex[J]. Psychol Med, 2003, 33(2): 335-344. DOI:10.1017/s0033291702007092 |
| [2] |
Rosset C, Netto CBO, Ashton-Prolla P. TSC1 and TSC2 gene mutations and their implications for treatment in tuberous sclerosis complex: a review[J]. Genet Mol Biol, 2017, 40(1): 69-79. DOI:10.1590/1678-4685-GMB-2015-0321 |
| [3] |
de Ribaupierre S, Dorfmüller G, Bulteau C, et al. Subependymal giant-cell astrocytomas in pediatric tuberous sclerosis disease: when should we operate?[J]. Neurosurgery, 2007, 60(1): 83-90. DOI:10.1227/01.NEU.0000249216.19591.5D |
| [4] |
Cuccia V, Zuccaro G, Sosa F, et al. Subependymal giant cell astrocytoma in children with tuberous sclerosis[J]. Childs Nerv Syst, 2003, 19(4): 232-243. DOI:10.1007/s00381-002-0700-2 |
| [5] |
朱妍, 刘瑞云, 赵克明. 结节性硬化合并室管膜下巨细胞星形细胞瘤(附五例报告)[J]. 中华神经医学杂志, 2008, 7(8): 802-805. Zhu Y, Liu RY, Zhao KM. Tuberous sclerosis complex plus subependymal giant cell astrocytoma: a report of 5 cases[J]. Chin J Neuromed, 2008, 7(8): 802-805. DOI:10.3760/cma.j.issn.1671-8925.2008.08.012 |
| [6] |
Tahiri Elousrouti L, Lamchahab M, Bougtoub N, et al. Subependymal giant cell astrocytoma (SEGA): a case report and review of the literature[J]. J Med Case Rep, 2016, 10: 35. DOI:10.1186/s13256-016-0818-6 |
| [7] |
Jóźwiak S, Nabbout R, Curatolo P, et al. Management of subependymal giant cell astrocytoma (SEGA) associated with tuberous sclerosis complex (TSC): clinical recommendations[J]. Eur J Paediatr Neurol, 2013, 17(4): 348-352. DOI:10.1016/j.ejpn.2012.12.008 |
| [8] |
Sinson G, Sutton LN, Yachnis AT, et al. Subependymal giant cell astrocytomas in children[J]. Pediatr Neurosurg, 1994, 20(4): 233-239. DOI:10.1159/000120796 |
| [9] |
雷军, 许文静, 刘伟, 等. 室管膜下瘤6例临床病理分析[J]. 临床与实验病理学杂志, 2020, 36(6): 729-731. Lei J, Xu WJ, Liu W, et al. Clinicopathological analysis of subependymoma: a report of 6 cases[J]. Chin J Clin Exp Pathol, 2020, 36(6): 729-731. DOI:10.13315/j.cnki.cjcep.2020.06.025 |
| [10] |
Hamza TH, van Houwelingen HC, Stijnen T. The binomial distribution of meta-analysis was preferred to model within-study variability[J]. J Clin Epidemiol, 2008, 61(1): 41-51. DOI:10.1016/j.jclinepi.2007.03.016 |
| [11] |
Kotulska K, Borkowska J, Roszkowski M, et al. Surgical treatment of subependymal giant cell astrocytoma in tuberous sclerosis complex patients[J]. Pediatr Neurol, 2014, 50(4): 307-312. DOI:10.1016/j.pediatrneurol.2013.12.004 |
| [12] |
Morimoto K, Mogami H. Sequential CT study of subependymal giant-cell astrocytoma associated with tuberous sclerosis.Case report[J]. J Neurosurg, 1986, 65(6): 874-877. DOI:10.3171/jns.1986.65.6.0874 |
| [13] |
Adriaensen MEAPM, Schaefer-Prokop CM, Stijnen T, et al. Prevalence of subependymal giant cell tumors in patients with tuberous sclerosis and a review of the literature[J]. Eur J Neurol, 2009, 16(6): 691-696. DOI:10.1111/j.1468-1331.2009.02567.x |
| [14] |
赵凤毛, 葛明, 冀园琦, 等. 儿童结节性硬化症合并室管膜下结节或室管膜下巨细胞星形细胞瘤的治疗体会[J]. 中华神经外科杂志, 2020, 36(5): 470-475. Zhao FM, Ge M, Ji YQ, et al. Experiences of treating tuberous sclerosis complex with subependymal nodule/subependymal giant cell astrocytoma[J]. Chin J Neurosurg, 2020, 36(5): 470-475. DOI:10.3760/cma.j.cn112050-20190505-00189 |
| [15] |
Park SH, Pepkowitz SH, Kerfoot C, et al. Tuberous sclerosis in a 20-week gestation fetus: immunohistochemical study[J]. Acta Neuropathol, 1997, 94(2): 180-186. DOI:10.1007/s004010050691 |
| [16] |
Jóźwiak S, Mandera M, Młynarski W. Natural history and current treatment options for subependymal giant cell astrocytoma in tuberous sclerosis complex[J]. Semin Pediatr Neurol, 2015, 22(4): 274-281. DOI:10.1016/j.spen.2015.10.003 |
| [17] |
Torres VE, King BF, McKusick MA, et al. Update on tuberous sclerosis complex[J]. Contrib Nephrol, 2001, 136: 33-49. DOI:10.1159/000060178 |
| [18] |
Clarke MJ, Foy AB, Wetjen N, et al. Imaging characteristics and growth of subependymal giant cell astrocytomas[J]. Neurosurg Focus, 2006, 20(1): E5. DOI:10.3171/foc.2006.20.1.6 |
| [19] |
Franz DN, Agricola K, Mays M, et al. Everolimus for subependymal giant cell astrocytoma: 5-year final analysis[J]. Ann Neurol, 2015, 78(6): 929-938. DOI:10.1002/ana.24523 |
| [20] |
Bissler JJ, McCormack FX, Young LR, et al. Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis[J]. N Engl J Med, 2008, 358(2): 140-151. DOI:10.1056/NEJMoa063564 |
| [21] |
Overwater IE, Rietman AB, van Eeghen AM, et al. Everolimus for the treatment of refractory seizures associated with tuberous sclerosis complex (TSC): current perspectives[J]. Ther Clin Risk Manag, 2019, 15: 951-955. DOI:10.2147/TCRM.S145630 |
| [22] |
Jiang T, Du J, Raynald, et al. Presurgical administration of mTOR inhibitors in patients with large subependymal giant cell astrocytoma associated with tuberous sclerosis complex[J]. World Neurosurg, 2017, 107: 1053.e1-1053.e6. DOI:10.1016/j.wneu.2017.08.122 |
| [23] |
Turgut M, Akalan N, Ozgen T, et al. Subependymal giant cell astrocytoma associated with tuberous sclerosis: diagnostic and surgical characteristics of five cases with unusual features[J]. Clin Neurol Neurosurg, 1996, 98(3): 217-221. DOI:10.1016/0303-8467(96)00028-5 |
| [24] |
Ekici MA, Kumandas S, Per H, et al. Surgical timing of the subependymal giant cell astrocytoma (SEGA) with the patients of tuberous sclerosis complex[J]. Turk Neurosurg, 2011, 21(3): 315-324. DOI:10.5137/1019-5149.JTN.4169-11.0 |
 2023, Vol. 22
2023, Vol. 22


