苏醒期躁动(emergence agitation, EA)是小儿全身麻醉后常见的并发症,多见于学龄前儿童,是一种暂时的分离、迷失方向和易怒状态,主要表现为无目的运动、长时间哭闹、语无伦次、呻吟、抽打或踢腿[1-2]。EA患儿有发生静脉留置针脱出、拔出气管导管和坠床的风险,需额外补充镇静、镇痛药物,这可能会延迟患儿出院时间并增加住院费用[3]。腹腔镜手术是小儿外科常见的日间手术,手术过程中常行气管插管全身麻醉,但较易发生苏醒期躁动[4]。减少全身麻醉苏醒期躁动有助于加速康复外科(enhanced recovery after surgery, ERAS)理念应用于小儿外科手术,不仅安全有效,而且能有效减少围手术期应激反应及围手术期麻醉药物的用量,降低术后并发症发生率,减少术后住院时间、住院费用[5]。多项随机临床试验表明,氯胺酮能有效降低小儿全身麻醉后躁动发生率[6]。也有研究报道,氯胺酮并不能有效预防吸入麻醉小儿EA的发生[7]。一项Meta分析结果不建议使用氯胺酮预防小儿手术麻醉或影像学检查镇静后出现的躁动[8]。目前氯胺酮能否用于预防小儿全身麻醉苏醒期躁动仍存在争议。S-氯胺酮是一种新型麻醉药,是氯胺酮的右旋异构体,主要作用机制是持续阻断N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体,具有比氯胺酮更强的镇痛和分离麻醉的作用。目前,国内外关于S-氯胺酮的临床研究多集中在镇痛和抑郁症治疗,其用于小儿全身麻醉苏醒质量的研究较少[9]。本研究旨在探讨S-氯胺酮对小儿日间腹腔镜手术全身麻醉苏醒期躁动的影响,为优化全身麻醉苏醒期管理提供参考依据。
资料与方法 一、临床资料本研究为前瞻性研究。选择2022年3月至2022年5月浙江大学医学院附属儿童医院择期行日间腹腔镜疝修补术的患儿为研究对象,共114例患儿,采用随机数字表法分为S-氯胺酮组(S组)组和生理盐水组(N组),每组各57例。纳入标准:行日间腹腔镜疝修补术者,年龄1~7岁,身体质量指数(body mass index, BMI)12~20 kg/m2,美国麻醉医师协会(American Society of Anesthesiologists, ASA)分级Ⅰ级。排除标准:①嵌顿疝、复发疝; ②术前24 h使用了镇痛镇静药; ③术前1周内体温高于38℃或伴有急性上呼吸道感染症状、支气管哮喘病史; ④伴中重度睡眠呼吸暂停综合征; ⑤既往有异常麻醉恢复史、慢性神经系统或精神系统疾病史; ⑥6个月内有严重头部创伤史; ⑦有颅内高压、肝肾功能损伤; ⑧手术时间>40 min、未按规定用药、术中发现其他外科疾病并接受手术治疗; ⑨家属申请退出本研究。本研究以气管插管拔管后30 min内发生EA的比例为主要结局指标。根据预试验结果,假设S-氯胺酮组发生EA比例为42%,生理盐水组发生EA比例为75%。设定双侧α=0.05,把握度为90%,两组样本量比值为1 ∶ 1。根据两独立样本率的样本量计算公式:
| 表 1 两组日间腹腔镜疝修补术患儿的一般资料比较 Table 1 Comparing basic clinical profiles of two groups |
|
|
患儿术前禁饮2 h、禁母乳4 h、禁配方奶和淀粉类食物6 h,禁油炸类和肉类食物8 h。在日间病房建立静脉通道,不给予任何术前用药。入手术室后常规监测心率(heart rate, HR)、平均血压(mean blood pressure, MBP)、心电图(electrocardiogram, ECG)和脉搏血氧饱和度(oxygen saturation of pulse, SpO2)。采用8%七氟醚(氧流量8 L/min)吸入诱导,同时静脉给予咪达唑仑0.05 mg/kg、丙泊酚2 mg/kg、罗库溴铵0.6 mg/kg、芬太尼2 μg/kg、阿托品0.01 mg/kg、昂丹司琼0.1 mg/kg。S组麻醉诱导时静脉给予S-氯胺酮0.5 mg/kg(S-氯胺酮50 mg用生理盐水稀释至10 mL,0.1 mL/kg),N组麻醉诱导时静脉给予生理盐水0.1 mL/kg。对配制药物的医护人员与进行药物干预及记录围手术期各项指标和评分的麻醉医师进行分组情况的设盲。90 s后采用经口可视喉镜下气管插管,听诊双肺确定导管位置、深度后固定气管导管。连接呼吸机行机械通气,调整呼吸参数,潮气量(tidal volume, VT)6~8 mL/kg,呼吸频率(respiratory rate, RR)15~25次/分,吸入氧浓度(fraction of inspired oxygen, FiO2)35%,流量2 L/min, 呼气末CO2分压(end-tidal carbon dioxide partial pressure, PETCO2)维持在35~45 mmHg(1 mmHg=0.133 kPa)。麻醉维持:吸入2% ~4%七氟醚,静脉泵注瑞芬太尼0.15 μg·kg-1·min-1;维持患儿的脑电双频指数(bispectral index,BIS)在40~60。缝皮时予0.3%罗哌卡因0.2 mL/kg局部浸润并停用麻醉维持药物,同时氧流量调至6 L/min。手术结束后予氟马西尼0.01 mg/kg拮抗咪达唑仑,患儿开始有自主呼吸时予新斯的明0.03 mg/kg、阿托品0.01 mg/kg拮抗罗库溴铵,当患儿潮气量>6 mL/kg、呼吸频率>15次/分、PETCO2正常、脱氧下SpO2≥95%时拔除气管插管,待患儿生命体征平稳后送入麻醉恢复室。
三、观察指标记录患儿气管插管拔管后苏醒期30 min内的躁动发生率。记录麻醉前(T0)、气管插管后(T1)、气腹即刻(T2)、术毕时(T3)的MBP和HR;记录气管插管拔管时间、苏醒时间、麻醉恢复室(postanesthesia care unit, PACU)停留时间。记录气管插管拔管即刻(T4)、气管插管拔管后10 min(T5)、气管插管拔管后20 min(T6)、气管插管拔管后30 min(T7)的躁动评分和疼痛评分。躁动评分采用Richmond躁动- 镇静评分(Richmond agitation and sedation scale, RASS)量表,分为10个等级,从昏迷到有攻击不同等级意识状态,每个分值区间对应一种意识状态,其中-4~-5分为深度镇静;-3~0分为轻度镇静,此为临床上所期望的镇静水平;+1~+4分为躁动[10]。疼痛评分采用FLACC(face, legs, activity, crying, consolability)量表,包括5个方面行为变化:脸部表情、腿部动作、体位、哭闹和可安慰性,每项0~2分,总分0~10分,总分越高,表明患儿疼痛越剧烈。FLACC≤3分为镇痛满意。若RASS>0分考虑患儿发生EA, 若RASS≥+2分考虑患儿出现严重EA, 给予丙泊酚1 mg/kg镇静。若FLACC≥4分为患儿出现中重度疼痛,给予芬太尼0.5 μg/kg镇痛。记录术后不良反应如低氧血症(SpO2<90%)、恶心呕吐、流涎等发生情况。
四、统计学处理采用SPSS 26.0和R 4.1.0进行统计学分析。采用Shapiro-Wilk法检验计量资料的正态性,正态分布计量资料以x±s表示,组间比较采用两独立样本t检验;非正态分布计量资料以M(Q1, Q3)表示,组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。正态分布重复测量数据采用重复测量方差分析,组内各时间点的多重比较采用LSD法。非正态分布重复测量数据采用Scheirer-Ray-Hare检验,组内各时间点的多重比较采用friedman双向秩方差分析法。P<0.05为差异有统计学意义。
结果MBP经重复测量方差分析,球形检验结果Machly W=0.601,P<0.001,不符合球形检验条件, 因此以一元方差分析“Greenhouse-Geisser”中校正结果为准。重复测量方差分析结果:组别的主效应显著,F=5.860,P=0.018,偏η2=0.067;时间点的主效应显著,F=26.582,P < 0.001,偏η2=0.245;组别与时间点的交互效应不显著,F=1.686,P=0.181,偏η2=0.020。T1时S组MBP为(71.90±8.76)mmHg,N组MBP为(66.55±9.51)mmHg,简单效应显著(P<0.05)。T2时S组MBP为(69.52±7.21)mmHg,N组MBP为(65.38±7.36)mmHg,简单效应显著(P<0.05)。见图 1、表 2。
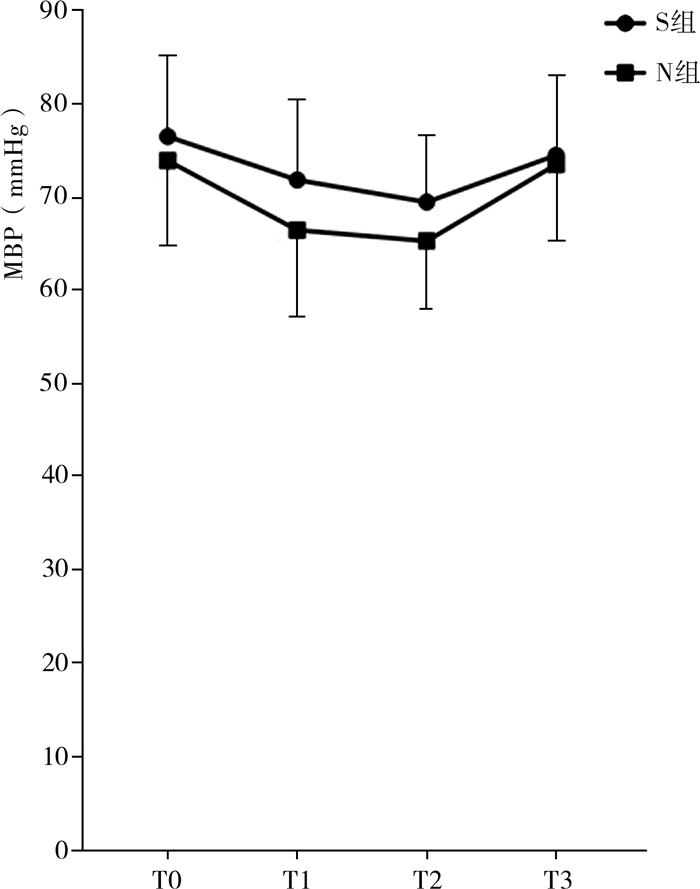
|
图 1 两组日间腹腔镜疝修补术患儿的平均血压变化 Fig.1 Changes in MBP between two groups 注 S组:S-氯胺酮组;N组:生理盐水组;MBP:平均血压 |
| 表 2 两组日间腹腔镜疝修补术患儿不同时间点MBP比较(x±s,mmHg) Table 2 Comparison of MBP at different time points between the two groups(x±s, mmHg) |
|
|
经Scheirer-Ray-Hare检验, 两组间HR差异无统计学意义(H=0.000,P=0.999),不同时间点HR差异有统计学意义(H=72.979,P<0.001)。组别和时间点的交互作用对HR无影响(H=0.220,P=0.974)。见表 3。经Scheirer-Ray-Hare检验两组间RASS差异有统计学意义(H=32.670,P<0.001),不同时间点RASS差异有统计学意义(H=28.624,P<0.001)。组别和时间点的交互作用对RASS无影响(H=3.385,P=0.336)。见表 4。
| 表 3 两组日间腹腔镜疝修补术患儿不同时间点HR比较[M(Q1, Q3), 次/分] Table 3 omparison of HR at different time points between the two groups[M(Q1, Q3), time/min] |
|
|
| 表 4 两组日间腹腔镜疝修补术患儿不同时间点RASS评分比较[M(Q1,Q3)] Table 4 Comparison of RASS scores at different time points between the two groups[M(Q1, Q3)] |
|
|
经Scheirer-Ray-Hare检验, 两组间FLACC差异有统计学意义(H=23.875,P<0.001),不同时间点FLACC差异无统计学意义(H=7.276,P=0.064)。组别和时间点的交互作用对FLACC无影响(H=3.027,P=0.387)。见表 5。S组发生EA 24例(45.3%),N组发生EA 41例(78.9%),差异有统计学意义(χ2=12.538,P<0.001)。两组严重EA、中重度疼痛的发生率差异均有统计学意义(P<0.05)。见表 6。S组拔管时间中位数为11.00(8.75,15.00)min,N组拔管时间中位数为9.50(8.00,11.00)min, 两组拔管时间差异有统计学意义(Z=2.614,P=0.009)。S组苏醒时间中位数为24.50(16.00,32.25)min,N组苏醒时间中位数为12.00(8.75,18.00)min,两组苏醒时间差异有统计学意义(Z=4.496,P<0.001)。两组PACU停留时间差异无统计学意义(P>0.05)。见表 7。两组患儿术后不良反应发生率比较, 差异无统计学意义(P>0.05)。见表 8。
| 表 5 两组日间腹腔镜疝修补术患儿不同时间点FLACC评分比较[M(Q1,Q3)] Table 5 Comparison of FLACC scores at different time points between the two groups[M(Q1, Q3)] |
|
|
| 表 6 两组日间腹腔镜疝修补术患儿EA、严重EA和中重度疼痛发生率比较[例(%)] Table 6 The incidence of emergence agitation, severe emergence agitation and moderate-to-severe pain between two groups[n(%)] |
|
|
| 表 7 两组日间腹腔镜疝修补术患儿术后恢复情况比较[M(Q1, Q3), min] Table 7 Comparing postoperative recovery between two groups[M(Q1, Q3), min] |
|
|
| 表 8 两组日间腹腔镜疝修补术患儿术后不良反应的比较[例(%)] Table 8 Comparing postoperative adverse reactions between two groups[n(%)] |
|
|
七氟醚具有血/气分配系数小、血液溶解度低、诱导和苏醒迅速、对小儿呼吸道刺激小、心血管抑制作用轻等优点,是常用于小儿日间腹腔镜手术的吸入性全身麻醉药物。腹腔镜疝修补术是小儿外科常见的日间手术,因日间手术具有“短”(手术时间短﹑麻醉药物作用时间短)﹑“平”(麻醉诱导﹑维持及苏醒平稳)﹑“快”(起效快﹑恢复快﹑质量好﹑出院快)﹑“少”(不良反应少)四大特点,手术过程中常行七氟醚诱导气管插管全身麻醉,但较易发生EA,其机制目前尚不明确[11]。
一直以来,疼痛被认为是导致EA的重要原因[12]。S-氯胺酮是具有强镇痛和分离麻醉作用的手性环己酮,是一种新型NMDA受体拮抗剂。S-氯胺酮与NMDA受体的亲和力是氯胺酮的2倍,对阿片μ受体的亲和力是R-氯胺酮的4倍,其临床麻醉镇痛效能是氯胺酮的2倍;在达到相同镇痛效能的前提下,所用剂量仅为氯胺酮的一半,药物不良反应亦随之减少。本研究结果表明,血压、心率、RASS躁动评分、FLACC疼痛评分的组别因素和时间点因素无显著交互作用(P>0.05),不同组间或组内的血压、心率、RASS躁动评分、FLACC疼痛评分比较差异有统计学意义。两组血压差异也有统计学意义(P<0.05),其中S组T1、T2血压明显高于N组(P<0.05),但心率与N组比较差异无统计学意义(P>0.05)。这与S-氯胺酮通过阻止神经元的儿茶酚胺再摄取和刺激去甲肾上腺素能神经元的去甲肾上腺素、多巴胺和S-羟色胺释放,导致中枢交感神经激活,从而增加个体血压和心率有关[13]。本研究麻醉诱导气管插管至气腹即刻平均时间为5~15 min,这与S-氯胺酮药理作用高峰时间相符。S组与N组心率无显著差异可能与麻醉诱导前静脉注射阿托品有关。组内比较,S组与N组T1、T2心率明显快于T0(P<0.05),但T1、T2血压明显低于T0(P<0.05)。与T0比较,T1、T2心率加快,这与随着手术进程麻醉深度加深及气腹影响血压下降,继而兴奋交感神经系统的人体代偿机制有关。S组RASS躁动评分和EA、严重EA的发生率均明显低于N组(P<0.05),且S组内RASS躁动评分T7明显高于T4、T5、T6(P<0.05),提示S组在PACU观察期间苏醒质量逐步达到了满意的效果,但N组仍存在轻度躁动,提示S-氯胺酮在预防儿童EA方面具有良好的效果,且S组T4、T5、T7 FLACC疼痛评分和中- 重度疼痛的发生率均明显低于N组(P<0.05),提示可能与其镇痛作用有关,也可能与减少脑内兴奋性氨基酸递质的释放、拮抗谷氨酸过度激活作用、降低胞内氧自由基和钙离子水平有关。S组拔管时间、苏醒时间更长,可能与S-氯胺酮有轻度呼吸抑制和分离麻醉作用有关。两组PACU停留时间无显著差异,虽然N组苏醒时间更短,但严重EA需要丙泊酚缓解的可能性更大,延长了PACU观察时间,使两组最终PACU的停留时间无显著差异。尽管两组低氧血症发生率无显著差异,但是S组出现1例气管插管拔管后呼吸抑制予纳洛酮拮抗、1例舌后坠予托下颌缓解;N组中仅1例舌后坠予托下颌即缓解,其余病例予面罩吸氧后SpO2上升≥95%。
围手术期使用阿片类药物镇痛的同时也可能诱发患者对痛觉过敏,S-氯胺酮能预防阿片类药物(如瑞芬太尼)引起的痛觉过敏,同时其强效镇痛作用可减少阿片类药物用量,提升围手术期疼痛管理质量[14]。在腹部手术及心脏手术围手术期应用S-氯胺酮均可显著减少术后阿片类药物的使用量,且S-氯胺酮术后镇痛效果更好,无精神类不良事件发生,术后恶心、呕吐的发生率也明显降低[14]。临床常用的麻醉药物对循环系统均有一定抑制作用,而S-氯胺酮对循环系统有轻微的兴奋作用,常引起血压、心率轻度上升。因此麻醉过程中,S-氯胺酮、阿片类药物、肌松药及苯二氮类药物联合应用,可补偿其他麻醉药物所产生的循环抑制,其镇痛作用也可使阿片类药物用量减少,进而降低其不良反应(如术后恶心、呕吐)的发生率;同时,S-氯胺酮的不良反应(如幻觉、噩梦)在辅以苯二氮类药物后明显减少,围手术期麻醉苏醒质量提高。国外研究报道,围手术期S-氯胺酮联合镇静、镇痛药物(如咪达唑仑等)可减少其他药物使用量,且术后苏醒迅速,其残留镇痛作用可明显减轻患儿的苏醒后躁动,与本研究结果相符[15]。
本研究存在如下局限性:①本研究为单中心临床试验,为加快PACU的周转,避免术后气管插管拔管时间、苏醒时间的延长,采用了S-氯胺酮0.5 mg/kg麻醉诱导期静脉注射,其预防EA的最佳剂量还有待进一步研究;②仅对气管插管拔管后30 min内进行躁动和疼痛评分,未监测回病房的躁动和疼痛情况;③基于FLACC的疼痛评分不一定能反映真实疼痛水平,哭泣和躁动是儿童与生俱来的反应,但FLACC仍是学龄前儿童疼痛评分的首选。
综上所述,日间腹腔镜手术麻醉诱导期静脉注射0.5 mg/kg S-氯胺酮可降低小儿EA的发生率及疼痛评分,不增加恶心呕吐和低氧血症的发生率,对提高小儿日间手术麻醉苏醒期质量及安全性有积极意义。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 邱金鹏、金海燕负责研究的设计、实施和论文撰写;曹慧霞、朱智瑞进行病例数据收集及分析;金海燕、朱智瑞负责研究设计与指导,并对文章知识性内容进行审阅
| [1] |
An LJ, Zhang Y, Su Z, et al. A single dose of dezocine suppresses emergence agitation in preschool children anesthetized with sevoflurane-remifentanil[J]. BMC Anesthesiol, 2017, 17(1): 154. DOI:10.1186/s12871-017-0446-8 |
| [2] |
Fattahi-Saravi Z, Jouybar R, Haghighat R, et al. Comparison of the effect of ketamine, ketamine-midazolam and ketamine-propofol on post-tonsillectomy agitation in children[J]. Malays J Med Sci, 2021, 28(5): 72-81. DOI:10.21315/mjms2021.28.5.7 |
| [3] |
Kuratani N, Oi Y. Greater incidence of emergence agitation in children after sevoflurane anesthesia as compared with halothane: a meta-analysis of randomized controlled trials[J]. Anesthesiology, 2008, 109(2): 225-232. DOI:10.1097/ALN.0b013e31817f5c18 |
| [4] |
Dohms K, Hein M, Rossaint R, et al. Inguinal hernia repair in preterm neonates: is there evidence that spinal or general anaesthesia is the better option regarding intraoperative and postoperative complications? A systematic review and meta-analysis[J]. BMJ Open, 2019, 9(10): e028728. DOI:10.1136/bmjopen-2018-028728 |
| [5] |
舒强, 钭金法. 加速康复外科在小儿外科中的应用与展望[J]. 临床小儿外科杂志, 2019, 18(4): 253-256. Shu Q, Tou JF. Applications and future prospects of enhanced recovery after surgery during pediatric surgery[J]. J Clin Ped Sur, 2019, 18(4): 253-256. DOI:10.3969/j.issn.1671-6353.2019.04.001 |
| [6] |
Moore AD, Anghelescu DL. Emergence delirium in pediatric anesthesia[J]. Paediatr Drugs, 2017, 19(1): 11-20. DOI:10.1007/s40272-016-0201-5 |
| [7] |
Ozcan A, Kaya AG, Ozcan N, et al. Effects of ketamine and midazolam on emergence agitation after sevoflurane anaesthesia in children receiving caudal block: a randomized trial[J]. Rev Bras Anestesiol, 2014, 64(6): 377-381. DOI:10.1016/j.bjan.2014.01.004 |
| [8] |
Ng KT, Sarode D, Lai YS, et al. The effect of ketamine on emergence agitation in children: a systematic review and meta-analysis[J]. Paediatr Anaesth, 2019, 29(12): 1163-1172. DOI:10.1111/pan.13752 |
| [9] |
McIntyre RS, Rosenblat JD, Nemeroff CB, et al. Synthesizing the evidence for ketamine and esketamine in treatment-resistant depression: an international expert opinion on the available evidence and implementation[J]. Am J Psychiatry, 2021, 178(5): 383-399. DOI:10.1176/appi.ajp.2020.20081251 |
| [10] |
Larsen LG, Wegger M, Lé Greves S, et al. Emergence agitation in paediatric day case surgery: a randomised, single-blinded study comparing narcotrend and heart rate variability with standard monitoring[J]. Eur J Anaesthesiol, 2022, 39(3): 261-268. DOI:10.1097/EJA.0000000000001649 |
| [11] |
Choi EK, Park S, Park KB, et al. Postoperative emergence agitation and intraoperative sevoflurane sedation under caudal block in children: a randomized comparison of two sevoflurane doses[J]. Anesth Pain Med (Seoul), 2019, 14(4): 434-440. DOI:10.17085/apm.2019.14.4.434 |
| [12] |
Lee SJ, Sung TY. Emergence agitation: current knowledge and unresolved questions[J]. Korean J Anesthesiol, 2020, 73(6): 471-485. DOI:10.4097/kja.20097 |
| [13] |
Peltoniemi MA, Hagelberg NM, Olkkola KT, et al. Ketamine: a review of clinical pharmacokinetics and pharmacodynamics in anesthesia and pain therapy[J]. Clin Pharmacokinet, 2016, 55(9): 1059-1077. DOI:10.1007/s40262-016-0383-6 |
| [14] |
Wilson SH, Hellman KM, James D, et al. Mechanisms, diagnosis, prevention and management of perioperative opioid-induced hyperalgesia[J]. Pain Manag, 2021, 11(4): 405-417. DOI:10.2217/pmt-2020-0105 |
| [15] |
Kuypers MI, Smits GJP, Baerends EP, et al. Paediatric procedural sedation and analgesia by emergency physicians in a country with a recent establishment of emergency medicine[J]. Eur J Emerg Med, 2019, 26(3): 168-173. DOI:10.1097/MEJ.0000000000000524 |
 2023, Vol. 22
2023, Vol. 22


