2. 河北省儿童医院普外科, 石家庄 050000;
3. 河北省儿童医院内分泌科, 石家庄 050000
2. Department of General Surgery, Hebei Children's Hospital, Shijiazhuang 050000, China;
3. Department of Endocrinology, Hebei Children's Hospital, Shijiazhuang 050000, China
黏多糖贮积症Ⅰ型(mucopolysaccharidosis type Ⅰ, MPSⅠ)是一组临床表现复杂、多系统受累的遗传代谢性疾病,属于罕见病[1]。早期诊断并给予积极治疗对改善患儿预后具有重要作用。但因早期表现不典型及其罕见性,MPSⅠ往往诊断困难。腹外疝是MPS Ⅰ的常见临床表现[2]。最新报道表明泛发型蒙古斑与MPS Ⅰ有关,是MPS Ⅰ患儿新生儿期即可出现的早期临床表现,对腹外疝合并泛发型蒙古斑患儿进行MPS Ⅰ筛查有助于其早期诊断[3]。现报道河北省儿童医院收治的3例腹外疝合并泛发型蒙古斑经X线检查提出怀疑诊断,最终确诊为MPS Ⅰ患儿的临床及影像资料,并查阅相关文献,总结MPS Ⅰ的临床及影像特征。
病例1:女,7岁,因矮小、脐疝、双手关节僵硬就诊于我院儿保科。患儿系第1胎第1产,父母非近亲结婚,父母身高、智力正常,其妹身高正常、口齿不清。9月龄时因漏斗胸于外院骨科就诊,行胸腰椎正侧位X线检查示:第12胸椎、第1腰椎椎体形态稍不规则,建议复查。4岁起因双手关节僵硬、伸直受限、腹胀,多次就诊于本院及外院,血常规、甲状腺功能三项、类风湿因子检查均未见异常;腹部超声检查示肝左叶厚48 mm,右叶厚108 mm,肋下79 mm(右锁骨中线处);脾脏长径88 mm,厚34 mm。外院诊断不排除先天性代谢缺陷疾病,行氨基酸代谢疾病、有机酸代谢疾病、脂肪酸代谢疾病筛查,检测结果均未见异常。查体:身高107 cm,智力正常,面容特殊,鼻梁塌陷,两眼距增宽,前额突出,颈短,腹部膨隆,脐疝,双膝外翻,双手伸直受限,后背部及骶尾部见多个大片状浅灰蓝色蒙古斑,部分蒙古斑直径大于10 cm。行胸部正位、脊柱正侧位及左手正位X线检查示:肋骨飘带征、尺桡骨远端关节V形变、爪形手,结合泛发型蒙古斑及临床表现,不排除MPS。通过医学外显子检测发现IDUA基因有2个杂合突变,即c.611-612insCTGCT和c.1037T>G,临床诊断为MPS ⅠH/S型。
病例2:男,1岁4个月,因脊柱后凸就诊于我院骨科。5天前因右侧嵌顿性腹股沟疝于我院行腹腔镜下右侧疝囊高位结扎术。患儿系第2胎第2产,父母非近亲结婚,父母及姐姐身高、智力正常。1岁前因反复上呼吸道感染于外院多次就诊。查体:身高75 cm,面容特殊,鼻梁塌陷,两眼距增宽,前额突出,颈短,腹部膨隆,双手伸直受限,骶尾部、臀部、后背部及双上肢见广泛分布的大片状、椭圆形灰蓝色蒙古斑,部分融合,大部分蒙古斑直径超过10 cm。腹部超声示肝左叶厚35 mm,右叶厚75 mm,肋下22 mm(右侧锁骨中线处);脾脏长径88 mm,厚26 mm,肋下23 mm。脊柱正侧位、左手正位、胸部正位X线检查示肋骨飘带征、椎体变尖、脊柱后凸、掌骨近端变尖、爪形手,结合泛发型蒙古斑及临床表现,不排除MPS。基因检测发现IDUA基因2个杂合突变,即c.236C>T和c.1651-1G>A,临床诊断为MPSⅠ H型。
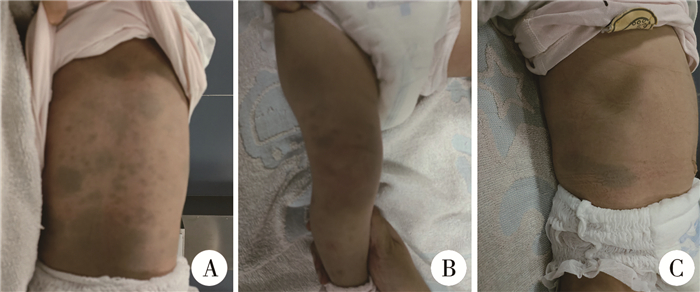
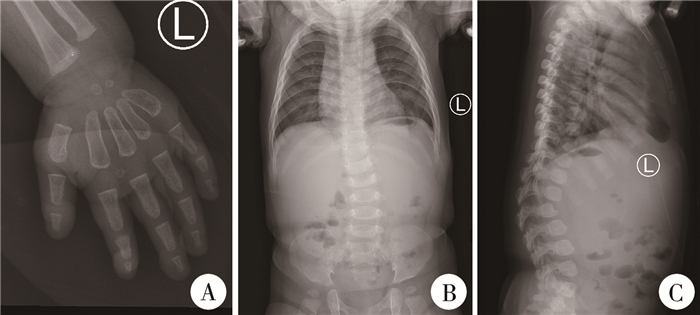
病例3:女,8个月,因左侧腹股沟区肿物逐渐增大就诊于我院普外科。患儿1月龄时左侧腹股沟处触及肿物,肿物可还纳,未予特殊治疗。患儿系第1胎第1产,体质量与同龄儿相当,生后无窒息史。父母非近亲结婚,身高、智力正常。查体:身高67 cm,面容特殊,鼻梁塌陷,两眼距增宽,颈短,骶尾部臀部、后背部、侧腹部及下肢可见广泛分布的大片状、点状、椭圆形灰蓝色蒙古斑,部分融合(图 1),部分蒙古斑直径超过10 cm。腹部超声示肝左叶厚48 mm,右叶厚78 mm,肋下45 mm(右侧锁骨中线处);脾脏长径68 mm,厚径26 mm,肋下15 mm。术前胸部正位X线片示双侧肋骨飘带征(图 2);左手正位、脊柱正侧位X线片示肋骨飘带征、椎体变尖、脊柱后凸、掌骨近端变尖,结合泛发型蒙古斑及临床表现,不排除MPS。基因检测发现IDUA基因有2个杂合突变,即c.1402+2T>G和c.659G>A,临床诊断为MPSⅠ H型。
|
图 1 1例黏多糖贮积症Ⅰ型患儿的蒙古斑分布图片 Fig.1 Extensive Mongolian spots of MPSⅠ 注 A: 后背部;B:下肢;C:侧腹部 |
|
图 2 1例黏多糖贮积症Ⅰ型患儿的X线检查图像 Fig.2 Radiographic examination of MPSⅠ 注 A:左手正位;B:脊柱正位;C:脊柱侧位 |
MPS Ⅰ是由于α-L-艾杜糖苷酶(a-L-iduronidase enzyme, IDUA)缺乏引起的遗传代谢性疾病[4]。在中国台湾,MPS Ⅰ未被纳入新生儿筛查计划前(1984—2014年)的发病率为0.11/10万,但在MPS Ⅰ纳入新生儿筛查计划后(2015—2017年)发病率为1.35/10万[1]。患儿一般出生时正常,逐渐出现生长缓慢、智力受损、面容粗糙、角膜混浊、关节僵硬、脊椎后凸、心脏瓣膜增厚等多系统的不可逆性病变[5]。MPS Ⅰ患儿往往于确诊前转诊于多个科室(骨科、耳鼻喉科、眼科、神经科等),确诊时间存在较长时间延迟,在戴阳丽等[1]的研究中,MPS Ⅰ患儿平均发病年龄1.25岁,确诊时年龄3.5岁。目前酶替代疗法(enzyme replacement therapy, ERT)和造血干细胞移植(hematopoietic stem cell transplantation, HSCT)是MPS Ⅰ的主要治疗方法。HSCT是年龄≤2.0岁且发育指数>70的重型MPS Ⅰ的首选治疗方法,能够显著改变MPS Ⅰ的自然病程[6]。因此早期诊断对MPS Ⅰ的预后具有重要意义。
蒙古斑(Mongolian spot, MS)通常被认为是一种良性病变,表现为局限于腰骶部或臀部的蓝色或灰蓝色色素沉着,亚洲人群中发生率约80%,一般在出生时或几周内出现,随着年龄增长在幼儿时期消退[7]。Weissbluth等[8]首次提出泛发型蒙古斑与代谢障碍疾病之间存在联系。在之后的40年间,有很多报道将两者联系起来,最常见的是MPS Ⅰ(Hurler)综合征和GM1神经节苷脂症。Ochiai等[9]提出对存在超出骶尾部和臀部,向外弥漫分布于背部、肩部、四肢或侧腹,并且持续存在、渐进出现非典型形状的泛发型蒙古斑患儿进行MPS筛查,有助于早期诊断。
腹外疝是MPSⅠ的常见临床表现。在Arn等[2]的文献报道中,544例MPSⅠ患儿确诊前至少接受过一次手术者占41%,其中39%为疝修补手术。与健康儿童相比,MPSⅠ患儿接受疝气手术的年龄分布更广。健康儿童腹外疝修复手术多在3岁内,而MPSⅠ患儿在较大患儿中也常见[10]。其发生机制可能与MPSⅠ肝脾肿大、腹部肌肉和结缔组织减弱有关[11]。对MPSⅠ合并腹外疝患儿进行腹外疝修补手术属于对症治疗,并不能根治MPSⅠ。几乎所有的MPSⅠ患儿都会因气道狭窄、限制性肺病、阻塞性睡眠呼吸暂停和哮喘存在严重的呼吸功能不全,使得全身麻醉时可能遇到插管及拔管困难及其他并发症,导致气管切开甚至死亡,增加麻醉风险,手术前确诊MPSⅠ可降低患儿手术干预和麻醉的风险[12]。
骨骼系统X线检查对MPSⅠ的诊断、接受造血干细胞移植患儿术前及术后的评估均有重要意义,因此X线检查是MPSⅠ诊断及评估的重要方法。MPS Ⅰ的典型X线表现为:肋骨增宽而脊柱端根部变细,锁骨内侧增宽、外侧变细,脊柱后凸,椎体前缘变尖,指骨远端变细,掌骨近端变尖;爪形手;尺桡骨远端呈相对的倾斜面。MPS的影像特征虽然典型,但在缺乏临床病史提示时,影像科医生容易忽略相关征象,造成漏诊。本组3例中,病例1及病例2均在确诊前接受X线检查(包括胸部正位、胸腰椎正侧位),但肋骨飘带征均未引起影像科医生重视,造成漏诊。MPSⅠ诊断困难、诊断延迟主要与以下因素有关:一方面MPS Ⅰ早期临床表现并不典型。患儿6月龄之前多表现正常,部分患儿仅表现为轻度脊柱后凸。虽然随着年龄增长逐渐出现多系统受累的症状,但由于MPSⅠ是一种罕见病,且临床表现具有多样性、变异性,部分临床医师及影像医师对此病知识储备不足。另一方面,虽然MPSⅠ患儿会因脊柱后凸、频繁呼吸道感染、腹外疝、中耳炎、关节挛缩等原因就诊,但临床及影像科医生往往因对症状的惯性思维,重点只放在病变区域而忽略了其他临床或影像学征象,造成漏诊,因此对临床及影像学资料审阅的全面性至关重要。泛发型蒙古斑是MPSⅠ患儿出生时即可观察到的临床征象,腹外疝亦是患儿常见的伴发疾病,以上均提示临床及影像科医师要对患儿进行全面查体,综合考虑,必要时进行多学科会诊。
综上所述,对于腹外疝合并泛发型蒙古斑患儿应提高警惕,行胸部正位、脊柱正侧位、左手正位X线检查有助于MPSⅠ的早期诊断。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索为李玉叶、付兴娇;论文调查设计为李玉楼、丛力宁;数据收集与分析为张蔷、张晓军;论文结果撰写为李玉叶、丛力宁;论文讨论分析为李玉叶、王赞
| [1] |
戴阳丽, 朱铭强, 邹朝春. 黏多糖贮积症Ⅰ型的研究现状及进展[J]. 中华内分泌代谢杂志, 2021, 37(4): 306-310. Dai YL, Zhu MQ, Zou ZC. Current researches and recent advances of mucopolysaccharidosis type Ⅰ[J]. Chin J Endocrinol Metab, 2021, 37(4): 306-310. DOI:10.3760/cma.j.cn311282-20201214-00824 |
| [2] |
Arn P, Wraith JE, Underhill L. Characterization of surgical procedures in patients with mucopolysaccharidosis type I: findings from the MPS I Registry[J]. J Pediatr, 2009, 154(6): 859-64. DOI:10.1016/j.jpeds.2008.12.024 |
| [3] |
Kolbe V, Boy D, Büttner A. Mongolian spots-a challenging clinical sign[J]. Forensic Sci Int, 2021, 327: 110964. DOI:10.1016/j.forsciint.2021.110964 |
| [4] |
Chuang CK, Lin HY, Wang TJ, et al. Status of newborn screening and follow up investigations for mucopolysaccharidoses Ⅰ and Ⅱ in Taiwan[J]. Orphanet J Rare Dis, 2018, 13(1): 84. DOI:10.1186/s13023-018-0816-4 |
| [5] |
Colmenares-Bonilla D, Colin-Gonzalez C, Gonzalez-Segoviano A, et al. Diagnosis of mucopolysaccharidosis based on history and clinical features: evidence from the Bajio region of Mexico[J]. Cureus, 2018, 10(11): e3617. DOI:10.7759/cureus.3617 |
| [6] |
Schmidt M, Breyer S, Löbel U, et al. Musculoskeletal manifestations in mucopolysaccharidosis type I (Hurler syndrome) following hematopoietic stem cell transplantation[J]. Orphanet J Rare Dis, 2016, 11(1): 93. DOI:10.1186/s13023-016-0470-7 |
| [7] |
Techasatian L, Sanaphay V, Paopongsawan P, et al. Neonatal birthmarks: a prospective survey in 1000 neonates[J]. Glob Pediatr Health, 2019, 6: 2333794X. DOI:10.1177/2333794X19835668 |
| [8] |
Weissbluth M, Esterly NB, Caro WA. Report of an infant with GM1 gangliosidosis type I and extensive and unusual mongolian spots[J]. Br J Dermatol, 1981, 104(2): 195-200. DOI:10.1111/j.1365-2133.1981.tb00045.x |
| [9] |
Ochiai T, Suzuki Y, Kato T, et al. Natural history of extensive Mongolian spots in mucopolysaccharidosis type Ⅱ (Hunter syndrome): a survey among 52 Japanese patients[J]. J Eur Acad Dermatol Venereol, 2007, 21(8): 1082-1085. DOI:10.1111/j.1468-3083.2007.02203.x |
| [10] |
莫智峰, 何汉忠, 张焯荣, 等. 腹腔镜下个体化处置疝囊治疗小儿腹股沟斜疝的应用体会[J]. 临床小儿外科杂志, 2020, 19(12): 1130-1134. Mo ZF, He HZ, Zhang ZR, et al. Application of individualized laparoscopy for oblique inguinal hernia based upon the classification of internal ring in children[J]. J Clin Ped Sur, 2020, 19(12): 1130-1134. DOI:10.3969/j.issn.1671-6353.2020.12.013 |
| [11] |
Kubaski F, de Oliveira Poswar F, Michelin-Tirelli K, et al. Mucopolysaccharidosis type I[J]. Diagnostics (Basel), 2020, 10(3): 161. DOI:10.3390/diagnostics10030161 |
| [12] |
Muenzer J, Wraith JE, Clarke LA, et al. Mucopolysaccharidosis I: management and treatment guidelines[J]. Pediatrics, 2009, 123(1): 19-29. DOI:10.1542/peds.2008-0416 |
 2023, Vol. 22
2023, Vol. 22


