2. 温州医科大学附属第二医院 育英儿童医院病理科, 温州 325000
2. Department of Pathology, Second Affiliated Hospital & Yuying Children's Hospital, Wenzhou Medical University, Wenzhou 325000, China
嗜酸性实性和囊性肾细胞癌(eosinophilic solid and cystic renal cell carcinomas, ESC RCC) 常发生于成年女性,发病年龄集中于40~50岁,儿童罕见。肿瘤常单发,无偏侧倾向,恶性程度较低,呈惰性,极少发生复发和转移,少数患者伴有结节性硬化症(tuberous sclerosis complex, TSC)。该肿瘤多表现为边界清楚的肿块,无完整包膜,肿瘤长径5~13 cm[1-3]。温州医科大学附属第二医院、育英儿童医院近期收治1例儿童ESC RCC患者,本文通过分析该例患儿临床资料,并对相关文献进行归纳,总结ESC RCC的临床病理特征、诊治方法及预后,以提高小儿外科医生对该类型肿瘤的认识。
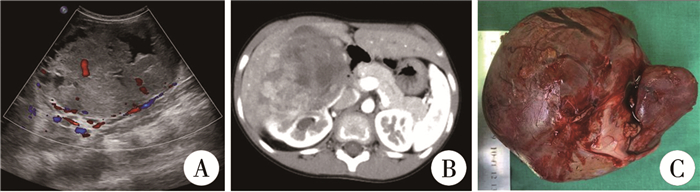
病例资料 一、本院患儿临床资料患儿女,9岁,因“右侧腹部隆起3 d”入院,既往无尿频、尿急、尿痛,无血尿及腰痛,无腹痛、腹胀,无TSC相关临床表现(血管平滑肌瘤、皮肤病理改变和癫痫发作)。体格检查:腹平软,未见胃肠型及蠕动波,右侧腹部局部隆起,可触及大小约8 cm×5 cm包块,边界尚清楚,质地硬,无触痛,活动欠佳,全腹无压痛及反跳痛,双肾区叩击痛(-)。实验室检查:血常规、肝肾功能、血电解质、凝血功能及尿常规检查未见明显异常,甲胎蛋白:3.62×10-9mol/L,癌胚抗原:1.90×10-9mol/L,糖类抗原12-5:2.07×10-9mol/L,糖类抗原19-9:2.48×10-9mol/L,糖类抗原72-4:0.39×10-9mol/L,神经元特异度烯醇化酶:59.25×10-9mol/L。腹部B超检查:双肾皮质回声正常,皮、髓质界限清楚,集合系统未见分离,右肾中下部见一混合回声团,大小约114 mm×75 mm,内部可见不规则液性暗区,右肾其余组织及肝脏受压(图 1A),提示右肾占位性病变。腹部CT增强检查见右肾巨大混杂密度肿块影,增强后明显不均匀强化,边界清楚,大小约111 mm×82 mm(图 1B),诊断为右肾巨大占位,考虑横纹肌样瘤可能。
|
图 1 嗜酸性实性和囊性肾细胞癌患儿超声、CT影像及手术切除标本 Fig.1 Ultrasound, CT images and surgical resection specimens of eosinophilic solid and cystic renal cell carcinoma patient in our hospital 注 A:术前B超检查见右肾中下部一混合回声团;B:腹部CT提示右肾巨大混杂密度团块影,增强后明显不均匀强化;C:术中切除的右肾肿瘤大体标本 |
患儿经多学科团队讨论后,在全身麻醉下行右肾巨大肿瘤根治性切除术。术中见肿瘤呈灰黄暗红色,质韧,位于右肾中下极,肿瘤底部与腹膜后组织相连,肉眼见肿瘤大小约110 mm×80 mm,无明显包膜,周围未见肿大淋巴结(图 1C)。术中快速冰冻病理检查结果为右肾肿瘤(倾向于肾细胞癌),输尿管切缘阴性。术中失血量约10 mL,手术过程顺利,术后未予放化疗,恢复可,术后第5天出院,截至目前已随访6个月,未见肿瘤复发。
术后病理检查结果:肿瘤大小约120 mm×90 mm,切面呈灰黄暗红色,多结节状,局部见囊腔。右肾血管周围及右肾周围脂肪组织未见肿瘤累及,卫星灶(-);癌组织坏死(-);肉瘤样分化(-);横纹肌样分化(-);纤维被膜侵犯(-);肾周脂肪侵犯(-);输尿管组织及输尿管切缘(-);血管切缘(-);神经侵犯(-);脉管内癌栓(-);肾静脉瘤栓/侵犯(-);肾窦侵犯(-);免疫组化:CK20(+)、PAX-8(+)、CD117(+)、Vim(少部分+)、CK(部分+)、CK7(-)、CD10(-)、TEE3(-)、P504S(部分+)、Ki-67 3% ~5%(+)、CAIX(-)、CD34(间质血管+,血管丰富)。
二、文献检索情况检索中国知网、万方、PubMed、Web of Science等数据库。检索关键词:嗜酸性实性和囊性肾细胞癌(eosinophilic solid and cystic renal cell carcinomas);检索日期为2000年1月1日至2021年12月31日。文献纳入标准:①关于嗜酸性实性和囊性肾细胞癌的个案报道或病例报道;②年龄小于18岁。排除标准:仅在文章摘要描述、信息缺失过多或笼统描述病例个数而无具体临床资料的文献。
共获得3篇文献报道6例ESC RCC患儿(表 1),患儿中位诊断年龄14岁(9~17岁),2例因出现临床症状而就诊,但均无结节性硬化症相关临床表现(血管平滑肌瘤、皮肤病理改变和癫痫发作);1例为双侧,其余为单侧(2例右侧,1例左侧,2例单侧未注明具体侧别)。1例行部分肾切除术;6例行根治性肾肿瘤切除术,其中1例因下腔静脉受累,合并肺栓塞,术后予辅助化疗,2年后出现肝转移。5例出现TSC基因突变,均为TSC2基因突变。免疫病理提示6例CK20阳性(100%);3例CK7阴性及PAX-8阳性,3例未注明。中位随访时间18个月(6~132个月),均存活,无一例复发。
| 表 1 2001—2021年文献报道嗜酸性实性和囊性肾细胞癌患儿临床资料 Table 1 Clinical data of children with eosinophilic solid and cystic renal cell carcinoma |
|
|
ESC RCC是一种新发现的罕见肾肿瘤,最早由Trpkov等[2]于2016年首次报道,目前尚未纳入世界卫生组织(2016)泌尿生殖系统肿瘤分类,儿童病例报道较少,其流行病学、临床特点、病理特点以及预后情况尚未明确。
|
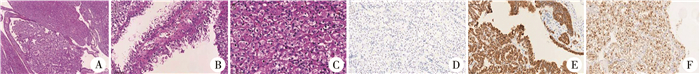
图 2 嗜酸性实性和囊性肾细胞癌特征性病理表现 Fig.2 Characteristic pathological manifestations of eosinophilic solid and cystic renal cell carcinoma patient 注 A:肿瘤呈实性片状、乳头状或囊状排列(HE染色,×40);B:囊壁衬覆立方上皮,可见靴钉样凸起(HE染色,×200);C:实性区肿瘤细胞呈圆形、卵圆形,胞质嗜酸,其内含有粗颗粒状的点彩状斑点(HE染色,×400);D:肿瘤细胞CK7(-)(免疫组化,×200);E:肿瘤细胞CK20(+)(免疫组化,×200);F:肿瘤细胞PAX-8(+)(免疫组化,×200) |
ESC RCC多见于成年女性,发病年龄多集中在40~50岁,部分可发生于青年男性,儿童罕见[1-3, 6]。该病的真实发病率目前尚不明确,据不完全统计约为0.2%[7]。儿童和成人ESC RCC的异同点在于:①成人好发于女性,儿童未见明显性别差异。②成人和儿童均无偏侧倾向,常为单侧, 成人多为单发病灶,而本研究7例中有3例为多发病灶[3, 8]。③临床症状基本一致,主要表现为腹痛、腹部肿块,成人患者中约10%伴有结节性硬化症(tuberous sclerosis complex, TSC),本研究7例均无结节性硬化症相关临床表现[9]。④成人多为TSC1/TSC2基因突变,儿童多为TSC2基因突变[1, 3]。ESC RCC在临床表现上与其他类型儿童肾恶性肿瘤稍有不同。儿童肾细胞癌中最常见类型是MiT家族易位型肾细胞癌,此类患儿早期多无症状,但有时症状多变,临床症状可由肾癌本身或转移灶压迫和侵犯引起,也可由肾癌细胞所分泌的激素或代谢产物产生,最常见的临床症状是肉眼血尿[10]。大部分ESC RCC患者早期无症状,多于体检时经影像学检查偶然发现,少部分因腰腹痛、肩部疼痛、腹部肿块及腰部占位等临床症状就诊,多无血尿[1, 2, 6, 11-13]。儿童肾恶性肿瘤中最常见的肾母细胞瘤多以腹部包块为首发症状,部分可出现血尿、发热、尿路感染、精索静脉曲张、高血压或低血压、贫血等[14]。本研究7例ESC RCC患儿中3例存在腹痛、腹部肿块,无一例出现血尿。儿童ESC RCC与其他类型儿童肾细胞癌相似,发病年龄一般大于5岁。本研究7例平均发病年龄为13岁(9~17岁)。而肾母细胞瘤发病年龄常小于5岁,2~3岁是其发病的高峰年龄,男女发病率无明显差异[15]。
各种类型儿童肾癌与肾母细胞瘤在实验室检查和影像学检查上均无特异度表现。儿童肾细胞癌患者实验室检查可表现为血尿、贫血、血沉增快、高血糖、高血钙、肾功能异常及肝功能异常等,目前尚无公认的用于儿童肾癌辅助诊断的血清学标志物[10]。本院收治的ESC RCC患儿神经元特异度烯醇化酶较正常值稍高,其余实验室检查均未见明显异常。影像学检查对儿童肾癌的诊治有重要作用,腹部超声常表现为混合回声团,内有不规则液性暗区[4]。腹部CT检查是儿童肾癌术前诊断最常用的检查方法,ESC RCC的CT检查常表现为混杂密度肿块,增强后呈明显不均匀强化,边界尚清楚。儿童肾母细胞瘤CT平扫也常表现为混杂密度肿块,增强后实质部分轻中度强化、囊性部分无强化,与ESC RCC患者的CT表现无明显差异[16]。
中国泌尿外科疾病诊断治疗指南认为,对年老体弱或有手术禁忌证的肾癌患者或不能手术而需化疗或其他治疗(如射频消融、冷冻消融等)的晚期肾癌患者,治疗前可选择肾穿刺活检获取病理诊断,而肾穿刺活检对肾细胞癌的诊断价值有限。ESC RCC是否需要穿刺暂无定论,本研究中7例均未行术前穿刺。治疗方式以患侧肾根治性切除或肿瘤剜除术为主,本研究中5例行患侧肾根治性切除,1例下腔静脉受累、肺栓塞,2年后以肝转移形式复发,予mTOR抑制剂依维莫司化疗,8年后复查未见其他器官转移[17]。1例双侧ESC RCC行双侧肾部分切除术。根据美国癌症分期联合委员会制定的TNM分期标准,本院收治患儿属于肾癌Ⅱ期(T2bN0M0),行患侧肾根治性切除术[10]。既往文献报道,肾完全切除的儿童肾细胞癌无论淋巴结活检病理是否阳性,均预后良好,无需放化疗[10]。本院收治患儿术后未予放化疗,术前腹部超声、胸部CT、头颅MRI未见明显异常,术后未行发射型计算机断层扫描仪(emission computed tomography, ECT)、正电子发射计算机断层显像(positron emission tomography-computerized tomography, PET-CT)等全身肿瘤系统扫描评估,仅行常规腹部B超及CT检查。截至目前已随访6个月,未见肿瘤复发及转移。但文献复习6例中有1例合并下腔静脉癌栓、肺栓塞及肝转移。
肿瘤切面多呈棕黄色,大多数表现为混合实性和巨囊性外观,典型表现为边界清楚但无包膜的肿块,坏死、出血少见[1-2]。有文献报道ESC RCC最大长径平均为50 mm[2]。本文结果与文献报道相似。肿瘤细胞镜下表现胞质丰富,嗜伊红染色可有大小不一的空泡,呈透明细胞样,部分区域可有类似乳头样结构,胞质中见特征性颗粒状点彩,这些颗粒在电镜下被证实为粗面内质网聚集体[2, 7]。细胞核呈圆形或卵圆形,核分裂象少见。肿瘤主要由嗜酸性细胞组成,实性区肿瘤多呈片状或团块状排列,部分呈腺管状或岛状;囊性区囊壁被覆细胞多呈靴钉样凸起[4, 17]。
肿瘤细胞免疫表型常表现为PAX-8表达、CK20阳性及CK7阴性,大部分患者CD117阴性,其中CK20阳性及CK7对ESC RCC的诊断有重要提示作用[2, 7]。成人和儿童ESC RCC常发生TSC1/TSC2基因突变,导致雷帕霉素靶蛋白信号通路过度激活,促进细胞的生长和增殖。本研究7例中,5例发生TSC2基因突变,1例无突变,1例未测定是否存在突变;未发现TSC1突变。
总之,由于目前嗜酸性实性和囊性肾细胞癌罕见,肿瘤的具体性质、影像学诊断特点及临床与病理表现仍有待进一步研究。根据已有文献报道,ESC RCC具有独特的形态学特点和免疫表型,临床预后良好,可视为一种独立类型的肾肿瘤。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 文献检索、论文调查设计及论文结果撰写为邵佳文、周平江;数据收集与分析邵佳文、周平江、周玲玲、李仲荣;论文讨论分析为邵佳文、周平江、李仲荣
| [1] |
Li YJ, Reuter VE, Matoso A, et al. Re-evaluation of 33 'unclassified' eosinophilic renal cell carcinomas in young patients[J]. Histopathology, 2018, 72(4): 588-600. DOI:10.1111/his.13395 |
| [2] |
Trpkov K, Hes O, Bonert M, et al. Eosinophilic, solid, and cystic renal cell carcinoma: clinicopathologic study of 16 unique, sporadic neoplasms occurring in women[J]. Am J Surg Pathol, 2016, 40(1): 60-71. DOI:10.1097/PAS.0000000000000508 |
| [3] |
Palsgrove DN, Li YJ, Pratilas CA, et al. Eosinophilic solid and cystic (ESC) renal cell carcinomas harbor TSC mutations: molecular analysis supports an expanding clinicopathologic spectrum[J]. Am J Surg Pathol, 2018, 42(9): 1166-1181. DOI:10.1097/PAS.0000000000001111 |
| [4] |
杨文萍, Chang KTE, 徐红艳, 等. 具有TSC2基因突变的儿童嗜酸性实性和囊性肾细胞癌临床病理学观察[J]. 中华病理学杂志, 2020, 49(7): 693-698. Yang WP, Chang KTE, Xu HY, et al. Eosinophilic solid and cystic renal cell carcinoma with TSC2 gene mutations in children[J]. Chin J Pathol, 2020, 49(7): 693-698. DOI:10.3760/cma.j.cn112151-20191217-00807 |
| [5] |
牛云, 李冬梅, 刘平平, 等. 嗜酸性实性和囊性肾细胞癌伴肿瘤性骨软化症一例[J]. 中华病理学杂志, 2021, 50(7): 829-831. Niu Y, Li DM, Liu PP, et al. Eosinophilic solid and cystic renal cell carcinoma with tumor-induced osteomalacia: one case report[J]. Chin J Pathol, 2021, 50(7): 829-831. DOI:10.3760/cma.j.cn112151-20201225-00966 |
| [6] |
Tretiakova MS. Eosinophilic solid and cystic renal cell carcinoma mimicking epithelioid angiomyolipoma: series of 4 primary tumors and 2 metastases[J]. Hum Pathol, 2018, 80: 65-75. DOI:10.1016/j.humpath.2018.05.023 |
| [7] |
Trpkov K, Abou-Ouf H, Hes O, et al. Eosinophilic solid and cystic renal cell carcinoma (ESC RCC): further morphologic and molecular characterization of ESC RCC as a distinct entity[J]. Am J Surg Pathol, 2017, 41(10): 1299-1308. DOI:10.1097/PAS.0000000000000838 |
| [8] |
National Health Commission of the People's Republic of China. Chinese guidelines for diagnosis and treatment of renal cell carcinoma 2018 (English version)[J]. Chin J Cancer Res, 2019, 31(1): 29-48. DOI:10.21147/j.issn.1000-9604.2019.01.02 |
| [9] |
Trpkov K, Hes O. New and emerging renal entities: a perspective post-WHO 2016 classification[J]. Histopathology, 2019, 74(1): 31-59. DOI:10.1111/his.13727 |
| [10] |
李仲荣. 儿童肾细胞癌诊治现状[J]. 浙江医学, 2021, 43(22): 2389-2392. Li ZR. Diagnosis and treatment of renal cell carcinoma in children[J]. Zhejiang Med J, 2021, 43(22): 2389-2392. DOI:10.12056/j.issn.1006-2785.2021.43.22.2021-2327 |
| [11] |
Parilla M, Kadri S, Patil SA, et al. Are sporadic eosinophilic solid and cystic renal cell carcinomas characterized by somatic tuberous sclerosis gene mutations?[J]. Am J Surg Pathol, 2018, 42(7): 911-917. DOI:10.1097/PAS.0000000000001067 |
| [12] |
Mehra R, Vats P, Cao XH, et al. Somatic bi-allelic loss of TSC genes in eosinophilic solid and cystic renal cell carcinoma[J]. Eur Urol, 2018, 74(4): 483-486. DOI:10.1016/j.eururo.2018.06.007 |
| [13] |
史倩芸, 王小桐, 付尧, 等. 嗜酸性实性囊性肾细胞癌4例临床病理分析[J]. 临床与实验病理学杂志, 2019, 35(8): 916-919. Shi QY, Wang XT, Fu Y, et al. Eosinophilic solid and cystic renal cell carcinoma: clinicopathologic analysis of four cases[J]. Chin J Clin Exp Pathol, 2019, 35(8): 916-919. DOI:10.13315/j.cnki.cjcep.2019.08.008 |
| [14] |
洪博, 董瑞. 肾母细胞瘤治疗研究进展[J]. 临床小儿外科杂志, 2021, 20(6): 569-575. Hong B, Dong R. Recent advances in the treatment of Wilms tumor[J]. J Clin Ped Sur, 2021, 20(6): 569-575. DOI:10.12260/lcxewkzz.2021.06.012 |
| [15] |
Dome JS, Perlman EJ, Graf N. Risk stratification for wilms tumor: current approach and future directions[J]. Am Soc Clin Oncol Educ Book, 2014, 34: 215-223. DOI:10.14694/EdBook_AM.2014.34.215 |
| [16] |
徐丰, 郭春娜, 李博. CT诊断肾母细胞瘤患儿的价值观察[J]. 中国CT和MRI杂志, 2021, 19(1): 135-137. Xu F, Guo CN, Li B. Diagnostic value of CT for nephroblastoma children[J]. Chin J CT MRI, 2021, 19(1): 135-137. DOI:10.3969/j.issn.1672-5131.2021.01.046 |
| [17] |
刘宇飞, 蔡玲玲, 胡余昌. 嗜酸性实性和囊性肾细胞癌病理研究进展[J]. 巴楚医学, 2020, 3(3): 110-113. Liu YF, Cai LL, Hu YC. Progress in the pathological research of eosinophilic solid and cystic renal cell carcinoma[J]. Bachu Med J, 2020, 3(3): 110-113. DOI:10.3969/j.issn.2096-6113.2020.03.026 |
 2023, Vol. 22
2023, Vol. 22


