胆道闭锁(biliary atresia, BA)是一种婴幼儿期以胆道堵塞导致严重黄疸为特征的疾病, 病因不明[1]。不同地区BA发病率不同,欧洲发病率约1/18 000,亚洲较高,达1/5 000[2]。BA一般分为三种类型,囊肿型胆道闭锁(cystic biliary atresia, CBA)是三型以外不常见的一种特殊类型,占BA总病例数的5% ~10%,特征性表现是肝门部出现囊性改变[3-6]。产前超声筛查可增加肝门囊性肿块的检出率,但无法鉴别CBA与先天性胆管扩张症(congenital biliary dilatation, CBD)。由于CBA和CBD具有很高的相似性,容易混淆导致误诊,然而两者手术干预的时机及手术方案截然不同。本研究将着重讨论CBA和CBD临床指标的差异,并对比相关诊断参数,为CBA和CBD的早期诊断及治疗提供参考依据。
资料与方法 一、研究对象回顾性分析2013年1月至2022年1月遵义医科大学附属医院收治的34例年龄小于150 d的肝门囊肿患儿临床资料,根据术中胆道造影结果分为CBA组(n=14)和CBD组(n=20)。CBA患儿均因皮肤黄染及大便颜色变浅入院;20例CBD患儿中,4例因皮肤黄染入院,3例因大便颜色变浅入院,13例因产前超声发现肝门处囊肿或体检发现肝门处囊肿入院;CBA组有1例合并先天性心脏病。CBA诊断标准:术中胆道造影见肝内外胆管未显影或仅囊肿显影,探查肝门处可见一囊性肿块,其近端在肝门闭锁处形成纤维斑块,术后肝脏病理显示小胆管增生及胆汁淤积。本研究经遵义医科大学伦理委员会批准(KLL—2022—769),患儿家属均知情同意。
二、研究方法收集患儿性别、手术时年龄、入院时体重、术前血常规及血生化检查结果,后两者主要包括白细胞数(white blood cell, WBC)、中性粒细胞百分比(neutrophil percentage, NEUT%)、中性粒细胞绝对值(neutrophil, NEUT)、淋巴细胞百分比(lymphocyte percentage, LYN%)、淋巴细胞绝对值(lymphocyte, LYN)、红细胞数(red blood cell, RBC)、血红蛋白(hemoglobin, Hb)、丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、γ-谷氨酰转肽酶(γ-gamma-glutamyltransferase, GGT)等。所有CBA和CBD患儿术前行腹部超声和磁共振检查,根据超声、磁共振检查结果记录以下数据:①胆囊大小和形状;②餐前、餐后胆囊大小变化;③肝门囊肿大小。所有患儿行术中胆道造影,造影剂进入后若显示肝门处有囊肿,肝内、肝外胆道未显影,则判定为CBA;相反,胆总管囊肿显影,伴或不伴肝内外胆管扩张,则判定为CBD。记录术中切开囊肿后壁内情况,肝内外胆管和囊肿中是否有造影剂。本研究将胆囊大小分为正常、条索状和未探及三种。
三、统计学处理采用SPSS 26.0进行统计学分析。服从正态分布的计量资料用x±s表示,两组间比较采用独立样本t检验;计数资料用频数、构成比表示,组间比较采用卡方检验;将差异有统计学意义的指标纳入受试者操作特征(receiver operating characteristic, ROC)曲线运算,得到超声测量肝门处囊性肿块大小对诊断CBA的最佳截断值、曲线下面积(area under the curve, AUC)、敏感度及特异度;P<0.05表示差异有统计学意义。
结果 一、两组患者基本情况两组患儿性别差异具有统计学意义(P<0.05),但体重和手术年龄差异无统计学意义(P>0.05),见表 1。
| 表 1 CBA组与CBD组肝门囊肿患儿一般情况比较 Table 1 Comparison of general profiles between CBA and CBD groups |
|
|
CBA组TBIL、DBIL、ALT、AST、GGT数值范围分别为133.4~220.1 μmol/L,75.5~120.7 μmol/L,80~348 U/L,157~364 U/L,138~997 U/L。CBD组TBIL、DBIL、ALT、AST、GGT数值范围分别为2.5~239.1 μmol/L,0.9~114.2 μmol/L,15~203 U/L,37~373 U/L,14~1 074 U/L。CBA组TBIL、DBIL、ALT、AST均高于CBD组,差异有统计学意义(P<0.05);两组间GGT比较,差异无统计学意义(P>0.05)。CBA组患儿WBC、NEUT%、NEUT、LYN%、LYN、RBC及Hb数值范围分别为4.83×109~ 18.56×109/L、0.12~0.35、1.4×109~3.67×109/L、0.44~0.77、2.99×109~12.44×109/L、2.61×109 ~4.41×109/L、82.0~128.0 g/L。CBD组患儿WBC、NEUT%、NEUT、LYN%、LYN、RBC及Hb数值范围分别为4.91×109~18.72×109/L、0.14~0.44、10.99×109~6.68×109/L、0.50~0.81, 2.45×109~12.73×109/L、3.08×109~5.01×109/L、85.0~152.0 g/L,差异均无统计学意义(P>0.05)。分别用TBIL、DBIL、ALT、AST指标绘制ROC曲线(图 1A),其中TBIL的鉴别诊断价值最高,AUC为0.89,当TBIL≥98.5 μmol/L时,敏感度和特异度分别为91.9%和85.2%。见表 2。
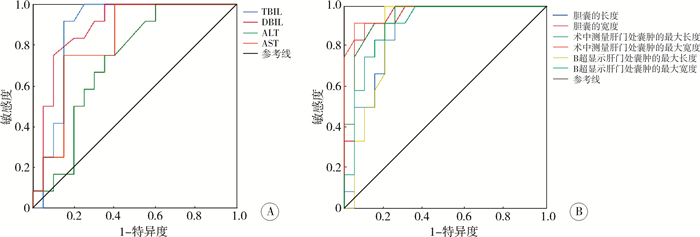
|
图 1 各指标诊断囊肿型胆道闭锁的ROC曲线图 Fig.1 ROC curve diagram of each parameter for diagnosing CBA 注 A:TBIL、DBIL、ALT、AST的AUC分别为0.89、0.87、0.72、0.82;B:胆囊的长度、胆囊的宽度、术中测量肝门处囊肿的最大长度、术中测量肝门处囊肿的最大宽度、超声显示肝门处囊肿的最大长度、超声显示肝门处囊肿的最大宽度的AUC分别为0.88、0.95、0.95、0.98、0.89、0.92;TBIL: 总胆红素;DBIL: 直接胆红素;ALT: 丙氨酸转氨酶;AST: 天冬氨酸转氨酶; ROC: 受试者操作特征曲线;AUC: 曲线下面积 |
| 表 2 单个指标对CBA的诊断效能 Table 2 Diagnostic efficiency of each single parameter for CBA |
|
|
CBA组患儿超声检查结果显示:9例未探及胆囊,2例为条索状胆囊,3例胆囊小、萎缩;餐前、餐后胆囊形态均未见明显变化。CBD组患儿超声检查结果表明胆囊大小均在正常值范围内。术中探查见CBA组胆囊发育较差,条索状,甚至没有管腔,同彩超探查结果相似;CBD组胆囊无萎缩,大小正常,无肝门处纤维块表现。超声显示CBA组胆囊长度、胆囊宽度、肝门处囊肿的最大宽度、肝门处囊肿的最大长度数值范围分别为0.40~5.00 cm、0.05~1.00 cm、0.10~2.30 cm、0.25~3.50 cm;CBD组胆囊长度、胆囊宽度、肝门处囊肿的最大宽度、肝门处囊肿的最大长度数值范围分别为2.8~10.5 cm、0.5~4.5 cm、1.6~9.0 cm、2.0~12.0 cm,差异均有统计学意义(P<0.001)。术中探查CBA组肝门处囊肿的最大宽度和肝门处囊肿的最大长度数值范围分别为0.08~2.30 cm,0.30~3.50 cm;CBD组肝门处囊肿的最大宽度和肝门处囊肿的最大长度数值范围分别为1.6~8.9 cm,1.8~12.3 cm,差异均有统计学意义(P<0.001),见表 3。分别用胆囊长度、胆囊宽度、术中测量肝门处囊肿的最大长度、术中测量肝门处囊肿的最大宽度、超声显示肝门处囊肿的最大长度、超声显示肝门处囊肿的最大宽度绘制ROC曲线图(图 1B),结果显示:术中测量肝门处囊肿的最大宽度的AUC最大,为0.98,最佳截断值为2.4 cm,诊断CBA的敏感度和特异度分别为91.0%和95.2%。胆囊的宽度AUC为0.95,最佳截断值为0.7 cm,诊断CBA的敏感度和特异度分别为91.0%和89.6%。超声测量肝门处囊肿的最大长度AUC为0.89,最佳截断值为3.1 cm,诊断CBA的敏感度和特异度分别为90.2%和78.8%;超声测量肝门处囊肿的最大宽度AUC为0.92,最佳截断值为2.3 cm,诊断CBA的敏感度和特异度分别为80.2%和85.9%。术前所有患儿行磁共振检查,CBA组有5例在肝门处可见囊性肿块(图 2A),其余患儿未见肝内外胆道扩张;CBD组患儿均可在肝门处见囊性肿块(图 2B)。
| 表 3 CBA组与CBD组肝门囊肿患儿临床资料相关数据比较(x±s) Table 3 Comparison of clinical data between CBA and CBD groups(x±s) |
|
|
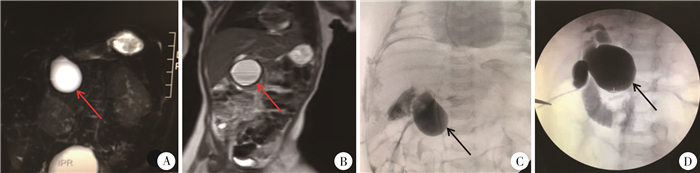
|
图 2 CBA患儿磁共振和术中胆道造影显示囊肿图像 Fig.2 MRI images of intraoperative cholangiography 注 图A、图B分别为一例56日龄CBA男性患儿和一例68日龄CBD男性患儿的磁共振图像,A:磁共振显示CBA患儿肝门处囊肿,边界清楚;B:磁共振显示CBD患儿肝门处囊肿,边界清楚。图C、图D分别为一例56日龄CBA男性患儿和一例68日龄CBD男性患儿的术中胆道造影图像,C:术中胆道造影在CBA患儿中仅囊肿显影;D:术中胆道造影在CBD患儿中胆囊、囊肿、十二指肠均显影;CBA: 囊肿型胆道闭锁; CBD:先天性胆管扩张症 |
CBA组术中胆道造影结果显示,9例肝内、外胆道均未见显影,5例囊肿显影,但囊肿上下胆道均未显影(图 2C)。14例均行Kasai手术,肝门部探查见囊性包块,囊肿与超声检查相似,切开囊肿见囊肿壁明显增厚、水肿,其内可见少量胆色素,7例囊肿内见少量淡黄色似胆汁样物,6例囊肿较小,几乎为实性包块,1例囊肿内似为坏死组织,培养无细菌生长,囊肿与肝内胆管不相通。CBD可见囊肿显影,造影剂通过胆道(图 2D),切开囊肿见大量胆汁流出。CBA患儿均按胆道闭锁的常规治疗方法给予抗生素、糖皮质激素和脂溶性维生素治疗。14例CBA患儿中,术中发现最大囊肿的最大长度为3.5 cm,最大宽度为2.3 cm,胆囊狭小(图 3A),与术前超声结果一致。CBD患儿的囊肿较大,胆囊大小正常,胆囊壁光滑,壁厚正常(图 3B)。
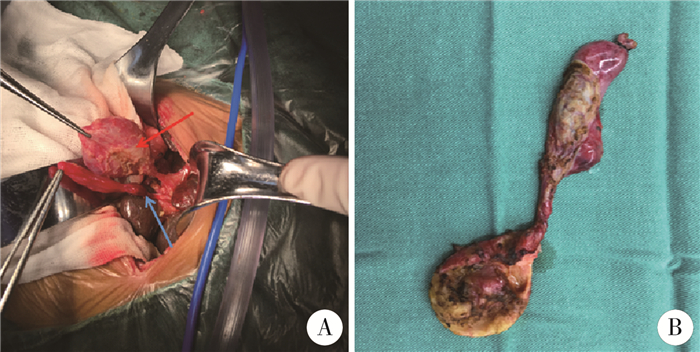
|
图 3 CBA与CBD患儿囊肿图像 Fig.3 Images of hilar cyst in CBA and CBD children 注 图A和图B分别为CBA与CBD患儿术中探查肝门处囊肿图像;A:蓝色箭头为胆囊,红色箭头为肝门处囊肿;B:胆囊大小正常,无肝门纤维肿块,囊肿扩张; CBA: 囊肿型胆道闭锁;CBD:先天性胆管扩张症 |
CBA和CBD是引起婴幼儿梗阻性黄疸的常见病因。CBA是BA的一种特殊类型,通常预后较好[7]。对于CBA和CBD患儿,远端胆管狭窄或盲端囊肿都可能导致梗阻性黄疸,超声均可表现为肝门处囊肿。因此,CBA和CBD在疾病早期阶段难以鉴别,CBA容易被误诊为CBD,导致患儿错过最佳手术时机,影响患儿的预后[8]。CBA患儿若不进行早期手术干预,会迅速发展为肝硬化,危及生命;而CBD患儿在发现腹部肿物后才会出现少许症状[9]。同时,两种疾病的手术方式也有显著差异:CBA采用Kasai手术,CBD采用囊肿切除和肝总管空肠吻合术。因此,本研究旨在分析CBA和CBD诊断指标的差异,为早期诊断和早期手术提供参考依据。
本组14例CBA患儿,婴幼儿期即出现明显黄疸、肝功能损害、胆红素增高(以DBIL增高为主);20例CBD患儿均有黄疸,但肝功能指标显著低于CBA组,这说明CBD患儿肝功损害较轻,出现这种情况的主要原因是CBA胆道梗阻比CBD更为严重[10]。本研究中所有CBA患儿ALT、AST、TBIL和DBIL值均高于同组CBD患儿,且差异均有统计学意义。由此可见,这些生化指标对疾病诊断有一定的参考价值,但不能完全根据生化指标将两者进行鉴别[7, 11-12]。根据我们的研究结果,两组患儿GGT数值差异无统计学意义,因此不能作为鉴别两者的诊断标准,这与相关文献报道一致[11]。Chen等[13]认为使用GGT作为鉴别诊断标准,患儿的年龄是必须考虑的因素,并提出GGT水平有助于诊断日龄120 d以内的患儿。因此,后期进一步研究需要根据年龄分层分析,并扩大样本量。
对于梗阻性黄疸患儿而言,超声检查具有无创、快捷的优势[14]。本研究通过超声检查发现CBD组胆囊大小均正常,而CBA组胆囊偏小或未探及胆囊,胆囊萎缩、僵硬或呈条索状。对比两组患儿胆囊长度、宽度发现,CBA组胆囊的宽度及长度均显著小于CBD组。Kanegawa等[15]报道,胆囊长度小于15 mm可作为BA的诊断标准。Mahalik等[16]也提出CBA的胆囊可以是闭锁、发育不良或正常,而CBD患儿均可见胆囊,且发育正常,这与我们的研究结果一致。本研究发现,胆囊宽度对CBA有较高的诊断价值,敏感度和特异度分别为91.0%和89.6%。因此当胆囊的宽度≤0.7 cm时,应考虑为CBA。肝门处囊肿在CBA与CBD患儿均可探及,所以通过超声鉴别二者仍存在一定的难度。本研究CBA患儿的肝门囊肿明显小于CBD患儿,超声显示肝门处囊肿的最大长度≤3.1 cm及超声显示肝门处囊肿的最大宽度≤2.3 cm,对CBA有较高的诊断价值。既往文献报道肝门处囊肿直径<1.5 cm时应考虑CBA,并指出肝门处囊肿大小是区分CBA与CBD准确度最高的参数[17]。也有文献报道指出,肝门处囊肿大小以直径3.5 cm为界值时,诊断CBA的敏感度为83.9%、特异度为95.5%[12]。术中切开囊肿壁发现,CBD内有大量深绿色胆汁和胆泥,而CBA只有少量黄色液体。CBD通常表现为大囊肿,伴有大量胆汁和胆泥,胆囊通常不闭锁,肝管更容易扩张,造影剂可进入十二指肠,而这些表现在CBA患儿中是没有的。CBA组术中1例囊肿表现为无菌性坏死组织,这可能是由于囊肿与肝内外胆管不相通,导致胆汁淤积,逐渐形成无菌性坏死组织。小囊肿、纤维肿块表现、胆囊小、胆囊萎缩、胆囊壁不规则是CBA在超声图像上的特征性改变,与我们的手术探查发现相似,若黄疸患儿超声观察到上述一个及以上征象,则应高度怀疑CBA。
磁共振是CBD患儿必要的术前检查方法,不同类型CBD磁共振图像显示的胆总管不同,胆总管可呈囊性扩张、节段性扩张及梭形扩张等,较为典型的是肝门处胆总管囊性扩张、边缘规整[18]。本研究表明,并非所有CBA患儿的磁共振检查都能显示囊肿,只有囊肿达到一定大小,才能看到肝门处有囊肿,因此无法单纯根据磁共振结果上的囊肿大小来鉴别CBA和CBD。绝大多数CBA患儿磁共振显示胆囊狭长、边缘不规整,有少数患儿未见胆囊显示[19]。
婴幼儿期鉴别CBA与CBD存在一定难度,它们在影像学上表现相似,但预后不同。研究表明,CBA患儿早期行介入Kasai手术(小于70日龄)可以改善胆管引流,治疗效果优于单纯性胆道闭锁。而CBD往往可以允许相对较晚的手术干预,因此早期区分两者对于BA治疗有积极意义[9, 20-21]。文献报道,60日龄内手术治疗的效果差于超过60日龄接受手术的患儿[22]。虽然对于手术的最佳年龄没有统一标准,但我们认为生后60~90 d接受手术对于恢复胆汁引流、控制炎症发展和减缓肝硬化进展至关重要。不管产前是否发现囊肿,只要患儿出现梗阻性黄疸症状,在一般情况稳定的前提下应尽早手术治疗。刁美等[23]认为产前发现囊肿的CBD患儿应在出生后1个月内行手术治疗,不仅能有效防止肝脏发生进行性损害,而且能避免完全性胆道梗阻或胆总管穿孔的风险。总之,CBA和CBD患儿早期手术治疗的关键在于早诊断,但目前常规检查如生化检查、超声、磁共振均不能明确鉴别CBA和CBD。所以,对于存在持续性梗阻性黄疸的患儿术前常规检查方法无法确诊时,可进一步行术中胆道造影[5]。
综上所述,超声测量肝门处囊肿的最大宽度有助于从出生后肝门处存在囊肿的黄疸患儿中诊断出CBA。若超声发现胆囊宽度较小且肝门处囊肿的最大宽度≤2.3 cm,患儿被诊断为CBA的可能性大,需早期进行胆道造影及手术治疗。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 章开智、陈雨彤负责研究的设计、实施和起草文章;章开智,陈雨彤,郑泽兵,汤成艳,龚元,黄露,周万康进行病例数据收集及分析;刘远梅,金祝负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Wehrman A, Waisbourd-Zinman O, Wells RG. Recent advances in understanding biliary atresia[J]. F1000Res, 2019, 8(F1000 Faculty Rev): 218. DOI:10.12688/f1000research.16732.1 |
| [2] |
Chen L, Fu M, Tan LD, et al. Irrelevance of USF2 rs916145 polymorphism with the risk of biliary atresia susceptibility in Southern Chinese children[J]. Biosci Rep, 2020, 40(2): BSR20193623. DOI:10.1042/BSR20193623 |
| [3] |
Parra D, Fecteau A, Daneman A. Findings in percutaneous cho-langiography in two cases of Type Ⅲ cystic biliary atresia (with ultrasound correlation)[J]. BJR Case Rep, 2016, 2(2): 20150377. DOI:10.1259/bjrcr.20150377 |
| [4] |
Götze T, Blessing H, Grillhösl C, et al. Neonatal cholestasis-differential diagnoses, current diagnostic procedures, and treatment[J]. Front Pediatr, 2015, 3: 43. DOI:10.3389/fped.2015.00043 |
| [5] |
Tanaka H, Sasaki H, Wada M, et al. Postnatal management of prenatally diagnosed biliary cystic malformation[J]. J Pediatr Surg, 2015, 50(4): 507-510. DOI:10.1016/j.jpedsurg.2014.08.002 |
| [6] |
Bezerra JA, Wells RG, Mack CL, et al. Biliary atresia: clinical and research challenges for the twenty-first century[J]. Hepatology, 2018, 68(3): 1163-1173. DOI:10.1002/hep.29905 |
| [7] |
Pariente D, Franchi-Abella S. Cystic biliary atresia is different from choledochal cyst[J]. Pediatr Radiol, 2009, 39(9): 1019. DOI:10.1007/s00247-009-1308-4 |
| [8] |
Hill SJ, Clifton MS, Derderian SC, et al. Cystic biliary atresia: a wolf in sheep's clothing[J]. Am Surg, 2013, 79(9): 870-872. |
| [9] |
Ortiz-Perez A, Donnelly B, Temple H, et al. Innate immunity and pathogenesis of biliary atresia[J]. Front Immunol, 2020, 11: 329. DOI:10.3389/fimmu.2020.00329 |
| [10] |
Song Z, Dong R, Shen Z, et al. Surgical outcome and etiologic heterogeneity of infants with biliary atresia who received Kasai operation less than 60 days after birth: a retrospective study[J]. Medicine (Baltimore), 2017, 96(26): e7267. DOI:10.1097/MD.0000000000007267 |
| [11] |
于蒲, 潘永康, 李龙, 等. 囊肿型胆道闭锁与胆总管囊肿的临床对比研究[J]. 中华小儿外科杂志, 2018, 39(6): 440-444. Yu P, Pan YK, Li L, et al. Comparisons between cystic biliary atresia and choledochal cyst: a controlled clinical trial[J]. Chin J Pediatr Surg, 2018, 39(6): 440-444. DOI:10.3760/cma.j.issn.0253-3006.2018.06.008 |
| [12] |
Tang J, Zhang D, Liu W, et al. Differentiation between cystic biliary atresia and choledochal cyst: a retrospective analysis[J]. J Paediatr Child Health, 2018, 54(4): 383-389. DOI:10.1111/jpc.13779 |
| [13] |
Chen XL, Dong R, Shen Z, et al. Value of gamma-glutamyl transpeptidase for diagnosis of biliary atresia by correlation with age[J]. J Pediatr Gastroenterol Nutr, 2016, 63(3): 370-373. DOI:10.1097/MPG.0000000000001168 |
| [14] |
El-Guindi MAS, Sira MM, Konsowa HAS, et al. Value of hepatic subcapsular flow by color Doppler ultrasonography in the diagnosis of biliary atresia[J]. J Gastroenterol Hepatol, 2013, 28(5): 867-872. DOI:10.1111/jgh.12151 |
| [15] |
Kanegawa K, Akasaka Y, Kitamura E, et al. Sonographic diagnosis of biliary atresia in pediatric patients using the"triangular cord"sign versus gallbladder length and contraction[J]. AJR Am J Roentgenol, 2003, 181(5): 1387-1390. DOI:10.2214/ajr.181.5.1811387 |
| [16] |
Mahalik SK, Mitra S, Patra S, et al. Cystic biliary atresia or atretic choledochal cyst: a continuum in infantile obstructive cholangiopathy[J]. Fetal Pediatr Pathol, 2019, 38(6): 477-483. DOI:10.1080/15513815.2019.1627621 |
| [17] |
Huang FC, Hwang KP. Differential diagnosis of infantile choledochal cyst with or without biliary atresia[J]. Acta Paediatr Taiwan, 2006, 47(4): 175-180. |
| [18] |
Abbey P, Kandasamy D, Naranje P. Neonatal jaundice[J]. Indian J Pediatr, 2019, 86(9): 830-841. DOI:10.1007/s12098-019-02856-0 |
| [19] |
吴慧莹, 徐文彪, 鹿连伟, 等. 囊肿型胆道闭锁MRI和MRCP特征[J]. 中国医学影像技术, 2019, 35(1): 86-90. Wu HY, Xu WB, Lu LW, et al. MRI and MR cholangiopancreatographic characteristics of cystic biliary atresia[J]. Chin J Med Imaging Technol, 2019, 35(1): 86-90. DOI:10.13929/j.1003-3289.201806133 |
| [20] |
Schooler GR, Mavis A. Cystic biliary atresia: a distinct clinical entity that may mimic choledochal cyst[J]. Radiol Case Rep, 2018, 13(2): 415-418. DOI:10.1016/j.radcr.2018.01.025 |
| [21] |
Tyraskis A, Davenport M. Steroids after the Kasai procedure for biliary atresia: the effect of age at Kasai portoenterostomy[J]. Pediatr Surg Int, 2016, 32(3): 193-200. DOI:10.1007/s00383-015-3836-3 |
| [22] |
Shinkai M, Ohhama Y, Take H, et al. Long-term outcome of children with biliary atresia who were not transplanted after the Kasai operation: >20-year experience at a children's hospital[J]. J Pediatr Gastroenterol Nutr, 2009, 48(4): 443-450. DOI:10.1097/mpg.0b013e318189f2d5 |
| [23] |
刁美, 孙旭, 叶茂, 等. 产前诊断的无症状性胆总管囊肿手术时机的探讨[J]. 中华小儿外科杂志, 2013, 34(4): 266-270. Diao M, Sun X, Ye M, et al. Rational operative timing for prenatally diagnosed asymptomatic choledochal cysts[J]. Chin J Pediatr Surg, 2013, 34(4): 266-270. DOI:10.3760/cma.j.issn.0253-3006.2013.04.008 |
 2023, Vol. 22
2023, Vol. 22


