胆道闭锁(biliary atresia, BA)是新生儿外科常见疾病,是导致新生儿梗阻性黄疸的重要原因之一。流行病学调查显示,2015—2016年上海市新生儿BA发病率约为10.82/100 000[1]。BA发病原因尚不清楚,主要特征为肝内外胆管进行性纤维化致胆道梗阻,早期出现肝功能异常,逐渐发展成为胆汁性肝硬化、门静脉高压及肝衰竭。研究表明,BA患儿尽早接受Kasai手术可显著改善预后情况,提高自体肝存活率,降低肝移植比例,因此BA的早期诊断和治疗极为重要[2-3]。BA的临床表现与其他原因所致梗阻性黄疸相比并无显著特异度,至目前为止,除术中胆道造影外,尚无理想的早期鉴别诊断方法。而胆道造影因检查风险和成本较高,不适合黄疸患儿的早期诊断。
有学者利用Nomogram模型对黄疸患儿进行发生BA的可能性预测,在Logistic回归分析的基础上,发现患儿性别、体重、γ-谷氨酰转肽酶(gamma glutamyltransferase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)和直接胆红素(direct bilirubin, DBIL)五项指标在BA组和非BA组之间的差异有统计学意义,将其绘制成Nomogram列线图,建立了预测BA患病风险的Nomogram模型。该模型有五个变量,每个变量的值对应列线图中的点数,五个变量点数相加得到总点数,根据总点数预测BA的患病概率,以百分比的形式显示该患儿判定为BA的风险。该团队建模后通过单中心数据验证得到列线图的受试者操作特征(receiver operating characteristic, ROC)的曲线下面积(area under the curve, AUC)值为0.898,大于GGT单独诊断的AUC值(0.848)、ALP的AUC值(0.572)和DB的AUC值(0.567);列线图ROC诊断BA的灵敏度为85.7%,特异度为80.3%,均优于单项指标[4]。该团队将此研究中的Nomogram模型开发成微信小程序,在应用界面输入某一患儿的性别、体重、GGT、ALP和DB数值,可得到该患儿诊断BA的预测概率值。为了验证该Nomogram模型对BA早期诊断的准确性,本研究回顾性分析了上海交通大学医学院附属新华医院2009—2020年间收治的BA患儿临床资料,报道如下。
资料与方法 一、临床资料与研究方法回顾性分析上海交通大学医学院附属新华医院2009年1月至2020年12月收治并予手术探查、胆道造影的婴儿梗阻性黄疸病例的临床资料。纳入标准:临床资料完整,于本院行肝功能检查。排除标准:存在其他可能严重影响肝功能的疾病(如新生儿溶血、母亲肝炎病毒感染);术前即可明确诊断患有代谢性疾病(如希特林蛋白缺乏);术前即可诊断肝内胆管发育不良疾病(如阿拉吉综合征);临床资料不完整或无肝功能检查报告。本研究经上海交通大学医学院附属新华医院中心伦理委员会审核同意(编号XHEC—D—2022—157),患儿家属均签署知情同意书。
将纳入该研究的631例婴儿梗阻性黄疸患者按手术年份分组,以2015年为界,分为前期组(2009—2014年)和后期组(2015—2020年),其中前期组308例,包括BA患儿233例,非BA患儿75例,基本信息见表 1;后期组323例,其中BA患儿267例,非BA患儿56例,基本信息见表 2;此分组用于检验指标诊断BA的单因素分析。进一步将入选的631例患儿按手术时日龄分层,分为6组,包括≤50 d组115例、51~60 d组125例、61~70 d组145例、71~80 d组89例、81~90 d组48例和>90 d组109例,此分组用于评估指标早期诊断BA的准确性。
| 表 1 2009—2014年(前期组)不同分组梗阻性黄疸患儿基本情况比较 Table 1 Basic profiles of infantile obstructive jaundice children in front group |
|
|
| 表 2 2015—2022年(后期组)不同分组梗阻性黄疸患儿基本情况比较 Table 2 Basic profiles of infantile obstructive jaundice children in rear group |
|
|
收集所有患儿基本信息和肝功能检测报告,基本信息包括性别、术前体重、手术时日龄。肝功能检测统一采集空腹6 h后静脉血,由我院检验科统一检测,采用罗氏诊断产品(上海)有限公司生产的罗氏Cobas c 311全自动生化分析仪进行检测。
所有入选患儿的性别、体重、GGT、ALP和DB数值被输入复旦大学附属儿科医院开发的微信小程序“Nomogram胆道闭锁概率预测器”中,得到每例患儿的BA预测概率值,根据不同分组方式(前期组和后期组、不同手术时日龄组)分别在同一坐标系内作该预测值与患儿单一指标的ROC曲线,得到相应结果。
二、统计学处理采用SPSS 20.0进行统计分析与图表绘制。服从正态分布的计量资料采用x±s描述,组间比较采用独立样本t检验;不服从正态分布的计量资料采用M(Q1,Q3)描述,组间比较采用两独立样本Mann-Whitney U秩和检验;计数资料采用卡方检验。诊断效能采用绘制ROC曲线的AUC表示,AUC>0.5提示诊断效能有统计学意义;AUC越大,表示该指标诊断BA的准确性越高。P<0.05为差异有统计学意义。
根据ROC曲线得到各指标诊断BA的灵敏度、特异度、约登指数(约登指数=灵敏度+特异度-1),根据约登指数的最高临界点确定该指标诊断BA的最佳截断值。
结果 一、单因素分析前期组和后期组中,性别、术前体重、手术时日龄和GGT在BA患儿和非BA患儿中差异均有统计学意义(P<0.05),ALP和DB在BA患儿和非BA患儿中差异无统计学意义(P>0.05)(表 1,表 2)。
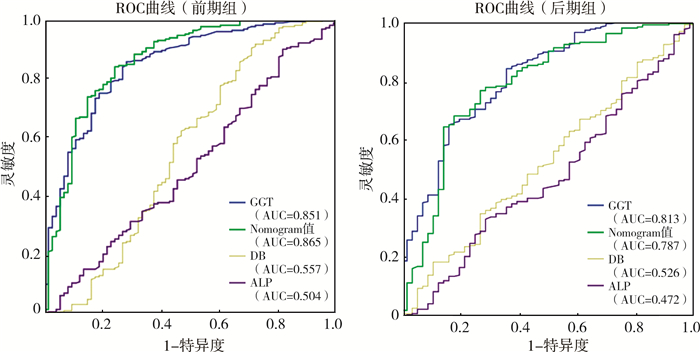
二、Nomogram模型与单一指标诊断BA的准确性分析对前期组和后期组病例经Nomogram诊断模型得到的BA预测概率和GGT、ALP和DB分别在同一坐标系内绘制ROC曲线(图 1)。前期组Nomogram模型的AUC值为0.865,GGT的AUC值为0.851;后期组Nomogram模型的AUC值为0.787,GGT的AUC值为0.813,均略低于前期组。前期组和后期组中ALP和DB的AUC值均在0.5左右(前期组DB的AUC值为0.557,ALP的AUC值为0.504;后期组DB的AUC值为0.526,ALP的AUC值为0.472),对BA的诊断无明显价值,属于混杂因素,在计算灵敏度和特异度时予以剔除。
|
图 1 Nomogram列线图预测BA的概率和单一指标诊断BA的ROC曲线 Fig.1 ROC of Nomogram value and single index in diagnosing BA 注 BA: 胆道闭锁;ROC: 受试者操作特征;GGT: γ-谷氨酰转肽酶;DB:直接胆红素;ALP: 碱性磷酸酶;AUC:曲线下面积 |
Nomogram模型在前期组的AUC值为0.865,在后期组的AUC值为0.787;GGT在前期组的AUC值为0.851,在后期组的AUC值为0.813。另外,Nomogram模型和GGT诊断BA的灵敏度在前期组(分别为84.1%和85.8%)均明显高于后期组(分别为68.2%和65.2%),相应的,前期组Nomogram模型和GGT的特异度(分别为76.0%和72.0%)均低于后期组(分别为82.1%和83.9%),但特异度的组间差距较灵敏度的组间差距小;以上数值差异均有统计学意义(P<0.05)。见表 3。
| 表 3 不同时期分组胆道闭锁患儿的诊断准确性参数 Table 3 Diagnostic accuracy parameters for different subgroups |
|
|
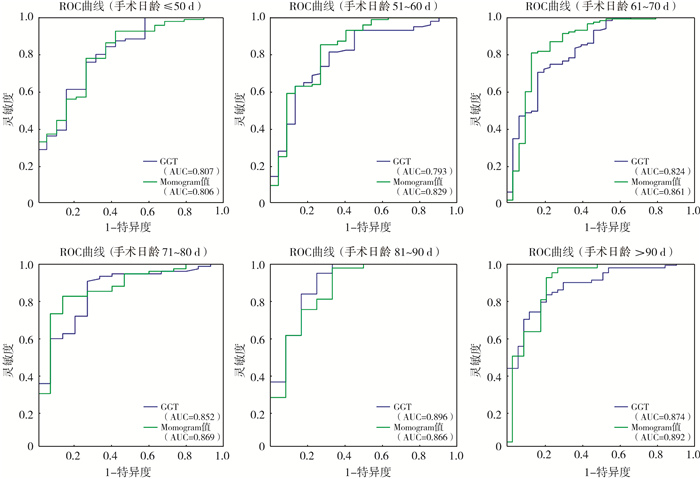
绘制每个手术时日龄层内Nomogram模型与GGT的ROC曲线(图 2),各手术日龄分层患儿基本情况见表 4。在手术时日龄≤50 d时Nomogram模型的AUC值为0.806、GGT的AUC值为0.807;手术时日龄61~70 d时GGT诊断BA的特异度为83.3%,Nomogram模型的特异度为86.7%;手术时日龄81~90 d时Nomogram模型的AUC值为0.866、GGT的AUC值为0.896,此时GGT和Nomogram模型诊断BA的灵敏度均为各手术时日龄分层最高数值,分别为94.4%和97.2%(表 5)。
|
图 2 不同手术日龄分层下Nomogram值与GGT诊断BA的ROC曲线 Fig.2 ROC of Nomogram value and GGT in different days 注 GGT: γ-谷氨酰转肽酶;ROC: 受试者操作特征;AUC:曲线下面积;BA: 胆道闭锁 |
| 表 4 按手术时日龄分层的梗阴性黄疸患儿基本情况比较[M(Q1,Q3), U/L] Table 4 Basic profiles of cases stratified by day age[M(Q1, Q3), U/L] |
|
|
| 表 5 不同日龄分层的胆道闭锁患儿诊断准确性参数 Table 5 Diagnostic accuracy parameters for different age strata |
|
|
BA作为新生儿梗阻性黄疸的病因之一,若不及时诊治,肝功能会出现进行性恶化,最终出现肝硬化、肝衰竭,导致死亡。从新生儿梗阻性黄疸病例中尽早鉴别BA,可以使患儿在肝功能发生不可逆损害之前完成Kasai手术,保证胆汁引流的通畅,改善患儿预后。肝功能是诊断BA最常用的实验室检查方法,其中GGT可有效反映胆管损伤,DB可反映胆汁淤积程度,然而胆汁淤积症和BA症状相似,异常检验指标也相仿,无法通过单一检验或检查指标很好地区分二者[5-7]。更有学者对黄疸患儿进行血液质谱检测,通过分析胆汁酸含量变化来诊断BA患儿,但因成本高昂难以推广,且往往因反复检查或诊断性治疗等延误了BA的早期诊断[8-9]。诸多学者也在不断追求如何从临床常见易得的指标入手,建立不同的诊断模型,弥补单一指标诊断BA的不足,得到尽可能准确的BA早期诊断方式。
本研究是在复旦大学附属儿科医院建立的早期诊断BA的Nomogram预测模型基础上,代入我院单中心数据进行验证的。文献报道该模型诊断BA的灵敏度为85.7%,特异度为80.3%,优于单项指标的诊断价值。本研究发现,在列线图模型中代入我院儿外科近12年的资料后,前期组中BA诊断的AUC值高于后期组,前期组BA诊断的灵敏度也高于后期组。GGT单一指标诊断BA得到的结果也是如此。另外,Nomogram模型与GGT单独诊断BA的对比中,Nomogram模型的AUC值相较于GGT无显著优势,甚至在后期组中Nomogrm模型的AUC值明显低于GGT的AUC值。这两项指标诊断BA的灵敏度和特异度在同一组内数值区别不大,且数值差异无统计学意义(P>0.05)。这说明Nomogram在诊断BA方面较GGT单独诊断无显著优势,但相较于其余单一指标(如ALP、DB等),该模型的诊断优势较为明显。
仔细对比本部分研究病例的基本信息与文献内容,发现我院前期组病例手术时日龄为70(59, 89)d,后期组病例手术时日龄为62(50, 74)d,而文献中为71(57, 85)d。我院近6年来通过接诊更多的BA患儿积累了更多的诊治经验,将BA患儿的诊断日龄中位数提前了8 d,较文献报道提前了9 d。笔者考虑这可能是导致前期组和后期组诊断效能差异的原因之一。
进一步对前期组和后期组的相关参数进行检验,发现除Nomogram模型和GGT外,ALP、DB、手术时日龄和术前体重在两组之间的差异均有统计学意义。考虑到术前体重与手术时日龄的相关性,推测导致两组之间Nomogram差异的最主要原因可能是手术时日龄不同。文献中强调Nomogram列线图模型对BA患儿的早期诊断效果较好,这与本研究结论存在出入。
为验证上述推测,我们又将入组患儿按手术时日龄进行分层,分别评估不同日龄下Nomogram模型和GGT的诊断效能。结果显示,Nomogram模型诊断BA的ROC曲线中AUC值总体优于GGT单独诊断,但仅在51~60 d和61~70 d的亚组内Nomogram模型的AUC明显高于GGT单独诊断,而在患儿手术时日龄≤50 d及在81~90 d时却出现了Nomogram模型的AUC低于GGT的现象。据此推测在某些日龄组的黄疸患儿中,采用Nomogram模型对BA患儿进行预测并无显著优势,甚至可能不利于早期诊断。当然,由于早期诊断的病例数较少,ROC曲线存在过拟合引起误差增大可能,这需要进一步增大样本、细分手术时日龄加以验证。
BA的早期诊断方式一直是研究的热点,目前较为热门的Nomogram列线图概率预测模型有较为理想的灵敏度和特异度,且高于单一指标的诊断效能。该工具可以综合单一指标的优势,进行科学拟合后达到较为理想的诊断效果,但是在临床应用中较为繁琐,需临床医师将检验、检查指标综合计算,得到可能的疾病风险概率。在症状较为典型的黄疸患儿中,使用该工具增加了临床医师的工作量,其效果与单一指标相比并无优势,这也是此类工具的不完美之处。单一指标对BA的诊断较为简单方便,医生可直接得到结果进行判断,但由于BA的特殊性,或许仍需结合多项指标综合判断以排除假阳性报告结果。诊断模型的建立和单一指标的诊断应是相辅相成的,可结合实际情况两者取其优。
本研究表明,在早期诊断方面,该Nomogram列线图模型尚有不足之处,对80 d以上日龄患儿的诊断有一定优势,对小于50 d日龄的患儿诊断结果不甚理想。该团队于2021年更新了Nomogram列线图的纳入指标,加入了超声检查中的胆囊和胆管情况[10]。这或许是一个更为有效的诊断模型,但也只基于单中心的临床经验,需进一步验证。除了常规临床指标外,非常规的血液检查如微小RNA、胆汁酸谱、基质金属蛋白酶7等对BA的诊断也有一定价值,目前仍在不断探索中[11-14]。20世纪90年代日本首先使用并推广婴儿粪便比色卡筛选BA,并建立BA的三级诊断模式,取得较为理想的效果,已被较多国家和地区采用,我国大陆地区也有相关临床研究,但整体推广度不够[15]。另有文献报道BA诊断的三级风险算法,以肝脏弹性超声、肝门三角征、胆囊异常、GGT和陶土色粪便将患儿分为BA高、中、低风险,其中高风险或低风险对BA诊断的敏感度为98.7%,特异度为91.4%[16]。肝脏超声和肝脏弹性显像等检查对操作医生的能力要求较高,不同医疗机构间可能因超声医生经验或检查探头品质等原因导致检查结果的误差,从而影响BA早期诊断模型的效能。另外,家长对患儿异常症状(如陶土色大便、皮肤黄染)的警觉程度也不尽相同,也是影响BA早期诊断的因素之一。在上述因素影响下,寻找早期诊断BA的更好方式仍然任重道远。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 刘坤慧,龚一鸣负责研究的设计、实施和起草文章;刘坤慧,龚一鸣进行病例数据收集及分析;龚一鸣,蔡威负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
沈桢, 董瑞, 汪吉梅, 等. 上海地区胆道闭锁筛查报告[J]. 中华小儿外科杂志, 2020, 41(11): 989-993. Shen Z, Dong R, Wang JM, et al. Preliminary report for screening biliary atresia in Shanghai Area[J]. Chin J Pediatr Surg, 2020, 41(11): 989-993. DOI:10.3760/cma.j.cn421158-20190507-00336 |
| [2] |
Lien TH, Chang MH, Wu JF, et al. Effects of the infant stool color card screening program on 5-year outcome of biliary atresia in Taiwan[J]. Hepatology, 2011, 53(1): 202-208. DOI:10.1002/hep.24023 |
| [3] |
吕成超, 肖静, 向义, 等. 小儿胆道闭锁手术日龄的危险因素分析及策略[J]. 肝胆外科杂志, 2020, 28(3): 190-193. Lyu CC, Xiao J, Xiang Y, et al. Analysis and strategy of risk factors for operative day age of biliary atresia[J]. J Hepatobiliary Surg, 2020, 28(3): 190-193. DOI:10.3969/j.issn.1006-4761.2020.03.008 |
| [4] |
Dong R, Jiang JY, Zhang SH, et al. Development and validation of novel diagnostic models for biliary atresia in a large cohort of Chinese patients[J]. E Bio Medicine, 2018, 34: 223-230. DOI:10.1016/j.ebiom.2018.07.025 |
| [5] |
Chen XL, Dong R, Shen Z, et al. Value of gamma-glutamyl tran-speptidase for diagnosis of biliary atresia by correlation with age[J]. J Pediatr Gastroenterol Nutr, 2016, 63(3): 370-373. DOI:10.1097/MPG.0000000000001168 |
| [6] |
Rendón-Macías ME, Villasís-Keever MA, Castañeda-Muciño G, et al. Improvement in accuracy of gamma-glutamyl transferase for differential diagnosis of biliary atresia by correlation with age[J]. Turk J Pediatr, 2008, 50(3): 253-259. |
| [7] |
姜璟, 具钊汝, 孙颖华, 等. 剪切波弹性成像诊断胆道闭锁价值的Meta分析[J]. 临床小儿外科杂志, 2021, 20(2): 126-132. Jiang JY, Ju ZR, Sun YH, et al. Application of shear wave elastography for diagnosing biliary atresia: a Meta-analysis[J]. J Clin Ped Sur, 2021, 20(2): 126-132. DOI:10.12260/lcxewkzz.2021.02.005 |
| [8] |
Zhou KJ, Wang J, Xie GX, et al. Distinct plasma bile acid profiles of biliary atresia and neonatal hepatitis syndrome[J]. J Proteome Res, 2015, 14(11): 4844-4850. DOI:10.1021/acs.jproteome.5b00676 |
| [9] |
Zhou KJ, Xie GX, Wang J, et al. Metabonomics reveals metabolite changes in biliary atresia infants[J]. J Proteome Res, 2015, 14(6): 2569-2574. DOI:10.1021/acs.jproteome.5b00125 |
| [10] |
Dai SY, Sun YQ, Wu Y, et al. Development and assessment of screening nomogram for biliary atresia based on hepatobiliary ultrasonographic features[J]. Front Pediatr, 2021, 9: 625451. DOI:10.3389/fped.2021.625451 |
| [11] |
Huang CC, Chuang JH, Chou MH, et al. Matrilysin (MMP-7) is a major matrix metalloproteinase upregulated in biliary atresia-associated liver fibrosis[J]. Mod Pathol, 2005, 18(7): 941-950. DOI:10.1038/modpathol.3800374 |
| [12] |
Kerola A, Lampela H, Lohi J, et al. Increased MMP-7 expression in biliary epithelium and serum underpins native liver fibrosis after successful portoenterostomy in biliary atresia[J]. J Pathol Clin Res, 2016, 2(3): 187-198. DOI:10.1002/cjp2.50 |
| [13] |
罗腾飞, 胡文胜. 超高效液相色谱-串联质谱法同时测定15种胆汁酸的方法分析[J]. 检验医学与临床, 2018, 15(16): 2412-2415. Luo TF, Hu WS. Analysis of simultaneous detection of 15 bile acids in human sera by ultra-performance liquid chromatography-tandem mass spectrometry[J]. Lab Med Clin, 2018, 15(16): 2412-2415. DOI:10.3969/j.issn.1672-9455.2018.16.016 |
| [14] |
Xiao YT, Liu RP, Li XJO, et al. Long noncoding RNA H19 contributes to cholangiocyte proliferation and cholestatic liver fibrosis in biliary atresia[J]. Hepatology, 2019, 70(5): 1658-1673. DOI:10.1002/hep.30698 |
| [15] |
Gu YH, Yokoyama K, Mizuta K, et al. Stool color card screening for early detection of biliary atresia and long-term native liver survival: a 19-year cohort study in Japan[J]. J Pediatr, 2015, 166(4): 897-902.e1. DOI:10.1016/j.jpeds.2014.12.063 |
| [16] |
Chen Y, Zhao DY, Gu SL, et al. Three-color risk stratification for improving the diagnostic accuracy for biliary atresia[J]. Eur Radiol, 2020, 30(7): 3852-3861. DOI:10.1007/s00330-020-06751-7 |
 2023, Vol. 22
2023, Vol. 22


