2. 首都儿科研究所附属儿童医院外科, 北京 100020;
3. 长春市儿童医院外科, 长春 130061;
4. 哈尔滨市儿童医院外科, 哈尔滨 150010;
5. 河北医科大学第二医院中心实验室, 石家庄 050000
2. Department of Surgery, Capital Institute of Pediatrics Affiliated Children's Hospital, Beijing 100020, China;
3. Department of Surgery, Municipal Children's Hospital, Chang Chun 130061, China;
4. Department of Surgery, Harbin Children's Hospital, Harbin 150010, China;
5. Department of Central Labarotory, Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
小肠闭锁是先天性消化道畸形的常见类型和新生儿肠梗阻常见原因,确切发病机制目前尚不清楚。已有研究显示肠壁组织黏膜层高表达促炎症因子,包括肿瘤坏死因子(tumor necrosis factor-alpha, TNF-α),可进一步诱导巨噬细胞炎症因子蛋白(macrophage inflammatory protein-alpha, MIP-α)的表达,通过配体介导树突状细胞进行抗原呈递和效应性/记忆性T/B淋巴细胞再进行免疫应答与调控[1-2]。由于炎症调控异常伴随胚胎或新生儿组织结构发生过程,影响组织代谢和凋亡,提示促使TNF-α上调表达的上游分子信号通路可能引起炎症-凋亡平衡调控异常,从而导致隔膜组织胚胎期残留液泡的发育和形成。此前本课题组已观察和描述了Ⅰ型肠闭锁肠隔膜组织内胚胎期残留液泡的形态[3]。在此基础上证实隔膜组织内Toll样信号通路(Toll-like Receptor Signaling Pathway, TLRs)中TLR4分子高表达,通过与MyD88分子结合诱导IκB磷酸化,并促使炎症蛋白因子转录和表达,即上游TLR4-MyD88依赖性途径参与了信号转导和调控下游炎症信号通路,从而引起胚胎期隔膜组织黏膜层炎症反应的激活[4]。
与其他TLRs家族成员不同的是,TLR4可以同时调控MyD88依赖性途径或MyD88非依赖性途径,实施信号转导和调控下游信号通路,并通过连接蛋白及其远端调控分子的调控引起免疫应答和凋亡。本研究在前续TLR4-MyD88依赖性途径基础上,采用免疫组织化学技术观察Ⅰ型小肠闭锁肠腔隔膜组织黏膜层内TLR4/TRIF信号通路(即MyD88非依赖性途径)分子表达特征,探索胚胎期TRL4-TRIF依赖性信号通路与肠管再通的相关性。
资料与方法 一、实验材料双蒸水和三氯化铁溶液自行配置。磷酸盐缓冲液,多聚甲醛和枸橼酸盐溶液(Solarbio,中国),不同浓度酒精溶液(Solarbio,中国)。一抗见表 1。山羊抗兔IgG和大鼠抗小鼠IgG(Bioworld,美国),DAB检测试剂盒(中杉金桥,中国)用于免疫组织化学检查。H&E染色溶液(购于Sigma,美国)购自Sigma(美国),用于组织学形态研究。组织标本固定专用容器,快速组织处理系统(HT—3100,山东骏腾),金属包埋模具,石蜡包埋平台,切片机,染色平台。显微镜及影像系统(Olympus SZX7, Nikon, Eclipse E600,日本)用于观察和拍摄。
| 表 1 本研究所用单/多克隆抗体 Table 1 Single/polyclonal antibody for the present study |
|
|
所有研究程序和组织标本均遵循知情同意原则,经解放军总医院儿科医学部、解放军总医院第七医学中心伦理学委员会批准(2022—169)。患儿均采取常规开放手术,术中找到闭锁部位,于肠管近端扩张与远端狭窄交界处用刀片划开肠壁,暴露其内隔膜组织,采用组织剪贴壁完整剪取隔膜组织,放入包埋篮浸入4%多聚甲醛溶液,24 h后转入70%酒精溶液内。收集16例患儿组织标本(解放军总医院第七医学中心八一儿童医院1例,首都儿科研究所1例,河北医科大学第二医院6例,哈尔滨市儿童医院5例,长春市儿童医院3例),均为术中证实的Ⅰ型肠闭锁隔膜组织。患儿手术年龄为出生后1~3 d,其中空肠闭锁13例(男5例,女8例),回肠闭锁3例(男1例,女2例)。组织标本转入快速组织处理系统进行脱水、透明、浸蜡后备用。本研究采用免疫组化技术观察和比较新生儿正常肠壁和Ⅰ型肠闭锁隔膜组织黏膜层内TRIF通路内重要分子的表达特征。
三、免疫组织化学染色连续切片(切片厚度为4 μm),室温放置5 min待切片恢复室温并干燥。PBS清洗3次(每次5 min)。3% H2O2阻断内源性过氧化物酶室温孵育10 min,PBS清洗,山羊血清封闭非特异性抗原室温孵育30 min,弃血清后直接加一抗(稀释浓度见表 1),于4℃冰箱内孵育过夜。第2天室温下复温20 min,PBS清洗后加二抗(生物素标记的山羊抗兔IgG)室温孵育30 min,PBS清洗后滴加辣根酶标记链霉素工作液,室温孵育30 min,PBS清洗后滴加DAB液显色。苏木素复染后用0.1%盐酸分化,2%氨水返蓝。最后切片经梯度酒精脱水、二甲苯透明后中性树胶封固,显微镜下观察。
四、半定量表达分析采用双盲法进行免疫组化半定量表达分析。普通光学显微镜下放大200倍,棕黄色颗粒为阳性蛋白表达,隔膜组和正常对照组每组16例,每例染色随机取4个视野(非肌肉区域),应用图像分析软件Image pro plus 6.0测量积分光密度(IOD)和面积(Area)并计算出平均吸光度(A)(OD)。OD=IOD/Area。
五、统计学处理采用SPSS 18.0处理数据,用Prism6.0作图,用Image pro plus分析免疫组化平均光密度。计量资料用x±s表示,两组间均数比较采用独立样本t检验,P < 0.05为差异有统计学意义。
结果正常肠壁黏膜层腺体内干扰素β抗体(interferon-β, TRIF)分子低表达,腺体外组织内TRIF分子散在表达,量微;隔膜组织黏膜层内未见典型腺体,黏膜绒毛倒伏,杯状细胞内未见TRIF分子表达,组织间隙内TRIF分子表达明显,与正常新生儿肠壁黏膜层比较,隔膜组织黏膜层TRIF分子表达显著(图 1)。进一步观察TRAF3分子的表达特征,在正常肠壁内,TRAF3分子表达特征同TRIF分子,隔膜组织黏膜层内TRAF3分子表达显著(图 2)。
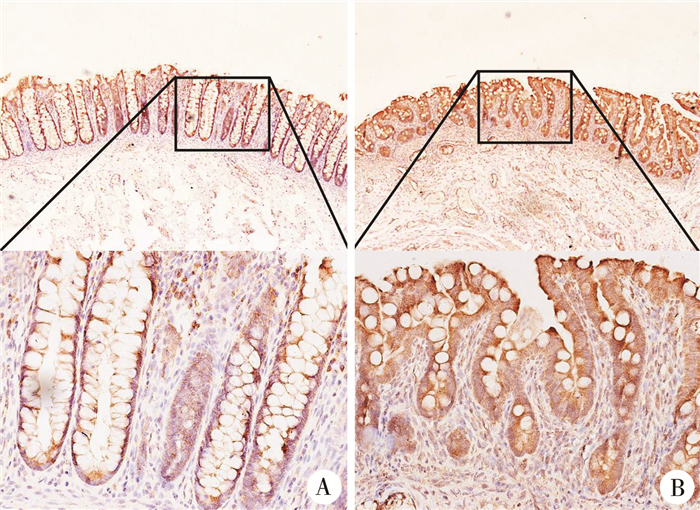
|
图 1 Ⅰ型肠闭锁隔膜组织中TRIF的表达 Fig.1 Expression of TRIF in diaphragmatic tissue of type Ⅰ intestinal atresia 注 A:正常肠壁, HE染色,×40;B:隔膜组织, HE染色,×200 |
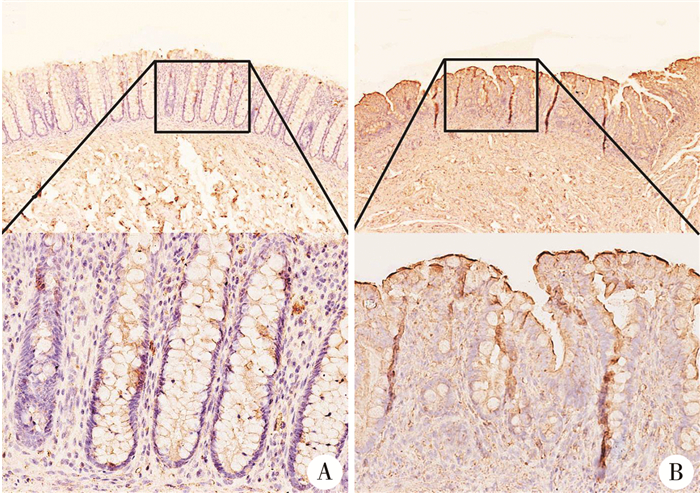
|
图 2 Ⅰ型肠闭锁隔膜组织TRAF3表达 Fig.2 Expression of TRAF3 in diaphragmatic tissue of type Ⅰ intestinal atresia 注 A:正常肠壁, HE染色,×40;B:隔膜组织, HE染色,×200 |
由于TRIF通路激活最终将介导核内转录和表达干扰素(Interferon, IFN)分子,因此我们进一步检测两种组织内IFN-β和IFN-λ1的表达特征。隔膜组织黏膜层IFN-β和IFN-λ1分子表达较正常新生儿肠壁黏膜层显著(图 3、图 4)。采用半定量检测进一步证实,TRIF、TRAF3、IFN-β和IFN-λ1分子在隔膜组织黏膜层表达增多,见表 2。
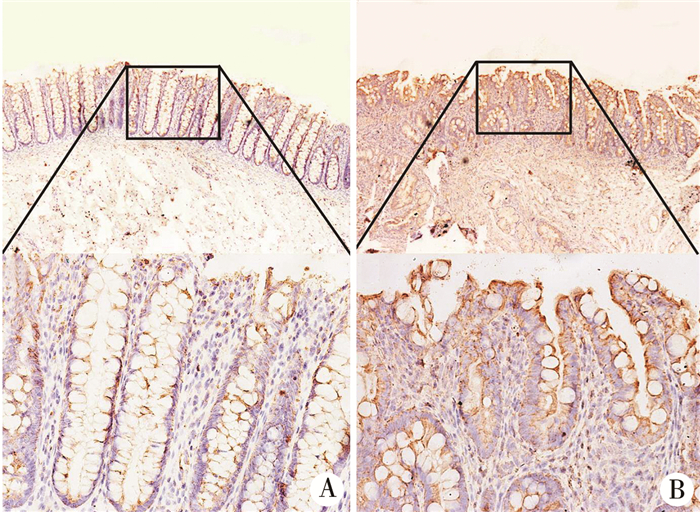
|
图 3 Ⅰ型肠闭锁隔膜组织IFN-β表达 Fig.3 Expression of IFN-β in type Ⅰintestinal atresia diaphragm 注 A:正常肠壁, HE染色,×40;B:隔膜组织, HE染色,×200 |
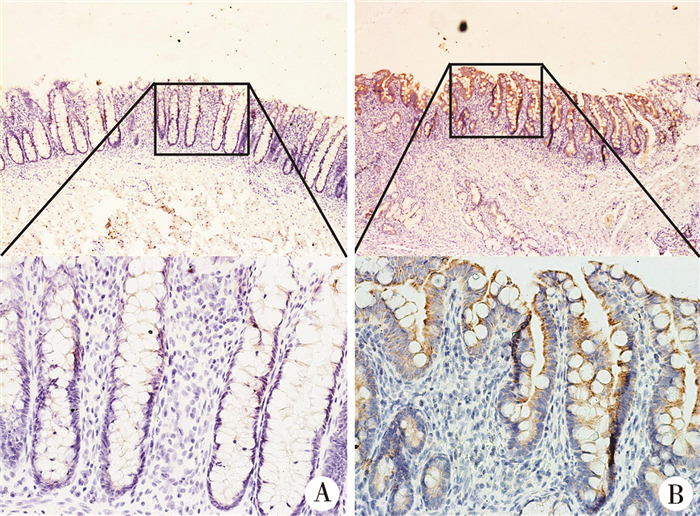
|
图 4 Ⅰ型肠闭锁隔膜组织IFN-λ1表达 Fig.4 Expression of IFN-λ1 in type Ⅰ intestinal atresia diaphragm 注 A:正常肠壁, HE染色,×40;B:隔膜组织, HE染色,×200 |
| 表 2 Ⅰ型肠闭锁隔膜组织与正常肠壁免疫组化半定量检测结果(x±s) Table 2 Semi-quantitative immunohistochemical test results of type Ⅰ intestinal atresia diaphragm tissue and normal intestinal wall(x±s) |
|
|
胚胎肠管充实期的再通障碍是解释小肠闭锁病因的假说之一。该学说认为:胚胎发育第5周时胚胎肠管已形成一个贯通的管腔,随后肠管上皮细胞增殖形成上皮栓(epithelial plug)导致管腔阻塞,形成暂时性充实期;胚胎第6~7周时闭塞管腔内出现很多胚胎液泡,并逐步扩大、融合;至胚胎第12周时肠腔再贯通,形成真正意义的肠道管腔[5-6]。而发生在胚胎8~12周的各种原因所致的再通停止或管腔再通不全,形成闭锁或狭窄[7-8]。前期研究中我们已在Ⅰ型肠闭锁, 肠隔膜组织内观察到残留液泡,作为胚胎时期肠腔再通过程发育残迹,对其形态特征进行描述并为再通障碍学说提供了初步的组织学依据[3]。目前已有研究显示肠壁组织黏膜层高表达TNF-α等促炎症因子,并可进一步诱导MIP-α表达,通过配体介导树突状细胞进行抗原呈递,效应/记忆性T/B淋巴细胞再进行免疫应答和调控[1-2]。由于炎症-凋亡调控异常参与了胚胎或新生儿组织结构的发生,炎症介质异常表达可能导致胚胎闭塞管腔内液泡凋亡的延迟甚至停滞,从而导致残留液泡发生和隔膜组织形成[9]。因此促使TNF-α表达上调的上游炎症信号通路调控异常可能参与了隔膜组织胚胎期残留液泡的发育和形成。
TLRs是介导天然免疫的信号通路,在免疫应答及炎性反应中起关键作用。TLRs不仅和感染性疾病相关,而且和一些炎性或自身免疫应答异常性疾病相关。已有研究显示肠上皮细胞TLRs信号通路激活在促炎反应中发挥关键作用[10-11]。前续课题组发现隔膜组织黏膜层TLRs中TLR4分子高表达,通过与MyD88分子结合诱导IB磷酸化,并促使炎症蛋白因子转录和表达[4]。这也证实TLR4-MyD88依赖性途径参与了胚胎期隔膜组织黏膜层炎症反应的激活。TLR4分子可同时调控MyD88依赖性途径或MyD88非依赖性途径,实施信号转导和调控下游信号,通过不同的桥接蛋白Mal和TRAM介导远端调控分子的调控,引起免疫应答和凋亡[12-13]。本研究结果显示,隔膜组织黏膜层较正常肠壁黏膜层TRIF、TRAF3、IFN-β和IFN-λ1均高表达,结合此前隔膜组织黏膜层TLR4高表达,提示TLR4/TRIF信号通路参与了Ⅰ型小肠闭锁肠腔隔膜组织黏膜层内炎症反应的激活[4];也提示TLR4支配的双信号通路在胚胎期参与了隔膜组织的发生和形成。但本研究为体内研究,我们尚无法在体外研究中准确模拟Ⅰ型小肠闭锁的形成过程,因此本研究无法通过细胞实验来探索TLR4/TRIF信号通路参与Ⅰ型小肠闭锁的形成,以及分析信号传导通路的改变情况。后续研究中,我们将聚焦TNF-α和MIP-α的表达情况,探索和比较上述双信号通路在隔膜组织内介导树突状细胞进行抗原呈递和效应性/记忆性T/B淋巴细胞进行免疫应答以及调控过程中可能存在的异常。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 高鹏负责研究的设计、实施和起草文章;崔钊、宋岩彪、李艳云进行病例数据收集及分析;刘雪来负责研究设计与酝酿,并对文章知识性内容进行审阅
| [1] |
Sahasrabudhe NM, Dokter-Fokkens J, de Vos P. Particulate β-glucans synergistically activate TLR4 and Dectin-1 in human dendritic cells[J]. Mol Nutr Food Res, 2016, 60(11): 2514-2522. DOI:10.1002/mnfr.201600356 |
| [2] |
Yao SY, Xu MK, Li YS, et al. Staphylococcal enterotoxin C2 stimulated the maturation of bone marrow derived dendritic cells via TLR-NFκB signaling pathway[J]. Exp Cell Res, 2018, 370(2): 237-244. DOI:10.1016/j.yexcr.2018.06.024 |
| [3] |
刘雪来, 曹学会, 宋岩彪, 等. 先天性小肠Ⅰ型闭锁胚胎期再贯通残留液泡的组织学形态观察[J]. 中华小儿外科杂志, 2019, 40(3): 241-244. Liu XL, Cao XH, Song YB, et al. Histological observations of septum from type Ⅰ intestinal atresia and residual vacuoles during recanalization in fetal period[J]. Chin J Pediatr Surg, 2019, 40(3): 241-244. DOI:10.3760/cma.j.issn.0253-3006.2019.03.010 |
| [4] |
刘雪来, 李龙, 谢向辉, 等. TLR4、MyD88、TRAF6和IRAK4分子在Ⅰ型小肠闭锁隔膜组织中表达的研究[J]. 中华小儿外科杂志, 2021, 42(11): 1020-1025. Liu XL, Li L, Xie XH, et al. Expressions of TLR4, MyD88, TRAF6 and IRAK4 in septum derived from type I intestinal atresia[J]. Chin J Pediatr Surg, 2021, 42(11): 1020-1025. DOI:10.3760/cma.j.cn421158-20200307-00148 |
| [5] |
Adams SD, Stanton MP. Malrotation and intestinal atresias[J]. Early Hum Dev, 2014, 90(12): 921-925. DOI:10.1016/j.earlhumdev.2014.09.017 |
| [6] |
Langer JC. Intestinal rotation abnormalities and midgut volvulus[J]. Surg Clin North Am, 2016, 97(1): 147-159. DOI:10.1016/j.suc.2016.08.011 |
| [7] |
Morris G, Kennedy A Jr, Cochran W. Small bowel congenital anomalies: a review and update[J]. Curr Gastroenterol Rep, 2016, 18(4): 16. DOI:10.1007/s11894-016-0490-4 |
| [8] |
Batra A, Keys SC, Johnson MJ, et al. Epidemiology, management and outcome of ultrashort bowel syndrome in infancy[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(6): F551-F556. DOI:10.1136/archdischild-2016-311765 |
| [9] |
Rigante D. New mosaic tiles in childhood hereditary autoinflammatory disorders[J]. Immunol Lett, 2018, 193: 67-76. DOI:10.1016/j.imlet.2017.11.013 |
| [10] |
Mohan S, Gupta D. Crosstalk of toll-like receptors signaling and Nrf2 pathway for regulation of inflammation[J]. Biomed Pharmacother, 2018, 108: 1866-1878. DOI:10.1016/j.biopha.2018.10.019 |
| [11] |
Kim S, Joe Y, Surh YJ, et al. Differential regulation of toll-like receptor-mediated cytokine production by unfolded protein response[J]. Oxid Med Cell Longev, 2018, 2018: 9827312. DOI:10.1155/2018/9827312 |
| [12] |
Pang Z, Junkins RD, Raudonis R, et al. Regulator of calcineurin 1 differentially regulates TLR-dependent MyD88 and TRIF signaling pathways[J]. PLoS One, 2018, 13(5): e0197491. DOI:10.1371/journal.pone.0197491 |
| [13] |
肖尚杰, 杨文熠, 朱小春, 等. 腹腔镜治疗54例新生儿先天性十二指肠梗阻的疗效分析[J]. 临床小儿外科杂志, 2019, 18(2): 141-146. Xiao SJ, Yang WY, Zhu XC, et al. Analysis of laparoscopic diagnosis and treatment for congenital duodenal obstruction in neonates: a report of 54 cases[J]. J Clin Ped Sur, 2019, 18(2): 141-146. DOI:10.3969/j.issn.1671-6353.2019.02.014 |
 2023, Vol. 22
2023, Vol. 22


