原发性梗阻型巨输尿管是小儿泌尿外科常见疾病,是新生儿肾积水的第二常见病因。输尿管末端狭窄可造成肾、输尿管积水,严重者可导致分肾功能受损。研究表明,大部分原发性梗阻型巨输尿管无需手术治疗,其所致上尿路积水可自行缓解;仅部分严重梗阻病例需要手术。传统手术方案为开放或腹腔镜下输尿管再植术,包括Cohen-Ahmed术、Lich-Gregoir术、Politano-Leadbetter术。但输尿管再植术历时长,膀胱刺激症状重,且1岁以下婴幼儿手术难度大。内镜下球囊扩张术是近年来兴起的一项新技术,与传统输尿管再植术相比具有操作简单、恢复快等优势。国外回顾性研究表明,球囊扩张术的短期及远期疗效均显著[1-3]。然而,至今为止尚无基于中国人群的随访数据,更缺乏前瞻性随机对照研究证明球囊扩张术的治疗效果优于传统手术方案。由上海儿童医学中心泌尿外科牵头开展的一项球囊扩张术治疗原发性梗阻型巨输尿管的多中心研究中,第一阶段工作主要是回顾性分析实施球囊扩张术治疗的患儿病例资料,并随访其疗效,探讨该术式的可行性及安全性。
资料与方法 一、一般资料本研究经上海儿童医学中心伦理委员会审核批准(SCMCIRB — K2019082 — 2)。所有患儿均由监护人签署知情同意书。共41例患儿纳入研究,其中单侧40例、双侧1例。病例纳入标准:①输尿管扩张直径>10 mm,且利尿肾图提示存在梗阻,放射性核素半排时间超过20 min;②上尿路扩张合并肾功能下降超过10%;③上尿路扩张出现临床症状或合并结石。手术前均行排泄性膀胱造影排除输尿管反流。存在尿路感染者予抗感染治疗,待尿培养阴性后择期手术。完善相关影像学检查,包括泌尿系B超、核磁共振、同位素分肾功能检查。收集术前憋尿情况下肾盂前后径、输尿管最宽径以及分肾功能。
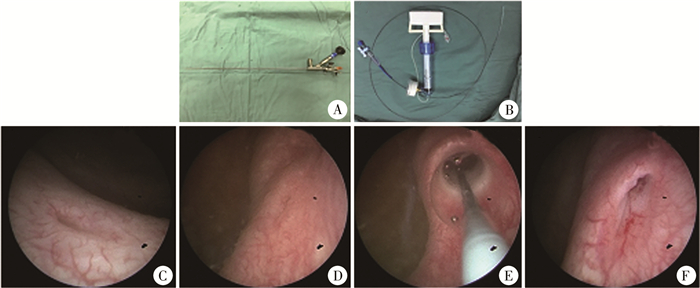
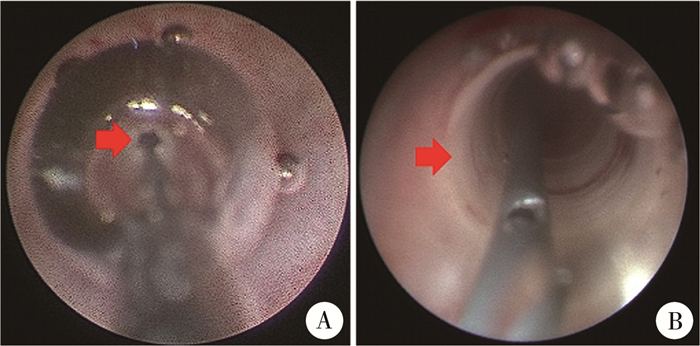
二、手术方式手术均采用6/7.8F输尿管硬镜(图 1A)及配套影像设备。球囊导管为英诺伟MY04040(导管直径2.4F,球囊最大直径4 mm,球囊长度40 mm(图 1B)。输尿管镜进入膀胱后,首先探查并比较健侧与患侧输尿管开口的大小。于输尿管镜直视下将球囊导管插入至输尿管,球囊跨过狭窄段输尿管。全程直视下缓慢充入生理盐水扩张球囊,维持球囊压力为12个大气压。在扩张的同时透过球囊观察近端输尿管情况(图 1C至图 1F)。球囊被狭窄段束缚无法均匀扩张,狭窄段呈皱缩状,且无法透过球囊观察到近端输尿管管腔,提示扩张失败(图 2A)。球囊均匀扩张,可透过球囊壁观察到近端输尿管管腔,提示扩张成功(图 2B)。扩张3 min后抽尽球囊内生理盐水,沿球囊导管直接上镜,观察狭窄段长度及近端输尿管扩张情况。直视下上镜至集合系统,拔除球囊导管后留置导丝,推入DJ管,确认DJ管近端位于集合系统,远端位于膀胱内,留置导尿管,结束手术。
|
图 1 球囊扩张术治疗输尿管末端狭窄所用器械及手术过程 Fig.1 Surgical instruments and procedures of balloon dilation for primary obstructive megaureter 注 A:F6/7.8输尿管硬镜;B:直径2.4F球囊导管;C:健侧输尿管开口;D:患侧输尿管开口;E:球囊扩张术中影像;F:球囊扩张术后管口形态 |
|
图 2 球囊扩张术治疗输尿管末端狭窄效果对比图 Fig.2 Comparison of balloon dilation effect for primary obstructive megaureter 注 A:球囊扩张失败病例可见狭窄环持续存在;B:球囊扩张成功可见狭窄环均匀扩张 |
术后第2天拔除导尿管出院。DJ管留置2个月后来医院拔除。所有患儿于拔除DJ管后开始计算随访时间,每隔3个月复查1次尿常规及泌尿系B超,拔管后1年复查利尿肾图。收集术后随访时间、憋尿情况下肾盂前后径、输尿管最宽径、分肾功能,并与术前数据进行比较。
四、统计学处理采用SPSS18.0软件进行统计学分析,计量资料以x±s表示,术前、术后资料的组间比较采用配对t检验。P<0.05为差异有统计学意义。
结果共41例42侧输尿管完成输尿管球囊扩张术,其中双侧输尿管末端狭窄1例,合并患侧上尿路结石4例。仅3例分肾功能低于40%,其余患儿虽然利尿肾图提示机械性梗阻,半排时间超过20 min,但分肾功能均未见明显降低。扩张失败1例,表现为术中球囊无法均匀扩张,狭窄环持续存在(图 2A),该患儿术后拒绝行输尿管再植手术,持续随访至今33个月,肾盂前后径,输尿管最宽径及分肾功能无明显改变。因输尿管扩张导致输尿管破裂1例,该患儿术后第1天腹胀明显,B超提示腹腔大量积液,导尿管引流尿液偏少,考虑尿腹可能,遂急诊行输尿管再植术,术中见输尿管入膀胱处破裂。合并上尿路结石的4例患儿分别经一期输尿管硬镜或二期输尿管软镜取净结石。
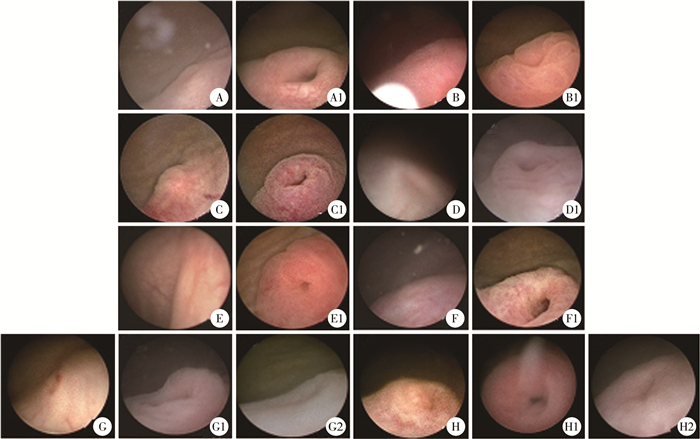
累计球囊扩张术治疗成功并获得规律随访37例,共38根输尿管。37例患儿年龄(32.9±35.7)个月,随访时间(17.2±9.5)个月,其中左侧25根,右侧13根;男19例,女18例。术前B超提示肾盂前后径(17.8±14.7)mm,最后1次随访肾盂前后径(9.7±8.9)mm,差异有统计学意义(P < 0.01);术前输尿管最宽径(13.4±2.9)mm,术后最后一次复查输尿管最宽径(7.5±6.9)mm,差异有统计学意义(P < 0.01),见表 1。球囊扩张前输尿管开口呈针尖样狭窄(图 3A至图 3H),术后2个月拔管时见患侧输尿管开口呈洞口状,黏膜光滑,无明显瘢痕组织(图 3A1至图 3H1)。2例患儿分别于术后8个月(图 3G2)、18个月(图 3H2)复查膀胱镜,见输尿管管口较拔管时无明显缩窄。
| 表 1 41例原发性梗阻型巨输尿管球囊扩张术患儿临床资料 Table 1 Case profiles of balloon dilatation children |
|
|
|
图 3 8例输尿管开口狭窄患儿球囊扩张术前及术后膀胱镜检查结果对比 Fig.3 Comparison of ureteral orifice before and after balloon dilatation 注 A~H:球囊扩张术前输尿管口形态为针尖样;A1~H1:球囊扩张术后2个月开口形态呈洞口状;G2:球囊扩张术后8个月复查见开口形态为洞口状;H2:球囊扩张术后18个月复查见开口形态为洞口状 |
原发性梗阻型巨输尿管症也称为先天性输尿管末端狭窄,是输尿管远端进入膀胱发生阻塞的疾病。正常输尿管直径为5 mm以下,英国小儿泌尿外科协会在2014年发表的共识中将输尿管直径超过7 mm定义为异常扩张的输尿管[4]。该病确切的发病原因目前尚未明确[5]。较为普遍的观点是妊娠中后期输尿管远端肌肉发育异常或延迟,导致输尿管末端蠕动功能低下造成局部梗阻[6]。也有研究表明,输尿管远心端进入壁内段和黏膜下段时会在壁内重新排列肌肉层。在发育早期,远端输尿管主要是圆形肌肉,而外层肌肉发育较晚,整个过程持续长达两年[7]。因此,临床上大部分原发性梗阻型巨输尿管患儿无需手术干预,定期随访即可观察到积水自行消退[8]。
由于原发性梗阻型巨输尿管存在自愈的可能性,因此手术时机的选择是一个严肃的科学问题,否则容易导致过度医疗。然而目前为止各医疗中心对于原发性梗阻型巨输尿管的手术指征尚缺乏一个量化的参考标准。2019版中国泌尿外科和男科疾病诊断治疗指南提出,先天性输尿管膀胱连接部梗阻的手术指征为:输尿管或肾积水持续加重,肾功能降低超过10%,合并患侧临床症状、结石、反复感染及血尿。而2021版欧洲泌尿外科疾病诊疗指南建议手术指征为:有症状且随访中发现肾功能下降或积水加重,同时该指南提到输尿管直径>10 mm时更趋向于手术干预[9]。综合以上指南建议并参考同类研究[10]。本研究纳入病例标准为输尿管直径扩张大于10 mm且利尿肾图提示存在机械性梗阻;半排时间大于20 min;上尿路扩张合并肾功能下降超过10%;上尿路扩张合并症状或结石。对不符合上述标准的患儿,我们建议门诊随访观察。
内镜治疗是原发性梗阻型巨输尿管治疗中创伤最小的方式,包括单纯留置双J管、球囊扩张、内切开等方式。双J管置入术一般仅作为1岁以下婴幼儿的临时措施,其缺点是输尿管膀胱连接部梗阻严重时可能无法置入双J管,且总体治疗效果欠佳[11-12]。内切开作为一种可选方案,虽然文献报道成功率较高,但2019版中国泌尿外科和男科疾病诊断治疗指南不推荐在婴幼儿中采用该方式[13]。球囊扩张术是近年应用较多且最有前景的一种治疗方式,创伤小,恢复快,对于1岁以下患儿没有增加手术难度。近年国外多项回顾性研究显示球囊扩张术效果良好,成功率达90%以上[14-16]。但目前尚缺乏远期效果的随访研究,最重要的是缺乏前瞻性随机对照研究证实球囊扩张术较传统再植手术更具优势。因此,迄今为止尚无指南推荐球囊扩张术作为一线方案治疗原发性梗阻型巨输尿管。我们在该项临床研究的第一阶段主要探讨了直径4 mm的球囊扩张输尿管末端狭窄的可行性及成功率,该球囊导管较细(2.4F),目前所有纳入研究的病例中,尚无一例出现无法插入输尿管开口的情况。在拔管后的随访过程中,患儿均未出现反复尿路感染的情况,因此我们没有常规进行逆行膀胱造影。这可能是由于我们采用的球囊与国外文献中普遍采用的6 mm以上球囊相比,直径更小,扩张程度更轻,因此,不足以导致扩张过度而引起症状性反流。本研究中仅3例患儿分肾功能低于40%,其余患儿虽然分肾功能尚正常,但利尿肾图中排泄曲线提示梗阻存在,且半排时间大于20 min。此外,由于部分患儿尚未复查分肾功能,因此我们尚未对分肾功能进行自身前后对照,但在平均17个月的随访过程中,憋尿情况下的输尿管最宽径和肾盂前后径分别下降了6 mm和8 mm,这是一个较为理想的结果。且在所有患儿中,有2例分别于拔管后8个月、18个月复查膀胱镜,结果显示输尿管开口黏膜光滑、无明显挛缩。后续我们将继续随访,在第一阶段工作的基础上,开展前瞻性随机对照研究,以对比研究球囊扩张术与输尿管再植术治疗原发性梗阻型巨输尿管的确切效果。
综上所述,原发性梗阻型巨输尿管是小儿泌尿外科常见疾病,球囊扩张术治疗该病具有手术时间短、创伤小、恢复快等优点,短期随访显示术后上尿路积水改善明显,但仍然需要进行前瞻性随机对照研究以进一步证实其确切疗效。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 钟量负责研究的设计、实施和起草文案,邹翔宇进行病例数据收集及分析,孙杰负责研究设计和酝酿,并对文章知识性内容进行审阅
| [1] |
Bujons A, Saldaña L, Caffaratti J, et al. Can endoscopic balloon dilation for primary obstructive megaureter be effective in a long-term follow-up?[J]. J Pediatr Urol, 2015, 11(1): 37. e1-37. e6. DOI:10.1016/j.jpurol.2014.09.005 |
| [2] |
Romero RM, Angulo JM, Parente A, et al. Primary obstructive megaureter: the role of high pressure balloon dilation[J]. J Endourol, 2014, 28(5): 517-523. DOI:10.1089/end.2013.0210 |
| [3] |
García-Aparicio L, Blázquez-Gómez E, Martin O, et al. Use of high-pressure balloon dilatation of the ureterovesical junction instead of ureteral reimplantation to treat primary obstructive megaureter: is it justified?[J]. J Pediatr Urol, 2013, 9(6Pt B): 1229-1233. DOI:10.1016/j.jpurol.2013.05.019 |
| [4] |
Farrugia MK, Hitchcock R, Radford A, et al. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter[J]. J Pediatr Urol, 2014, 10(1): 26-33. DOI:10.1016/j.jpurol.2013.09.018 |
| [5] |
倪洁, 孙颖华, 钱蔷英, 等. 彩色多普勒超声对于儿童先天性巨输尿管症的诊断价值[J]. 临床小儿外科杂志, 2013, 12(6): 445-447. Ni J, Sun YH, Qian QY, et al. Diagnostic value of color doppler ultrasound for children with congenital megaureter[J]. J Clin Ped Sur, 2013, 12(6): 445-447. DOI:10.3969/j.issn.1671-6353.2013.06.005 |
| [6] |
Nicotina PA, Romeo C, Arena F, et al. Segmental up-regulation of transforming growth factor-beta in the pathogenesis of primary megaureter: an immunocytochemical study[J]. Br J Urol, 1997, 80(6): 946-949. DOI:10.1046/j.1464-410x.1997.00486.x |
| [7] |
Pirker ME, Rolle U, Shinkai T, et al. Prenatal and postnatal neuromuscular development of the ureterovesical junction[J]. J Urol, 2007, 177(4): 1546-1551. DOI:10.1016/j.juro.2006.11.081 |
| [8] |
Di Renzo D, Aguiar L, Cascini V, et al. Long-term followup of primary nonrefluxing megaureter[J]. J Urol, 2013, 190(3): 1021-1026. DOI:10.1016/j.juro.2013.03.008 |
| [9] |
Shukla AR, Cooper J, Patel RP, et al. Prenatally detected primary megaureter: a role for extended follow-up[J]. J Urol, 2005, 173(4): 1353-1356. DOI:10.1097/01.ju.0000152319.72909.52 |
| [10] |
Teklali Y, Robert Y, Boillot B, et al. Endoscopic management of primary obstructive megaureter in pediatrics[J]. J Pediatr Urol, 2018, 14(5): 382-387. DOI:10.1016/j.jpurol.2018.05.027 |
| [11] |
Awad K, Woodward MN, Shalaby MS. Long-term outcome of JJ stent insertion for primary obstructive megaureter in children[J]. J Pediatr Urol, 2019, 15(1): 66. e1-66. e5. DOI:10.1016/j.jpurol.2018.09.011 |
| [12] |
Farrugia MK, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age[J]. J Pediatr Urol, 2011, 7(2): 198-202. DOI:10.1016/j.jpurol.2010.04.015 |
| [13] |
Kajbafzadeh AM, Payabvash S, Salmasi AH, et al. Endoureterotomy for treatment of primary obstructive megaureter in children[J]. J Endourol, 2007, 21(7): 743-749. DOI:10.1089/end.2006.0330 |
| [14] |
Ortiz R, Parente A, Perez-Egido L, et al. Long-term outcomes in primary obstructive megaureter treated by endoscopic balloon dilation.Experience after 100 cases[J]. Front Pediatr, 2018, 6: 275. DOI:10.3389/fped.2018.00275 |
| [15] |
Kassite I, Renaux Petel M, Chaussy Y, et al. High pressure balloon dilatation of primary obstructive megaureter in children: a multicenter study[J]. Front Pediatr, 2018, 6: 329. DOI:10.3389/fped.2018.00329 |
| [16] |
Casal Beloy I, Somoza Argibay I, García González M, et al. Endoscopic balloon dilatation in primary obstructive megaureter: long-term results[J]. J Pediatr Urol, 2018, 14(2): 167. e1-167. e5. DOI:10.1016/j.jpurol.2017.10.016 |
 2023, Vol. 22
2023, Vol. 22


